解题方法
1 . 以含锌废液(主要成分为ZnSO4,含少量的Fe2+、Mn2+)为原料制备ZnCO3·2Zn(OH)2的实验流程如下。下列说法不正确的是
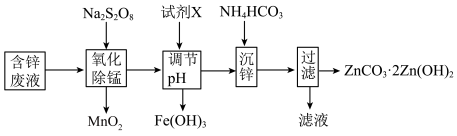
(已知:过二硫酸根的结构式:  )
)
| A.过二硫酸钠(Na2S2O8)中硫的化合价为+7价 |
B.氧化除锰后的溶液中一定存在:Na+、Zn2+、Fe3+、SO |
| C.调节pH时试剂X可以选用ZnO、ZnCO3等物质 |
D.氧化除锰过程中生成MnO2的离子方程:Mn2++S2O +2H2O=MnO2↓+2SO +2H2O=MnO2↓+2SO +4H+ +4H+ |
您最近半年使用:0次
2 . 下列离子方程式正确的是
A.酸性高锰酸钾溶液中滴双氧水褪色:2MnO +7H2O2+6H+=2Mn2++10H2O+6O2↑ +7H2O2+6H+=2Mn2++10H2O+6O2↑ |
| B.向红色Fe(SCN)3溶液中加入过量铁粉:2Fe3++Fe=3Fe2+ |
| C.氯化银中滴加浓氨水:2NH3+AgCl=Ag(NH3)2Cl |
D.明矾溶液中加入过量NaOH溶液:Al3++4OH-=AlO +2H2O +2H2O |
您最近半年使用:0次
3 . 酸浸法回收废炉渣中(主要为铜、钴、镍、铁等金属元素的氧化物)的铜、钴、镍的流程如下: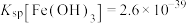 ,
, .
.
(1)“磨细”过程的目的是____________ .
(2)酸浸液中大量铁元素以 存在,加入
存在,加入 可减少铁屑的消耗从而降低成本,
可减少铁屑的消耗从而降低成本, 与
与 反应过程中会产生气泡,其离子方程式为
反应过程中会产生气泡,其离子方程式为____________ .
(3)“滤渣2”主要成分为______ (填化学式)。
(4)“镍钴分离”过程 发生反应的离子方程式为
发生反应的离子方程式为____________ .
(5)“酸溶1”过程用 替换HCl,从绿色化学角度分析其可行性
替换HCl,从绿色化学角度分析其可行性____________ 。
(6)“焙烧”过程发生反应的化学方程式为____________ 。
(7)已知当 mol⋅L
mol⋅L 时,认为其沉淀完全。“沉镍”过程的目的是为了将
时,认为其沉淀完全。“沉镍”过程的目的是为了将 .此时应调节溶液的pH为
.此时应调节溶液的pH为______ 。
(8)“操作X”采用的结晶方法为______ 。
 ,
, .
.(1)“磨细”过程的目的是
(2)酸浸液中大量铁元素以
 存在,加入
存在,加入 可减少铁屑的消耗从而降低成本,
可减少铁屑的消耗从而降低成本, 与
与 反应过程中会产生气泡,其离子方程式为
反应过程中会产生气泡,其离子方程式为(3)“滤渣2”主要成分为
(4)“镍钴分离”过程
 发生反应的离子方程式为
发生反应的离子方程式为(5)“酸溶1”过程用
 替换HCl,从绿色化学角度分析其可行性
替换HCl,从绿色化学角度分析其可行性(6)“焙烧”过程发生反应的化学方程式为
(7)已知当
 mol⋅L
mol⋅L 时,认为其沉淀完全。“沉镍”过程的目的是为了将
时,认为其沉淀完全。“沉镍”过程的目的是为了将 .此时应调节溶液的pH为
.此时应调节溶液的pH为(8)“操作X”采用的结晶方法为
您最近半年使用:0次
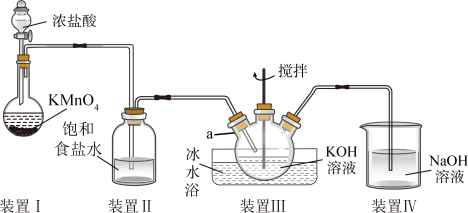
4 . 高铁酸钾(K2FeO4)是一种高效净水剂,某化学实验兴趣小组同学在实验室用如图所示装置制备K2FeO4 (夹持装置已略去)。 与KOH溶液在20℃以下反应生成KClO,在较高温度下则反应生成
与KOH溶液在20℃以下反应生成KClO,在较高温度下则反应生成 ;K2FeO4易溶于水,微溶于浓KOH溶液,在0~5℃的强碱性溶液中较稳定。
;K2FeO4易溶于水,微溶于浓KOH溶液,在0~5℃的强碱性溶液中较稳定。
已知:先制备KClO溶液,KClO再与KOH、 溶液反应制备K2FeO4。
溶液反应制备K2FeO4。
回答下列问题:
(1)进行该实验前,应先___________ 。
(2)仪器a的名称为___________ 。
(3)装置Ⅰ中发生反应的离子方程式为___________ 。
(4)装置Ⅲ的仪器a中得到足量的KClO后,将仪器a上的导管取下,依次加入KOH溶液、 溶液,水浴控制反应温度为25℃,搅拌数小时,溶液变为紫红色(含K2FeO4):
溶液,水浴控制反应温度为25℃,搅拌数小时,溶液变为紫红色(含K2FeO4):
①此时仪器a中发生反应的化学方程式为___________ 。
②该反应中每转移0.2mol电子,此时生成的K2FeO4的质量为___________ g。
(5)取提纯后的K2FeO4样品mg于烧杯中,加入强碱性亚铬酸盐溶液,反应后再加稀硫酸调节至溶液呈强酸性,配成VmL溶液,取出该溶液的四分之一于锥形瓶中,用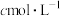 的
的 溶液滴定至终点,重复操作3次,平均消耗
溶液滴定至终点,重复操作3次,平均消耗 溶液48.00mL。涉及的主要反应为:
溶液48.00mL。涉及的主要反应为:
i.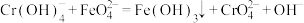 ;
;
ii. ;
;
iii. 。
。
则该K2FeO4样品的纯度为___________ (用含m、c的代数式表示,列出计算式即可)。
(6)装置Ⅳ中除了发生反应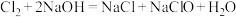 ,还有可能发生反应的离子方程式为
,还有可能发生反应的离子方程式为___________ (不考虑空气对反应的影响)。
 与KOH溶液在20℃以下反应生成KClO,在较高温度下则反应生成
与KOH溶液在20℃以下反应生成KClO,在较高温度下则反应生成 ;K2FeO4易溶于水,微溶于浓KOH溶液,在0~5℃的强碱性溶液中较稳定。
;K2FeO4易溶于水,微溶于浓KOH溶液,在0~5℃的强碱性溶液中较稳定。已知:先制备KClO溶液,KClO再与KOH、
 溶液反应制备K2FeO4。
溶液反应制备K2FeO4。回答下列问题:
(1)进行该实验前,应先
(2)仪器a的名称为
(3)装置Ⅰ中发生反应的离子方程式为
(4)装置Ⅲ的仪器a中得到足量的KClO后,将仪器a上的导管取下,依次加入KOH溶液、
 溶液,水浴控制反应温度为25℃,搅拌数小时,溶液变为紫红色(含K2FeO4):
溶液,水浴控制反应温度为25℃,搅拌数小时,溶液变为紫红色(含K2FeO4):①此时仪器a中发生反应的化学方程式为
②该反应中每转移0.2mol电子,此时生成的K2FeO4的质量为
(5)取提纯后的K2FeO4样品mg于烧杯中,加入强碱性亚铬酸盐溶液,反应后再加稀硫酸调节至溶液呈强酸性,配成VmL溶液,取出该溶液的四分之一于锥形瓶中,用
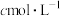 的
的 溶液滴定至终点,重复操作3次,平均消耗
溶液滴定至终点,重复操作3次,平均消耗 溶液48.00mL。涉及的主要反应为:
溶液48.00mL。涉及的主要反应为:i.
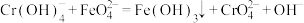 ;
;ii.
 ;
;iii.
 。
。则该K2FeO4样品的纯度为
(6)装置Ⅳ中除了发生反应
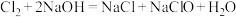 ,还有可能发生反应的离子方程式为
,还有可能发生反应的离子方程式为
您最近半年使用:0次
名校
解题方法
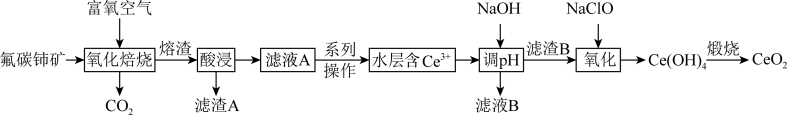
5 . 二氧化铈(CeO2)是一种典型的金属氧化物,具有较强的氧化性广泛应用于多相催化反应,并作为汽车尾气净化的三效催化剂的重要组成成分。以氟碳铈矿(主要含CeFCO3、BaO等)为原料制备CeO2的一种工艺流程如下图所示: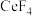 ;②滤液A中含:
;②滤液A中含: 、
、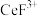 等离子。
等离子。
回答下列问题:
(1)滤渣A的主要成分是___________ (填化学式);“酸浸”不用盐酸的理由是_________ (答一点即可)。
(2)“系列操作”包含以下几个过程:已知: 不能溶于有机物TBP;
不能溶于有机物TBP;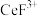 能溶于有机物TBP,且存在反应:
能溶于有机物TBP,且存在反应: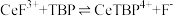 。“滤液A”中加入有机物TBP后的分离方法是
。“滤液A”中加入有机物TBP后的分离方法是___________ ,“有机层B”中发生反应的离子方程式为___________ 。水层中的一种溶质,理论上可以在工艺流程图中的_________ 工序中循环利用,减小“调pH”工序中 的用量,节约生产成本。
的用量,节约生产成本。 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于________ (已知25℃时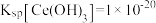 )。
)。
(4)二氧化铈立方晶胞如图所示,则铈原子Ce在晶胞中的位置是________ ;晶体中一个Ce周围与其最近的O的个数为________ 。
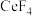 ;②滤液A中含:
;②滤液A中含: 、
、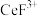 等离子。
等离子。回答下列问题:
(1)滤渣A的主要成分是
(2)“系列操作”包含以下几个过程:已知:
 不能溶于有机物TBP;
不能溶于有机物TBP;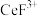 能溶于有机物TBP,且存在反应:
能溶于有机物TBP,且存在反应: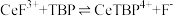 。“滤液A”中加入有机物TBP后的分离方法是
。“滤液A”中加入有机物TBP后的分离方法是 的用量,节约生产成本。
的用量,节约生产成本。
 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于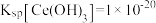 )。
)。(4)二氧化铈立方晶胞如图所示,则铈原子Ce在晶胞中的位置是
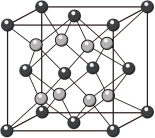
您最近半年使用:0次
名校
6 . 研究氨的制备、应用及氨氮的去除有重要意义。
(1)在固定体积的密闭容器中,进行如下化学反应: ,其平衡常数K与温度T的关系如下表。
,其平衡常数K与温度T的关系如下表。
①试判断
_______  (填写“>”“=”或“<”)
(填写“>”“=”或“<”)
②一定温度下,在 密闭容器中充入
密闭容器中充入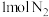 和
和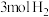 并发生反应。若容器容积恒定,
并发生反应。若容器容积恒定, 达到平衡时,气体的总物质的量为原来的
达到平衡时,气体的总物质的量为原来的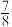 ,则
,则 的转化率
的转化率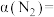
_______ ,以 表示该过程的反应速率
表示该过程的反应速率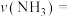
_______ 。
(2)氨的应用。以 和
和 为原料在一定温度和压强下合成尿素的反应分两步:
为原料在一定温度和压强下合成尿素的反应分两步:
I. 和
和 生成
生成 ;
;
Ⅱ. 分解生成
分解生成 。
。
反应过程中能量变化如图所示。 和
和 合成尿素反应的热化学方程式为
合成尿素反应的热化学方程式为_______ 。
②结合反应过程中能量变化示意图,下列说法正确的是_______ (填序号)。
a.活化能:反应I<反应Ⅱ
b.I为放热反应,Ⅱ为吸热反应
c.对总反应速率影响较大的是反应I
(3)氨氮的去除。下面是两种电化学除氨氮的方法。
方法一:电化学氧化法
有研究表明,当以碳材料为阴极, 可在阴极生成
可在阴极生成 ,并进一步生成氧化性更强的
,并进一步生成氧化性更强的 ,
, 可以将水中氨氮氧化为
可以将水中氨氮氧化为 。
。
①写出 去除氨气的化学反应方程式
去除氨气的化学反应方程式_______ 。
②阴极区加入 可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释
可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释 的作用
的作用_______ 。
用 溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的
溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的 转化为
转化为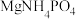 沉淀而除去。调节溶液初始
沉淀而除去。调节溶液初始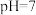 ,氨氮去除率和溶液
,氨氮去除率和溶液 随时间的变化情况如图所示。
随时间的变化情况如图所示。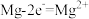 ,
, 。写出废水中生成
。写出废水中生成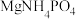 沉淀的离子方程式:
沉淀的离子方程式:_______ 。
④反应1h以后,氨氮去除率随时间的延长反而下降的原因是_______ 。
(1)在固定体积的密闭容器中,进行如下化学反应:
 ,其平衡常数K与温度T的关系如下表。
,其平衡常数K与温度T的关系如下表。| T/K | 298 | 398 | 498 |
| 平衡常数K | 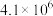 |  |  |

 (填写“>”“=”或“<”)
(填写“>”“=”或“<”)②一定温度下,在
 密闭容器中充入
密闭容器中充入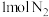 和
和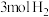 并发生反应。若容器容积恒定,
并发生反应。若容器容积恒定, 达到平衡时,气体的总物质的量为原来的
达到平衡时,气体的总物质的量为原来的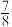 ,则
,则 的转化率
的转化率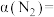
 表示该过程的反应速率
表示该过程的反应速率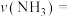
(2)氨的应用。以
 和
和 为原料在一定温度和压强下合成尿素的反应分两步:
为原料在一定温度和压强下合成尿素的反应分两步:I.
 和
和 生成
生成 ;
;Ⅱ.
 分解生成
分解生成 。
。反应过程中能量变化如图所示。

 和
和 合成尿素反应的热化学方程式为
合成尿素反应的热化学方程式为②结合反应过程中能量变化示意图,下列说法正确的是
a.活化能:反应I<反应Ⅱ
b.I为放热反应,Ⅱ为吸热反应
c.对总反应速率影响较大的是反应I
(3)氨氮的去除。下面是两种电化学除氨氮的方法。
方法一:电化学氧化法
有研究表明,当以碳材料为阴极,
 可在阴极生成
可在阴极生成 ,并进一步生成氧化性更强的
,并进一步生成氧化性更强的 ,
, 可以将水中氨氮氧化为
可以将水中氨氮氧化为 。
。①写出
 去除氨气的化学反应方程式
去除氨气的化学反应方程式②阴极区加入
 可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释
可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释 的作用
的作用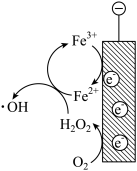
用
 溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的
溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的 转化为
转化为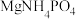 沉淀而除去。调节溶液初始
沉淀而除去。调节溶液初始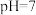 ,氨氮去除率和溶液
,氨氮去除率和溶液 随时间的变化情况如图所示。
随时间的变化情况如图所示。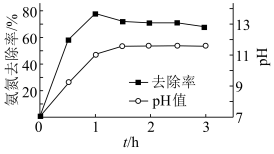
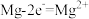 ,
, 。写出废水中生成
。写出废水中生成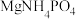 沉淀的离子方程式:
沉淀的离子方程式:④反应1h以后,氨氮去除率随时间的延长反而下降的原因是
您最近半年使用:0次
名校
7 . 燃煤产生的烟气中含有较多 、
、 、
、 等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是
等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是
 、
、 、
、 等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是
等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是A.将 通入足量的 通入足量的 溶液中,发生反应的化学方程式为 溶液中,发生反应的化学方程式为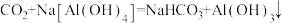 |
B.将 通入足量的酸性高锰酸钾溶液中,发生反应的离子方程式为 通入足量的酸性高锰酸钾溶液中,发生反应的离子方程式为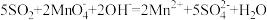 |
C.将 通入烧碱溶液中,发生反应的化学方程式为 通入烧碱溶液中,发生反应的化学方程式为 |
D.将 通入足量的次氯酸钠溶液中,发生反应的离子方程式为 通入足量的次氯酸钠溶液中,发生反应的离子方程式为 |
您最近半年使用:0次
名校
8 . 如今,半导体“硅”已经成为信息时代高科技的代名词,高纯硅是现代信息、半导体和光伏发电等产业的基础材料。制备高纯硅的主要工艺流程如图所示: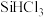 极易水解,反应过程中会产生氢气。
极易水解,反应过程中会产生氢气。
回答下列问题:
(1)二氧化硅和硅酸盐是构成地壳中大部分岩石、沙子和土壤的主要微粒, 的晶体类型为
的晶体类型为________ 。
(2)写出④的化学方程式为________ 。
(3)以上①~⑤的流程中,包含置换反应的是______ (填序号)。整个操作流程都需隔绝空气,原因是________ (答出两条即可)。
(4)氮化硼陶瓷基复合材料电推进系统及以SiC单晶制作器件,在航空航天特殊环境下具有广泛的应用前景。科学家用金属钠、四氯化碳和四氯化硅制得了SiC纳米棒,反应的化学方程式为____ 。
(5)在硅酸盐中,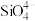 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为_____ ,其化学式为______ 。
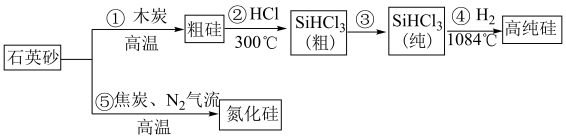
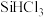 极易水解,反应过程中会产生氢气。
极易水解,反应过程中会产生氢气。回答下列问题:
(1)二氧化硅和硅酸盐是构成地壳中大部分岩石、沙子和土壤的主要微粒,
 的晶体类型为
的晶体类型为(2)写出④的化学方程式为
(3)以上①~⑤的流程中,包含置换反应的是
(4)氮化硼陶瓷基复合材料电推进系统及以SiC单晶制作器件,在航空航天特殊环境下具有广泛的应用前景。科学家用金属钠、四氯化碳和四氯化硅制得了SiC纳米棒,反应的化学方程式为
(5)在硅酸盐中,
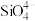 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为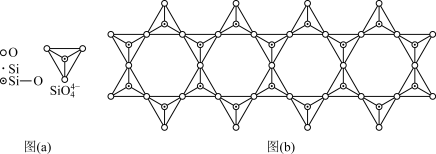
您最近半年使用:0次
9 . 采用选择性催化还原技术(SCR)可以有效脱除烟气中的氮氧化物( )。
)。
(1)钒基催化剂(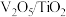 催化剂)可用于
催化剂)可用于 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示:
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示: 的总反应化学方程式为
的总反应化学方程式为___________ ,该反应的中间体有___________ 种。
②若烟气中含有硫的氧化物,则会降低 的速率,可能的原因是
的速率,可能的原因是___________ 。
(2)研究发现:当烟气中 和
和 的物质的量相同时,会发生快速SCR反应过程:
的物质的量相同时,会发生快速SCR反应过程: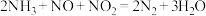 。臭氧对
。臭氧对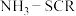 具有一定的辅助作用。臭氧先氧化
具有一定的辅助作用。臭氧先氧化 ,发生反应:
,发生反应: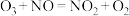 。在不同温度下,经过相同时间后测得
。在不同温度下,经过相同时间后测得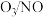 的物质的量之比与
的物质的量之比与 的脱除率关系如图乙所示。
的脱除率关系如图乙所示。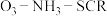 中
中 脱除率均有不同程度的降低,其原因是
脱除率均有不同程度的降低,其原因是___________ (写两条)。
②温度低于250℃,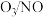 物质的量之比为0.5时,
物质的量之比为0.5时, 脱除率较高的原因是
脱除率较高的原因是___________ 。
③实验发现,向烟气中先通入 ,
, 脱除率低于先通入
脱除率低于先通入 ,可能的原因是
,可能的原因是___________
(3)以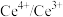 为媒介的间接电化学氧化法可以同时除去烟气中的
为媒介的间接电化学氧化法可以同时除去烟气中的 和
和 ,装置如图丙所示:
,装置如图丙所示:___________ , 参与反应的离子方程式为
参与反应的离子方程式为___________ 。
 )。
)。(1)钒基催化剂(
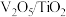 催化剂)可用于
催化剂)可用于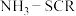 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示:
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示: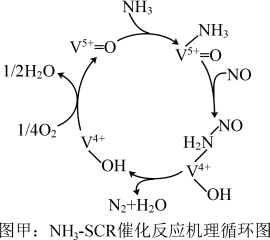
 的总反应化学方程式为
的总反应化学方程式为②若烟气中含有硫的氧化物,则会降低
 的速率,可能的原因是
的速率,可能的原因是(2)研究发现:当烟气中
 和
和 的物质的量相同时,会发生快速SCR反应过程:
的物质的量相同时,会发生快速SCR反应过程: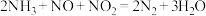 。臭氧对
。臭氧对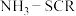 具有一定的辅助作用。臭氧先氧化
具有一定的辅助作用。臭氧先氧化 ,发生反应:
,发生反应: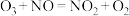 。在不同温度下,经过相同时间后测得
。在不同温度下,经过相同时间后测得 的物质的量之比与
的物质的量之比与 的脱除率关系如图乙所示。
的脱除率关系如图乙所示。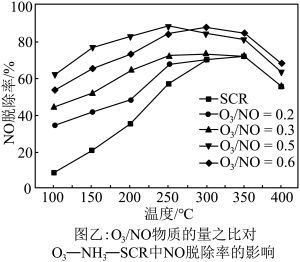
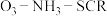 中
中 脱除率均有不同程度的降低,其原因是
脱除率均有不同程度的降低,其原因是②温度低于250℃,
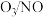 物质的量之比为0.5时,
物质的量之比为0.5时, 脱除率较高的原因是
脱除率较高的原因是③实验发现,向烟气中先通入
 ,
, 脱除率低于先通入
脱除率低于先通入 ,可能的原因是
,可能的原因是(3)以
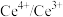 为媒介的间接电化学氧化法可以同时除去烟气中的
为媒介的间接电化学氧化法可以同时除去烟气中的 和
和 ,装置如图丙所示:
,装置如图丙所示: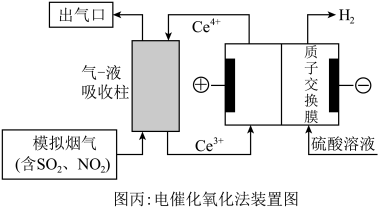
 参与反应的离子方程式为
参与反应的离子方程式为
您最近半年使用:0次
名校
解题方法
10 . 铬及其化合物在催化、金属防腐等方面具有重要应用。
(1)催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。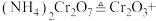
_______ +_______ 。
②Cr2O3催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为___________ (列式表示)。
③Cr2O3可用于NH3的催化氧化。设计从NH3出发经过3步反应制备HNO3的路线__________________ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为____________ 。
(2) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ)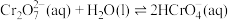
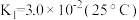
(ⅱ)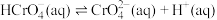

 溶液的说法正确的有
溶液的说法正确的有_______ 。
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时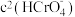 与
与 的比值保持不变
的比值保持不变
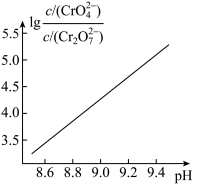
②25℃时,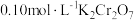 溶液中
溶液中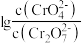 随pH的变化关系如图。当
随pH的变化关系如图。当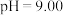 时,设
时,设 、
、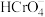 与
与 的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为____________  ;计算溶液中
;计算溶液中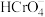 的平衡浓度
的平衡浓度__________ (写出计算过程,结果保留两位有效数字)。
(1)催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。
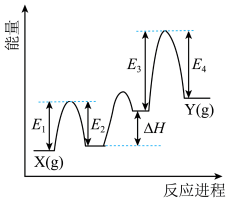
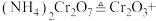
②Cr2O3催化丙烷脱氢过程中,部分反应历程如图,
 过程的焓变为
过程的焓变为③Cr2O3可用于NH3的催化氧化。设计从NH3出发经过3步反应制备HNO3的路线
(2)
 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(ⅰ)
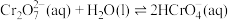
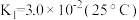
(ⅱ)
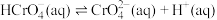

 溶液的说法正确的有
溶液的说法正确的有A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时
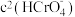 与
与 的比值保持不变
的比值保持不变②25℃时,
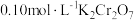 溶液中
溶液中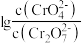 随pH的变化关系如图。当
随pH的变化关系如图。当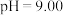 时,设
时,设 、
、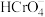 与
与 的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为 ;计算溶液中
;计算溶液中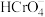 的平衡浓度
的平衡浓度
您最近半年使用:0次



