名校
解题方法
1 . 工业上以辉铋矿粉(主要成分是 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 (铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
(铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下: 难溶于水;
难溶于水;
②酸浸后,矿粉中的硫元素完全变为硫单质;
回答下列问题:
(1) 中Cu的化合价为
中Cu的化合价为___________ ,酸浸过程中, 反应的离子方程式
反应的离子方程式___________ 。
(2)检验“酸浸”液中是否含 ,可选择
,可选择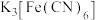 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是___________ 。
(3)氧化后,从反应体系中分离出 粗产品的操作名称是
粗产品的操作名称是___________ 。
(4)上述流程中,基态原子未成对电子数最多的金属元素名称是___________ 。
(5)向 和
和 混合溶液中通入氯气制备
混合溶液中通入氯气制备 的离子方程式
的离子方程式___________ 。
(6)已知常温下, ,调节FeCl3溶液至
,调节FeCl3溶液至 ,所得溶液中c(Fe3+)=
,所得溶液中c(Fe3+)=___________ 。
 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 (铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
(铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下: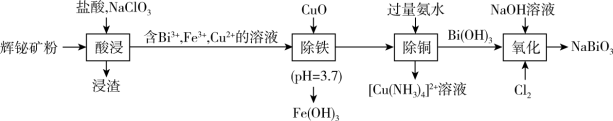
 难溶于水;
难溶于水;②酸浸后,矿粉中的硫元素完全变为硫单质;
回答下列问题:
(1)
 中Cu的化合价为
中Cu的化合价为 反应的离子方程式
反应的离子方程式(2)检验“酸浸”液中是否含
 ,可选择
,可选择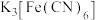 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是(3)氧化后,从反应体系中分离出
 粗产品的操作名称是
粗产品的操作名称是(4)上述流程中,基态原子未成对电子数最多的金属元素名称是
(5)向
 和
和 混合溶液中通入氯气制备
混合溶液中通入氯气制备 的离子方程式
的离子方程式(6)已知常温下,
 ,调节FeCl3溶液至
,调节FeCl3溶液至 ,所得溶液中c(Fe3+)=
,所得溶液中c(Fe3+)=
您最近一年使用:0次
名校
解题方法
2 . 以铁镍合金(含少量铜)为原料,生产电极材粗 的部分工艺流程如下:
的部分工艺流程如下:

已知:常温下,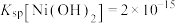 ,
,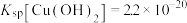 ,
,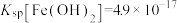 ,
,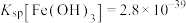 。
。
回答下列问题:
(1)基态Ni原子价层电子轨道表示式是_______ ;Cu原子位于周期表中_______ 区。
(2)“酸溶”时Ni转化为 ,该过程中温度控制在70~80℃的原因是
,该过程中温度控制在70~80℃的原因是_______ 。
(3)“氧化”时 的作用是(用离子方程式表示)
的作用是(用离子方程式表示)_______ 。
(4)“除铜”时若选用NaOH溶液,会导致部分 也产生沉淀,当常温时溶液中
也产生沉淀,当常温时溶液中 、
、 沉淀同时存在时,溶液中
沉淀同时存在时,溶液中
_______ 。
(5)“沉镍”时得到碳酸镍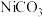 沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得
沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得 ,该反应的化学方程式是
,该反应的化学方程式是_______ 。
(6)金属镍的配合物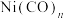 用途广泛,其中配体CO与
用途广泛,其中配体CO与 结构相似,CO分子内σ键与π键个数之比为
结构相似,CO分子内σ键与π键个数之比为_______ 。
 的部分工艺流程如下:
的部分工艺流程如下:
已知:常温下,
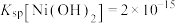 ,
,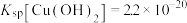 ,
,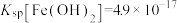 ,
,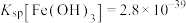 。
。回答下列问题:
(1)基态Ni原子价层电子轨道表示式是
(2)“酸溶”时Ni转化为
 ,该过程中温度控制在70~80℃的原因是
,该过程中温度控制在70~80℃的原因是(3)“氧化”时
 的作用是(用离子方程式表示)
的作用是(用离子方程式表示)(4)“除铜”时若选用NaOH溶液,会导致部分
 也产生沉淀,当常温时溶液中
也产生沉淀,当常温时溶液中 、
、 沉淀同时存在时,溶液中
沉淀同时存在时,溶液中
(5)“沉镍”时得到碳酸镍
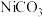 沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得
沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得 ,该反应的化学方程式是
,该反应的化学方程式是(6)金属镍的配合物
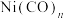 用途广泛,其中配体CO与
用途广泛,其中配体CO与 结构相似,CO分子内σ键与π键个数之比为
结构相似,CO分子内σ键与π键个数之比为
您最近一年使用:0次
名校
解题方法
3 . 一种从阳极泥(主要成分为Cu、Ag、Pt、Au、 、
、 等)中回收Se和贵重金属的工艺流程如图所示:
等)中回收Se和贵重金属的工艺流程如图所示:
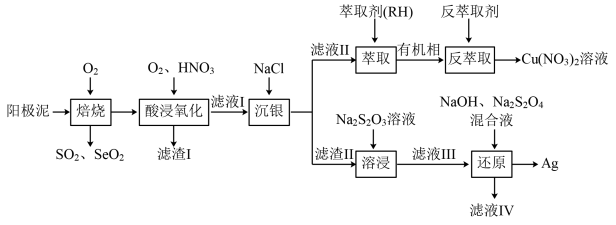
已知:①该工艺中萃取与反萃取的原理为: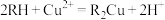 。
。
② 易与
易与 形成配离子:
形成配离子: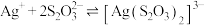 ,上述工艺条件下该反应的平衡常数为
,上述工艺条件下该反应的平衡常数为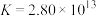 。
。
③上述工艺条件下,AgCl的溶度积常数: 。
。
(1)“焙烧”产生的; 与
与 的混合烟气可用水吸收制得单质Se,该反应的化学方程式为
的混合烟气可用水吸收制得单质Se,该反应的化学方程式为____________ 。
(2)“滤渣Ⅰ”的主要成分是______ (填化学式);“酸浸氧化”中通入氧气,体现了绿色化学的思想,其目的是____________ 。
(3)“反萃取剂”最好选用______ (填化学式)溶液。
(4)“溶浸”过程中滤渣Ⅱ被 溶液溶解,发生反应的平衡常数为
溶液溶解,发生反应的平衡常数为______ 。
(5)“还原”过程中; 没有参与氧化还原过程,“滤液Ⅳ”中还主要含有
没有参与氧化还原过程,“滤液Ⅳ”中还主要含有 。“还原”过程中氧化剂与还原剂的物质的量之比为
。“还原”过程中氧化剂与还原剂的物质的量之比为______ 。
(6)为减少工艺中试剂用量,“滤液Ⅳ”可返回______ (填工序名称)工序循环使用。
 、
、 等)中回收Se和贵重金属的工艺流程如图所示:
等)中回收Se和贵重金属的工艺流程如图所示:
已知:①该工艺中萃取与反萃取的原理为:
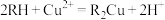 。
。②
 易与
易与 形成配离子:
形成配离子: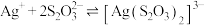 ,上述工艺条件下该反应的平衡常数为
,上述工艺条件下该反应的平衡常数为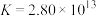 。
。③上述工艺条件下,AgCl的溶度积常数:
 。
。(1)“焙烧”产生的;
 与
与 的混合烟气可用水吸收制得单质Se,该反应的化学方程式为
的混合烟气可用水吸收制得单质Se,该反应的化学方程式为(2)“滤渣Ⅰ”的主要成分是
(3)“反萃取剂”最好选用
(4)“溶浸”过程中滤渣Ⅱ被
 溶液溶解,发生反应的平衡常数为
溶液溶解,发生反应的平衡常数为(5)“还原”过程中;
 没有参与氧化还原过程,“滤液Ⅳ”中还主要含有
没有参与氧化还原过程,“滤液Ⅳ”中还主要含有 。“还原”过程中氧化剂与还原剂的物质的量之比为
。“还原”过程中氧化剂与还原剂的物质的量之比为(6)为减少工艺中试剂用量,“滤液Ⅳ”可返回
您最近一年使用:0次
4 . 黄铁矿(主要成分为FeS2)的利用对资源和环境具有重要意义,一种酸性条件下催化氧化黄铁矿的物质转化关系如图所示,回答下列问题:
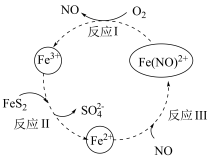
(1)基态氮原子的价层电子排布式为____________ 。
(2)基态氧原子的核外电子有________ 种空间运动状态,其电子占据的最高能级的电子云轮廓图为____ 形。
(3)第一电离能:N________ (填“>”“<”或“=”)O。
(4)反应Ⅱ的离子方程式为____________________ ,Fe3+的半径比Fe2+________ (填“大”或“小”),Fe3+的稳定性比Fe2+更________ (填“强”或“弱”)。

(1)基态氮原子的价层电子排布式为
(2)基态氧原子的核外电子有
(3)第一电离能:N
(4)反应Ⅱ的离子方程式为
您最近一年使用:0次
解题方法
5 . 将氟气通入氢氧化钠溶液中,可得OF2.OF2是一种无色、几乎无味的剧毒气体,主要用于氧化氟化反应、火箭工程助燃剂等。请回答下列问题:
(1)OF2中O的化合价为_______ ,OF2中O原子的杂化轨道类型是_______ ,OF2分子的空间构型为_______ 。
(2)与H2O分子相比,OF2分子的键角更_______ (填“大”或“小”)。
(3)与H2O分子相比,OF2分子的极性更_______ (填“大” 或“小”),原因是_______ ;
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)_______ 。
(1)OF2中O的化合价为
(2)与H2O分子相比,OF2分子的键角更
(3)与H2O分子相比,OF2分子的极性更
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)
您最近一年使用:0次
2023-11-22更新
|
347次组卷
|
2卷引用:陕西省榆林市第十中学2023-2024学年高二下学期第一次质量检测化学试题
6 . NH4Cl是农业常用的一种氮肥,该产品主要生产工艺之一就是利用中国著名实业家侯德榜发明的“侯氏制碱法”。
(1)NH4Cl中含有的化学键类型有_______ ;其三种组成元素中,原子半径最大的原子,其核外电子有_______ 种不同的运动状态,有_______ 种不同能量的电子。
(2)NH4I和NH4Cl性质类似都易分解,产物都有NH3,但NH4I分解过程中产生紫红色的气体。请从物质结构角度解释_______ 。
(3)纯碱工业中,使NH4Cl从母液中析出的措施不包括_______ (选填编号)。
a.冷却 b.加入食盐细颗粒 c.通入CO2 d.通入NH3
(4)无水情况下,NH4Cl可以和Fe2O3发生如下反应:_______NH4Cl +_______Fe2O3=_______Fe + _______FeCl3 + _______N2 ↑ + _______H2O
①配平上述反应方程式,并标出电子转移的方向和数目_______ ;
②当有2mol电子转移时,生成标准状况下的气体体积为_______ L(保留2位小数)
③若上述反应物恰好完全反应,将固体产物溶解并过滤,写出检验滤液中金属离子的方法:_______
(1)NH4Cl中含有的化学键类型有
(2)NH4I和NH4Cl性质类似都易分解,产物都有NH3,但NH4I分解过程中产生紫红色的气体。请从物质结构角度解释
(3)纯碱工业中,使NH4Cl从母液中析出的措施不包括
a.冷却 b.加入食盐细颗粒 c.通入CO2 d.通入NH3
(4)无水情况下,NH4Cl可以和Fe2O3发生如下反应:_______NH4Cl +_______Fe2O3=_______Fe + _______FeCl3 + _______N2 ↑ + _______H2O
①配平上述反应方程式,并标出电子转移的方向和数目
②当有2mol电子转移时,生成标准状况下的气体体积为
③若上述反应物恰好完全反应,将固体产物溶解并过滤,写出检验滤液中金属离子的方法:
您最近一年使用:0次
2021-12-19更新
|
572次组卷
|
4卷引用:陕西省西安市蓝田县城关中学大学区联考2023-2024学年高二上学期1月期末化学试题
陕西省西安市蓝田县城关中学大学区联考2023-2024学年高二上学期1月期末化学试题上海市闵行区2022届高三一模化学试题(已下线)上海市闵行区2022届高三一模化学试题(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)
名校
解题方法
7 . 北京市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式_______(将化学计量数填于空白处)
_______ KIO3+_______ KI+_______ H2SO4=_______ K2SO4+_______ I2+_______ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。已知Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式_______ 。
(3)已知:I2+2S2O =2I-+S4O
=2I-+S4O 。某学生测定食用精制盐的碘含量,其步骤为:
。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是_______ 。
②b中反应所产生的I2的物质的量是_______ mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_______ mg/kg。
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。已知Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式
(3)已知:I2+2S2O
 =2I-+S4O
=2I-+S4O 。某学生测定食用精制盐的碘含量,其步骤为:
。某学生测定食用精制盐的碘含量,其步骤为:a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是
②b中反应所产生的I2的物质的量是
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
您最近一年使用:0次
名校
解题方法
8 . (1)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是
2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是
B、容器内温度不再变化
C、断裂1mol N≡N键的同时,生成6mol N﹣H键
D、反应消耗N2、H2与产生NH3的速率之比1:3:2
(2)已知:①Zn(s)+1/2O2(g) = ZnO(s) △H =-348.3 kJ/mol
②2Ag(s)+1/2O2(g) = Ag2O(s) △H =-31.0 kJ/mol
则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的△H=
(3)已知两个热化学方程式:
C(s)+O2(g)==CO2(g) △H = -393.5kJ/mol
2H2(g)+O2(g)==2H2O(g)△H = -483.6kJ/mol
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是
(4)在水溶液中,YO3n-和S2-发生反应的离子方程式如下:YO3n- + 3S2- + 6H+ = Y-+ 3S↓+ 3H2O
①YO3n-中Y的化合价是
②Y元素原子的最外层电子数是
您最近一年使用:0次
2017-07-15更新
|
437次组卷
|
3卷引用:陕西省西安市蓝田县城关中学大学区联考2023-2024学年高二下学期3月月考化学试题



