名校
1 . 某化学学习小组经查阅资料发现: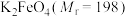 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。现制备高铁酸钾
,在碱性溶液中较稳定。现制备高铁酸钾 ,测定其纯度并探究其性质。
,测定其纯度并探究其性质。
(1)制备 (夹持装置略)
(夹持装置略)

①A为气体发生装置,写出对应的离子方程式_______ 。
②装置B的作用为_______ 。
③装置C中主要反应的化学方程式为_______ 。
(2)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否是
。为证明是否是 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
①补全方案Ⅰ中实验步骤:取少量a于试管中,_______ ,但该离子的产生不能判断一定是 被
被 还原得到,还可能由
还原得到,还可能由_______ 产生(用离子反应方程式表示)。
②方案Ⅱ可证明 氧化了
氧化了 ,用
,用 溶液洗涤的目的是
溶液洗涤的目的是_______ 。
③小组同学对比方案Ⅱ实验和 的制备实验发现:
的制备实验发现: 和
和 的氧化性强弱关系相反,请你帮助解释出现矛盾的原因是
的氧化性强弱关系相反,请你帮助解释出现矛盾的原因是_______ 。
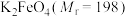 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。现制备高铁酸钾
,在碱性溶液中较稳定。现制备高铁酸钾 ,测定其纯度并探究其性质。
,测定其纯度并探究其性质。(1)制备
 (夹持装置略)
(夹持装置略)
①A为气体发生装置,写出对应的离子方程式
②装置B的作用为
③装置C中主要反应的化学方程式为
(2)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明是否是
。为证明是否是 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量a于试管中,… |
| 方案Ⅱ | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b;取少量b,滴加盐酸,有 溶出,得到紫色溶液b;取少量b,滴加盐酸,有 产生。 产生。 |
 被
被 还原得到,还可能由
还原得到,还可能由②方案Ⅱ可证明
 氧化了
氧化了 ,用
,用 溶液洗涤的目的是
溶液洗涤的目的是③小组同学对比方案Ⅱ实验和
 的制备实验发现:
的制备实验发现: 和
和 的氧化性强弱关系相反,请你帮助解释出现矛盾的原因是
的氧化性强弱关系相反,请你帮助解释出现矛盾的原因是
您最近一年使用:0次
2 . 含氯物质在生产生活中有重要作用。
(一)实验室利用下面的装置制备氯水和漂白液(尾气处理装置略)
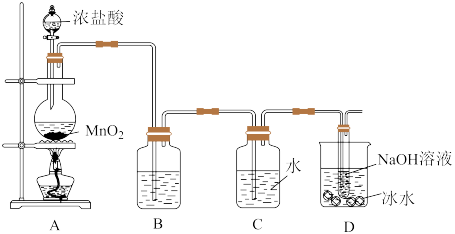
(1)盛放 粉末的仪器名称是
粉末的仪器名称是___________ ,A中发生反应的化学方程式为___________ 。
(2)装置B的作用是___________ 。
(3)D中可以得到漂白液,反应的离子方程式是___________ ,采用冰水浴冷却的目的是___________ 。
(二)测定漂白液中NaClO的含量
步骤①:取20mL制得的漂白液,加入过量盐酸酸化的KI溶液,充分反应;
步骤②:加入淀粉做指示剂,用 标准溶液滴定至终点,发生反应:
标准溶液滴定至终点,发生反应: 。
。
(4)步骤①中发生反应的离子方程式为___________ ;最终平均用去 标准溶液,测得NaClO的含量为
标准溶液,测得NaClO的含量为___________  (结果保留2位小数)。
(结果保留2位小数)。
(三)探究氯水的性质
(5)装置C中得到饱和的氯水,往淀粉-KI溶液中逐滴加入氯水至氯水过量,观察到溶液先变蓝后褪色。某组同学对褪色原因进行探究。
①查阅资料知道:氯水不能氧化淀粉;氯水不能氧化由 和淀粉形成的蓝色化合物。
和淀粉形成的蓝色化合物。
②提出假设: 被过量的氯水氧化为
被过量的氯水氧化为 ;
;
请帮助该组同学设计实验证明该假设成立:___________ 。
③有同学在实验过程中没有看到蓝色,而是看到了蓝褐色;经分析可能是发生了反应: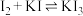 (棕红色络合物),干扰实验现象的观察。请帮助该同学设计实验证明上述分析:
(棕红色络合物),干扰实验现象的观察。请帮助该同学设计实验证明上述分析:___________ 。
(一)实验室利用下面的装置制备氯水和漂白液(尾气处理装置略)

(1)盛放
 粉末的仪器名称是
粉末的仪器名称是(2)装置B的作用是
(3)D中可以得到漂白液,反应的离子方程式是
(二)测定漂白液中NaClO的含量
步骤①:取20mL制得的漂白液,加入过量盐酸酸化的KI溶液,充分反应;
步骤②:加入淀粉做指示剂,用
 标准溶液滴定至终点,发生反应:
标准溶液滴定至终点,发生反应: 。
。(4)步骤①中发生反应的离子方程式为
 标准溶液,测得NaClO的含量为
标准溶液,测得NaClO的含量为 (结果保留2位小数)。
(结果保留2位小数)。(三)探究氯水的性质
(5)装置C中得到饱和的氯水,往淀粉-KI溶液中逐滴加入氯水至氯水过量,观察到溶液先变蓝后褪色。某组同学对褪色原因进行探究。
①查阅资料知道:氯水不能氧化淀粉;氯水不能氧化由
 和淀粉形成的蓝色化合物。
和淀粉形成的蓝色化合物。②提出假设:
 被过量的氯水氧化为
被过量的氯水氧化为 ;
;请帮助该组同学设计实验证明该假设成立:
③有同学在实验过程中没有看到蓝色,而是看到了蓝褐色;经分析可能是发生了反应:
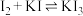 (棕红色络合物),干扰实验现象的观察。请帮助该同学设计实验证明上述分析:
(棕红色络合物),干扰实验现象的观察。请帮助该同学设计实验证明上述分析:
您最近一年使用:0次
2023-11-22更新
|
74次组卷
|
3卷引用:实验探究题
名校
3 . 关于非金属元素及其化合物,下列说法正确的是
| A.氯原子最外层电子数为7,所以Cl2只具有氧化性 |
| B.SO2、HClO的水溶液都具有漂白性,漂白原理也相同 |
| C.制备酸性KMnO4溶液时,通常用硫酸酸化 |
| D.将CO2或SO2通入Ba(NO3)2溶液中,均无沉淀生成 |
您最近一年使用:0次
2023-02-17更新
|
712次组卷
|
6卷引用:选择题1-5
(已下线)选择题1-5(已下线)专题卷08 无机物的性质与用途-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)青海省西宁市大通回族土族自治县2022-2023学年高三下学期开学摸底考试化学试题安徽省合肥市2022-2023学年高一下学期4月期中考试化学试题陕西省安康市2022-2023学年高一下学期4月期中考试化学试题黑龙江省双鸭山市第一中学2023-2024学年高三上学期开学考试化学试题



