名校
1 . 某化学学习小组经查阅资料发现: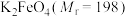 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。现制备高铁酸钾
,在碱性溶液中较稳定。现制备高铁酸钾 ,测定其纯度并探究其性质。
,测定其纯度并探究其性质。
(1)制备 (夹持装置略)
(夹持装置略)

①A为气体发生装置,写出对应的离子方程式_______ 。
②装置B的作用为_______ 。
③装置C中主要反应的化学方程式为_______ 。
(2)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否是
。为证明是否是 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
①补全方案Ⅰ中实验步骤:取少量a于试管中,_______ ,但该离子的产生不能判断一定是 被
被 还原得到,还可能由
还原得到,还可能由_______ 产生(用离子反应方程式表示)。
②方案Ⅱ可证明 氧化了
氧化了 ,用
,用 溶液洗涤的目的是
溶液洗涤的目的是_______ 。
③小组同学对比方案Ⅱ实验和 的制备实验发现:
的制备实验发现: 和
和 的氧化性强弱关系相反,请你帮助解释出现矛盾的原因是
的氧化性强弱关系相反,请你帮助解释出现矛盾的原因是_______ 。
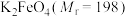 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。现制备高铁酸钾
,在碱性溶液中较稳定。现制备高铁酸钾 ,测定其纯度并探究其性质。
,测定其纯度并探究其性质。(1)制备
 (夹持装置略)
(夹持装置略)
①A为气体发生装置,写出对应的离子方程式
②装置B的作用为
③装置C中主要反应的化学方程式为
(2)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明是否是
。为证明是否是 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量a于试管中,… |
| 方案Ⅱ | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b;取少量b,滴加盐酸,有 溶出,得到紫色溶液b;取少量b,滴加盐酸,有 产生。 产生。 |
 被
被 还原得到,还可能由
还原得到,还可能由②方案Ⅱ可证明
 氧化了
氧化了 ,用
,用 溶液洗涤的目的是
溶液洗涤的目的是③小组同学对比方案Ⅱ实验和
 的制备实验发现:
的制备实验发现: 和
和 的氧化性强弱关系相反,请你帮助解释出现矛盾的原因是
的氧化性强弱关系相反,请你帮助解释出现矛盾的原因是
您最近一年使用:0次
2 . 下列实验操作及现象与对应结论不匹配的是
| 选项 | 实验操作及现象 | 结论 |
| A | 将Na2S2O3溶液和稀H2SO4混合,得到沉淀,且生成的气体可使品红溶液褪色 | Na2S2O3既体现还原性又体现氧化性 |
| B | 将Zn(OH)2固体粉末加入过量NaOH溶液中,充分搅拌,溶解得到无色溶液 | Zn(OH)2既体现碱性又体现酸性 |
| C | 将TiCl4液体和FeCl3固体分别暴露在潮湿空气中,只有前者会冒“白烟” | 水解性:TiCl4>FeCl3 |
| D | 将红色固体CrO3加热,得到绿色固体Cr2O3,且生成的气体可以使带火星的木条复燃 | 热稳定性:CrO3<Cr2O3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-22更新
|
4818次组卷
|
7卷引用:2022年重庆高考真题化学试题变式题(选择题6-10)
(已下线)2022年重庆高考真题化学试题变式题(选择题6-10)(已下线)专题11 化学实验基础-2022年高考真题模拟题分项汇编2022年重庆高考真题化学试题(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)题型07 化学实验基础(选择题)-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)黑龙江省七台河市勃利县高级中学2023-2024学年高三上学期9月月考化学试题
3 . 含氯物质在生产生活中有重要作用。
(一)实验室利用下面的装置制备氯水和漂白液(尾气处理装置略)
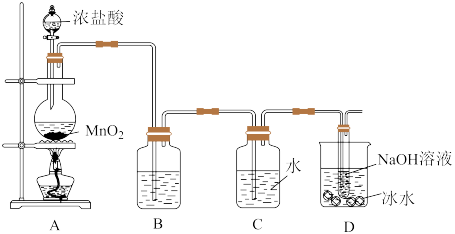
(1)盛放 粉末的仪器名称是
粉末的仪器名称是___________ ,A中发生反应的化学方程式为___________ 。
(2)装置B的作用是___________ 。
(3)D中可以得到漂白液,反应的离子方程式是___________ ,采用冰水浴冷却的目的是___________ 。
(二)测定漂白液中NaClO的含量
步骤①:取20mL制得的漂白液,加入过量盐酸酸化的KI溶液,充分反应;
步骤②:加入淀粉做指示剂,用 标准溶液滴定至终点,发生反应:
标准溶液滴定至终点,发生反应: 。
。
(4)步骤①中发生反应的离子方程式为___________ ;最终平均用去 标准溶液,测得NaClO的含量为
标准溶液,测得NaClO的含量为___________  (结果保留2位小数)。
(结果保留2位小数)。
(三)探究氯水的性质
(5)装置C中得到饱和的氯水,往淀粉-KI溶液中逐滴加入氯水至氯水过量,观察到溶液先变蓝后褪色。某组同学对褪色原因进行探究。
①查阅资料知道:氯水不能氧化淀粉;氯水不能氧化由 和淀粉形成的蓝色化合物。
和淀粉形成的蓝色化合物。
②提出假设: 被过量的氯水氧化为
被过量的氯水氧化为 ;
;
请帮助该组同学设计实验证明该假设成立:___________ 。
③有同学在实验过程中没有看到蓝色,而是看到了蓝褐色;经分析可能是发生了反应: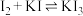 (棕红色络合物),干扰实验现象的观察。请帮助该同学设计实验证明上述分析:
(棕红色络合物),干扰实验现象的观察。请帮助该同学设计实验证明上述分析:___________ 。
(一)实验室利用下面的装置制备氯水和漂白液(尾气处理装置略)

(1)盛放
 粉末的仪器名称是
粉末的仪器名称是(2)装置B的作用是
(3)D中可以得到漂白液,反应的离子方程式是
(二)测定漂白液中NaClO的含量
步骤①:取20mL制得的漂白液,加入过量盐酸酸化的KI溶液,充分反应;
步骤②:加入淀粉做指示剂,用
 标准溶液滴定至终点,发生反应:
标准溶液滴定至终点,发生反应: 。
。(4)步骤①中发生反应的离子方程式为
 标准溶液,测得NaClO的含量为
标准溶液,测得NaClO的含量为 (结果保留2位小数)。
(结果保留2位小数)。(三)探究氯水的性质
(5)装置C中得到饱和的氯水,往淀粉-KI溶液中逐滴加入氯水至氯水过量,观察到溶液先变蓝后褪色。某组同学对褪色原因进行探究。
①查阅资料知道:氯水不能氧化淀粉;氯水不能氧化由
 和淀粉形成的蓝色化合物。
和淀粉形成的蓝色化合物。②提出假设:
 被过量的氯水氧化为
被过量的氯水氧化为 ;
;请帮助该组同学设计实验证明该假设成立:
③有同学在实验过程中没有看到蓝色,而是看到了蓝褐色;经分析可能是发生了反应:
 (棕红色络合物),干扰实验现象的观察。请帮助该同学设计实验证明上述分析:
(棕红色络合物),干扰实验现象的观察。请帮助该同学设计实验证明上述分析:
您最近一年使用:0次
2023-11-22更新
|
74次组卷
|
3卷引用:实验探究题
名校
解题方法
4 . 亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆漂白、食品消毒、水处理、杀菌灭藻和鱼药制造等。某校化学实验探究小组设计如下实验制备亚氯酸钠(NaClO2)晶体。
【查阅资料】
①A中发生的主要反应为:2NaClO3+ Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O。
②ClO2不稳定,常压下,其体积分数大于15%易爆炸;且ClO2极易溶于水而不与水反应,几乎不发生水解,沸点11℃。
③NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
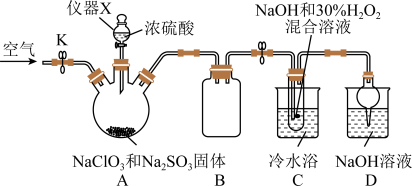
(1)仪器X的名称是___________ 。B的作用是___________ 。
(2)实验过程中,打开活塞k,缓缓通入空气,其目的是___________ 。
(3)A中使用浓硫酸而不用稀硫酸的原因是___________ 。
(4)ClO2气体与装置C中混合溶液反应生成NaClO2,生成NaClO2的离子方程式为___________ 。
(5)反应后,经55℃蒸发结晶→趁热过滤→洗涤→低于60℃干燥,可从装置C中得到无水NaClO2晶体。上述操作中,“洗涤”可选用的试剂可以是___________ (填标号)。
A.冰水 B.38~60℃热水 C.乙醇
(6)测定样品中NaClO2的纯度。测定时进行如下实验:准确称取mg的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应:ClO +4I-+4H+=2I2+Cl-+2H2O,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液作指示剂,用c mol·L-1的Na2S2O3标准液滴定至终点,测的消耗标准溶液体积的平均值为V mL(已知I2+ 2S2O
+4I-+4H+=2I2+Cl-+2H2O,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液作指示剂,用c mol·L-1的Na2S2O3标准液滴定至终点,测的消耗标准溶液体积的平均值为V mL(已知I2+ 2S2O =2I-+ S4O
=2I-+ S4O )。
)。
①确认滴定终点的现象是___________ 。
②所称取的样品中NaClO2的质量分数为___________ (用含m、c、V的代数式表示)。
【查阅资料】
①A中发生的主要反应为:2NaClO3+ Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O。
②ClO2不稳定,常压下,其体积分数大于15%易爆炸;且ClO2极易溶于水而不与水反应,几乎不发生水解,沸点11℃。
③NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。

(1)仪器X的名称是
(2)实验过程中,打开活塞k,缓缓通入空气,其目的是
(3)A中使用浓硫酸而不用稀硫酸的原因是
(4)ClO2气体与装置C中混合溶液反应生成NaClO2,生成NaClO2的离子方程式为
(5)反应后,经55℃蒸发结晶→趁热过滤→洗涤→低于60℃干燥,可从装置C中得到无水NaClO2晶体。上述操作中,“洗涤”可选用的试剂可以是
A.冰水 B.38~60℃热水 C.乙醇
(6)测定样品中NaClO2的纯度。测定时进行如下实验:准确称取mg的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应:ClO
 +4I-+4H+=2I2+Cl-+2H2O,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液作指示剂,用c mol·L-1的Na2S2O3标准液滴定至终点,测的消耗标准溶液体积的平均值为V mL(已知I2+ 2S2O
+4I-+4H+=2I2+Cl-+2H2O,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液作指示剂,用c mol·L-1的Na2S2O3标准液滴定至终点,测的消耗标准溶液体积的平均值为V mL(已知I2+ 2S2O =2I-+ S4O
=2I-+ S4O )。
)。①确认滴定终点的现象是
②所称取的样品中NaClO2的质量分数为
您最近一年使用:0次
名校
5 . W、X、Y、Z是原子序数依次增大的分属前四周期的主族元素,X、Y同主族,四种元素形成的某种化合物(结构式如图所示)可用作口腔清洁剂,下列说法错误的是
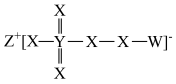
| A.简单离子半径:Y>Z>X | B.Z2X2中阴阳离子的个数比为1∶1 |
| C.失电子能力:Z>W>Y>X | D.该化合物有强氧化性,也有一定的还原性 |
您最近一年使用:0次
6 . 双咪唑是合成治疗高血压药物替米沙坦的一种中间体,其合成路线如下:___________ 。
(2)下列有关说法正确的是___________。
(3)③的化学方程式为___________ 。
(4)E的结构简式为___________ 。
(5)写出3种同时符合下列条件的化合物H的同分异构体的结构简式___________ 。
①分子中只含有1个环,且为连有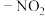 的苯环;
的苯环;
②分子中共有3种不同化学环境的氢原子。
(6)参照上述合成路线,设计由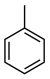 和
和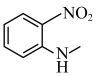 合成
合成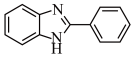 的路线
的路线___________ (其它无机试剂任选)。
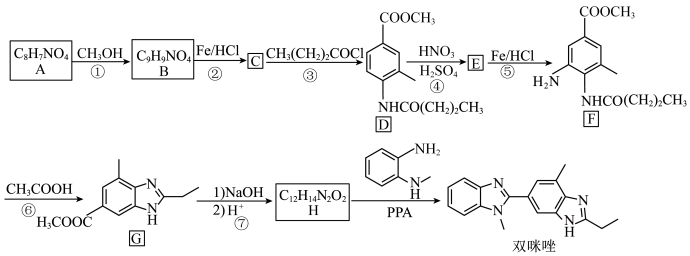
已知: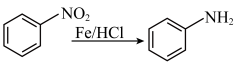 。请回答:
。请回答:
(2)下列有关说法正确的是___________。
| A.②的反应类型为还原反应 |
B.双咪唑的分子式为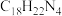 |
| C.化合物D在酸性、碱性条件下水解,均可生成盐 |
| D.常温下,化合物F在水中有较大的溶解度 |
(3)③的化学方程式为
(4)E的结构简式为
(5)写出3种同时符合下列条件的化合物H的同分异构体的结构简式
①分子中只含有1个环,且为连有
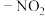 的苯环;
的苯环;②分子中共有3种不同化学环境的氢原子。
(6)参照上述合成路线,设计由
 和
和 合成
合成 的路线
的路线
您最近一年使用:0次
7 . 下列实验操作和现象,得出的相应结论正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向盛有 和 和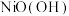 的试管中分别滴加浓盐酸 的试管中分别滴加浓盐酸 | 盛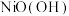 的试管中产生黄绿色气体 的试管中产生黄绿色气体 | 氧化性: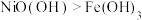 |
| B | 向 溶液中通入 溶液中通入 气体 气体 | 出现黑色沉淀(CuS) | 酸性: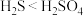 |
| C | 乙醇和浓硫酸共热至 ,将产生的气体通入溴水中 ,将产生的气体通入溴水中 | 溴水褪色 | 乙烯发生了加成反应 |
| D | 向 溶液中滴加 溶液中滴加 溶液 溶液 | 出现黄色沉淀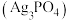 |  发生了水解反应 发生了水解反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-28更新
|
6308次组卷
|
12卷引用:选择题6-10
(已下线)选择题6-102023年重庆市高考化学试卷(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)题型07 化学实验基础(选择题)-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型03 离子方程式正误判断 离子共存、检验和推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)选择题6-10(已下线)T9-实验方案的设计与评价河北省石家庄市河北正定中学2024届高三上学期第二次月考化学试题山东省德州市第一中学2023-2024学年高三上学期1月月考化学试题辽宁省鞍山市普通高中2023-2024学年高三上学期期末联考化学试题北京市中国人民大学附属中学2023-2024学年高三下学期开学考试化学试题安徽省县中联盟2023-2024学年高三下学期(三模)联考化学试题
名校
8 . 关于非金属元素及其化合物,下列说法正确的是
| A.氯原子最外层电子数为7,所以Cl2只具有氧化性 |
| B.SO2、HClO的水溶液都具有漂白性,漂白原理也相同 |
| C.制备酸性KMnO4溶液时,通常用硫酸酸化 |
| D.将CO2或SO2通入Ba(NO3)2溶液中,均无沉淀生成 |
您最近一年使用:0次
2023-02-17更新
|
712次组卷
|
6卷引用:选择题1-5
(已下线)选择题1-5(已下线)专题卷08 无机物的性质与用途-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)青海省西宁市大通回族土族自治县2022-2023学年高三下学期开学摸底考试化学试题安徽省合肥市2022-2023学年高一下学期4月期中考试化学试题陕西省安康市2022-2023学年高一下学期4月期中考试化学试题黑龙江省双鸭山市第一中学2023-2024学年高三上学期开学考试化学试题
名校
解题方法
9 . 查阅资料知:FeCl3是一种共价化合物,熔点为306℃,沸点为315℃,无水FeCl3在空气中易潮解,加热易升华。
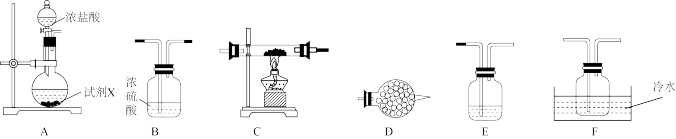
(1)实验室制备无水FeCl3的实验装置如图:
回答下列问题:
①上述仪器的连接顺序是A→_______ →B→_______ →_______ →D(填标号)
②试剂X是_______ (填名称)。
③装置D的作用是_______ 。
④C处右侧选用较粗玻璃管的原因是_______ 。
(2)工业上用NaClO3氧化酸性FeCl2废液制得。
①NaClO3氧化酸性FeCl2制备FeCl3的离子方程式为_______ 。
②为检验上述方法制备的FeCl3固体中是否含有FeCl2,应该进行的实验操作是_______ 。
③若酸性FeCl2废液中,c(Fe2+)=2.0×10-1mol•L-1,c(Fe3+)=1.0×10-2mol•L-1,c(Cl-)=5.3×10-1mol•L-1,则该溶液的 为
为 _______ 。(其他离子忽略不计)
(3)实验室中还常用 与FeCl3∙6H2O
与FeCl3∙6H2O共热 制备无水FeCl3,该反应的化学方程式为_______ 。
(1)实验室制备无水FeCl3的实验装置如图:

回答下列问题:
①上述仪器的连接顺序是A→
②试剂X是
③装置D的作用是
④C处右侧选用较粗玻璃管的原因是
(2)工业上用NaClO3氧化酸性FeCl2废液制得。
①NaClO3氧化酸性FeCl2制备FeCl3的离子方程式为
②为检验上述方法制备的FeCl3固体中是否含有FeCl2,应该进行的实验操作是
③若酸性FeCl2废液中,c(Fe2+)=2.0×10-1mol•L-1,c(Fe3+)=1.0×10-2mol•L-1,c(Cl-)=5.3×10-1mol•L-1,则该溶液的
 为
为 (3)实验室中还常用
 与FeCl3∙6H2O
与FeCl3∙6H2O
您最近一年使用:0次
解题方法
10 . 下列实验操作和现象,得出的相应结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向盛有 和 和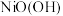 的试管中分别滴加相同浓度的浓盐酸 的试管中分别滴加相同浓度的浓盐酸 | 只有盛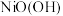 的试管中产生黄绿色气体 的试管中产生黄绿色气体 | 氧化性: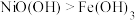 |
| B | 取   溶液于试管中,加入 溶液于试管中,加入   溶液,充分反应后滴入5滴15% 溶液,充分反应后滴入5滴15% 溶液 溶液 | 溶液变为血红色 |  与 与 的反应有一定限度 的反应有一定限度 |
| C | 乙醇和浓硫酸共热至170℃,将产生的气体通入溴水中 | 溴水褪色 | 乙烯发生了加成反应 |
| D | 向 溶液中滴加 溶液中滴加 溶液 溶液 | 出现黄色沉淀 |  发生了水解反应 发生了水解反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



