真题
1 . 家务劳动中蕴含着丰富的化学知识。下列相关解释错误的是
A.用过氧碳酸钠漂白衣物: 具有较强氧化性 具有较强氧化性 |
| B.酿米酒需晾凉米饭后加酒曲:乙醇受热易挥发 |
| C.用柠檬酸去除水垢:柠檬酸酸性强于碳酸 |
| D.用碱液清洗厨房油污:油脂可碱性水解 |
您最近一年使用:0次
7日内更新
|
2017次组卷
|
4卷引用:2024年高考化学真题完全解读(黑龙江、吉林、辽宁卷)(课件+讲义)
2021高三·全国·专题练习
名校
解题方法
2 . 根据元素周期律表无法判断的是
| A.稳定性:H2O>H2S>PH3 | B.酸性:HClO4>H2SO3>H2SiO3 |
| C.碱性:KOH>NaOH>LiOH | D.氧化性:F2>O2>N2 |
您最近一年使用:0次
2021-12-24更新
|
436次组卷
|
5卷引用:黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(1-10)
(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(1-10)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)宁夏回族自治区银川一中2022-2023学年高一上学期期末考试化学试题
名校
3 . I.利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是_______ (填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)此实验不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_______ 。
II.碘化钾常用作合成有机化合物的原料。某实验小组设计实验探究KI的还原性。探究不同条件下空气中氧气氧化KI的速率。
(3)酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为_______ 。
(4)设计实验组别3的目的是_______ 。
III.探究反应“2Fe3++2I- 2Fe2++I2”为可逆反应。
2Fe2++I2”为可逆反应。
试剂:0.01 mol·L-1KI溶液,0.005 mol·L-1 Fe2SO4溶液,淀粉溶液,0.01 mol·L-1AgNO3溶液,KSCN溶液。实验如下:

(5)甲同学通过试管i和试管ii中现象结合可证明该反应为可逆反应,则试管i中现象为_______ ;乙同学认为该现象无法证明该反应为可逆反应,原因为_______ 。
(6)请选择上述试剂重新设计实验,证明该反应为可逆反应:_______ 。

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)此实验不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是
II.碘化钾常用作合成有机化合物的原料。某实验小组设计实验探究KI的还原性。探究不同条件下空气中氧气氧化KI的速率。
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 蒸馏水 | 淀粉溶液 | ||
| c(KI) | V | c(H2SO4) | V | ||||
| 1 | 298K | 0.01 mol·L-1 | 5 mL | 0.1 mol·L-1 | 5 mL | 10 mL | 3滴 |
| 2 | 313K | 0.01 mol·L-1 | a mL | b mol·L-1 | 5 mL | 10 mL | 3滴 |
| 3 | 298K | 0.05 mol·L-1 | 10 mL | 0.2 mol·L-1 | 5 mL | 5 mL | 3滴 |
(4)设计实验组别3的目的是
III.探究反应“2Fe3++2I-
 2Fe2++I2”为可逆反应。
2Fe2++I2”为可逆反应。试剂:0.01 mol·L-1KI溶液,0.005 mol·L-1 Fe2SO4溶液,淀粉溶液,0.01 mol·L-1AgNO3溶液,KSCN溶液。实验如下:

(5)甲同学通过试管i和试管ii中现象结合可证明该反应为可逆反应,则试管i中现象为
(6)请选择上述试剂重新设计实验,证明该反应为可逆反应:
您最近一年使用:0次
名校
4 . V2O5可制备对高血糖、高血症等具有一定治疗作用的硫酸氧矾(VOSO4),而V2O5可以通过氯化氧钒(VOCl3)与氨水在一定条件下制备。
Ⅰ.制备VOSO4:实验流程如图-1及实验装置如图-2(夹持及加热装置已省略)。
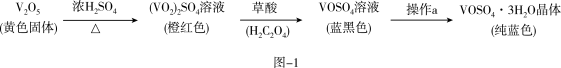
已知:草酸易溶于乙醇,可溶于水,不溶于苯,受热易分解,具有还原性。
回答下列问题:
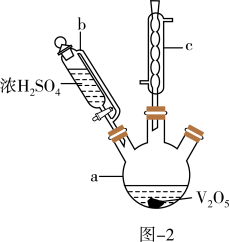
(1)仪器b的名称为_______ 。
(2)为防止草酸的损耗,加入草酸前需对反应液采取的措施为_______ 。
(3)反应液由橙红色变为蓝黑色的反应的化学方程式为_______ 。
(4)硫酸氧钒晶体(VOSO4·3H2O)中钒含量的测定:
①称取2.5g VOSO4·3H2O,配成250mL溶液;
②取25.00mL溶液于锥形瓶中,滴加足量酸性高锰酸钾将VO2+完全转化为VO 。
。
③滴加亚硝酸钠溶液反应掉过量的高锰酸钾,加入2mL尿素溶液至溶液不再产生气泡。已知:尿素不直接与亚硝酸盐反应,但可将亚硝酸转化为氮气;亚硝酸可将VO 转化为VO2+。
转化为VO2+。
④加入10mL硫酸-磷酸混酸调节pH=0,滴入指示剂用0.05mol·L-1硫酸亚铁铵标准溶液(Fe2+将VO 转化为VO2+)滴定至终点。测量三次,消耗标准溶液平均体积为10.00mL。
转化为VO2+)滴定至终点。测量三次,消耗标准溶液平均体积为10.00mL。
ⅰ.实验过程中,下列操作会导致所测钒含量偏高的是_______ 。
A.预处理过程中加入尿素的量不足
B.盛装硫酸亚铁铵标准液的滴定管未润洗
C.滴定管读数时,开始时仰视刻度线,结束时平视刻度线
D.滴定前滴定管有气泡,滴定结束后发现滴定管内无气泡
ⅱ.测得硫酸氧钒晶体中钒的质量分数为_______ (写出计算过程)。
Ⅱ.制备V2O5:VOCl3与氨水沉钒生成NH4VO3,NH4VO3加热分解生成V2O5。沉钒率与钒溶液浓度、氨解温度的关系如图-3、图-4所示。
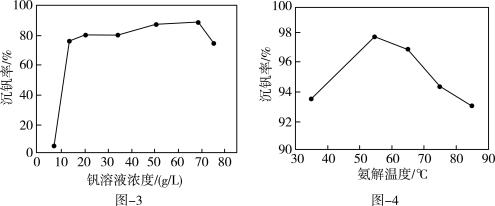
为确定较适宜的沉钒条件,请结合上图曲线,补充完整“探究氨水浓度对沉钒率的影响”的实验方案:_______ ,使用专用仪器测定并计算沉钒率。(实验中可供选择的试剂:50g/L的钒溶液、10g/L的钒溶液、25%的优级纯氨水、高纯水)
Ⅰ.制备VOSO4:实验流程如图-1及实验装置如图-2(夹持及加热装置已省略)。

已知:草酸易溶于乙醇,可溶于水,不溶于苯,受热易分解,具有还原性。
回答下列问题:

(1)仪器b的名称为
(2)为防止草酸的损耗,加入草酸前需对反应液采取的措施为
(3)反应液由橙红色变为蓝黑色的反应的化学方程式为
(4)硫酸氧钒晶体(VOSO4·3H2O)中钒含量的测定:
①称取2.5g VOSO4·3H2O,配成250mL溶液;
②取25.00mL溶液于锥形瓶中,滴加足量酸性高锰酸钾将VO2+完全转化为VO
 。
。③滴加亚硝酸钠溶液反应掉过量的高锰酸钾,加入2mL尿素溶液至溶液不再产生气泡。已知:尿素不直接与亚硝酸盐反应,但可将亚硝酸转化为氮气;亚硝酸可将VO
 转化为VO2+。
转化为VO2+。④加入10mL硫酸-磷酸混酸调节pH=0,滴入指示剂用0.05mol·L-1硫酸亚铁铵标准溶液(Fe2+将VO
 转化为VO2+)滴定至终点。测量三次,消耗标准溶液平均体积为10.00mL。
转化为VO2+)滴定至终点。测量三次,消耗标准溶液平均体积为10.00mL。ⅰ.实验过程中,下列操作会导致所测钒含量偏高的是
A.预处理过程中加入尿素的量不足
B.盛装硫酸亚铁铵标准液的滴定管未润洗
C.滴定管读数时,开始时仰视刻度线,结束时平视刻度线
D.滴定前滴定管有气泡,滴定结束后发现滴定管内无气泡
ⅱ.测得硫酸氧钒晶体中钒的质量分数为
Ⅱ.制备V2O5:VOCl3与氨水沉钒生成NH4VO3,NH4VO3加热分解生成V2O5。沉钒率与钒溶液浓度、氨解温度的关系如图-3、图-4所示。

为确定较适宜的沉钒条件,请结合上图曲线,补充完整“探究氨水浓度对沉钒率的影响”的实验方案:
您最近一年使用:0次
2022-12-17更新
|
752次组卷
|
4卷引用:黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(21-24)
(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(21-24)(已下线)河北省部分学校2022-2023学年高三上学期期末考试变式汇编(14-17)江苏省南京师范大学附属中学、天一中学、海安中学、海门中学2022-2023学年高三上学期12月联考化学试题江苏省无锡市天一中学等四校2022-2023学年高三上学期联考化学试题
名校
5 . 葡萄酒中添加的SO2有抗氧化和杀菌等作用。中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g/L。
1.SO2的制取和部分性质研究。
(1)下列实验室制取、验证漂白性、收集及尾气处理的装置和原理能达到实验目的的是_______ 。

(2)设计实验验证SO2与Fe2+还原性的强弱(可供选择的试剂有:FeCl2溶液、氯水、KSCN溶液、Ba(NO3)2溶液、BaCl2溶液、KMnO4溶液)。取SO2的饱和溶液,向其中滴加少量FeCl3溶液,充分反应。将反应后混合液分成甲、乙两份。
向甲中滴加_______ 溶液,观察到_______ ,可知混合液中无Fe3+;
向乙中滴加_______ 溶液,观察到_______ ,可知混合液中有_______
由此得出结论:SO2的还原性强于Fe2+。
2.葡萄酒中SO2的检测。
(3)检测干白葡萄酒(液体为无色)中的SO2或 。设计如图1的实验:
。设计如图1的实验:
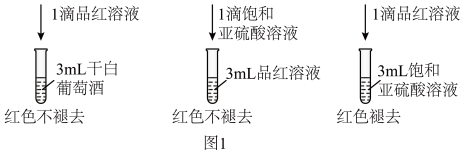
甲同学得出实验结论:干白葡萄酒中不含SO2或 。这个结论是否合理
。这个结论是否合理_______ (填“是”或“否”)说明理由_______ 。
(4)某兴趣小组用图2装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定。
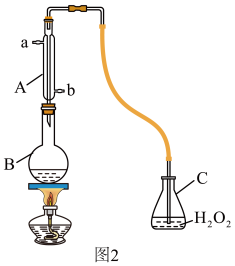
实验步骤:
i.检查装置的气密性后,向图2仪器B中加入300.00mL葡萄酒和适量盐酸
ii.加热使SO2全部逸出并与C中H2O2完全反应
iii.除去C中过量的H2O2
iv.用0.0900mol/LNaOH标准溶液进行滴定
回答下列问题:
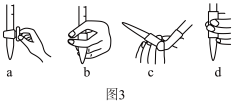
①A的进水口为_______ ,滴定前排气泡时,应选择图3中的_______ 。
②C中反应生成物的化学式是_______ ,除去过量H2O2的方法是_______ 。
③滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为_______ g/L,是否符合国家标准_______ (填“是”或“否”)。
④下列操作使测定结果比实际值偏高的是_______ 。
a.B中加入的盐酸挥发
b.滴定终点读取滴定管刻度时,俯视标准液液面
c.配制NaOH标准溶液时,未等烧杯中溶液冷却至室温即转移定容
1.SO2的制取和部分性质研究。
(1)下列实验室制取、验证漂白性、收集及尾气处理的装置和原理能达到实验目的的是

(2)设计实验验证SO2与Fe2+还原性的强弱(可供选择的试剂有:FeCl2溶液、氯水、KSCN溶液、Ba(NO3)2溶液、BaCl2溶液、KMnO4溶液)。取SO2的饱和溶液,向其中滴加少量FeCl3溶液,充分反应。将反应后混合液分成甲、乙两份。
向甲中滴加
向乙中滴加
由此得出结论:SO2的还原性强于Fe2+。
2.葡萄酒中SO2的检测。
(3)检测干白葡萄酒(液体为无色)中的SO2或
 。设计如图1的实验:
。设计如图1的实验:
甲同学得出实验结论:干白葡萄酒中不含SO2或
 。这个结论是否合理
。这个结论是否合理(4)某兴趣小组用图2装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定。

实验步骤:
i.检查装置的气密性后,向图2仪器B中加入300.00mL葡萄酒和适量盐酸
ii.加热使SO2全部逸出并与C中H2O2完全反应
iii.除去C中过量的H2O2
iv.用0.0900mol/LNaOH标准溶液进行滴定
回答下列问题:
①A的进水口为

②C中反应生成物的化学式是
③滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为
④下列操作使测定结果比实际值偏高的是
a.B中加入的盐酸挥发
b.滴定终点读取滴定管刻度时,俯视标准液液面
c.配制NaOH标准溶液时,未等烧杯中溶液冷却至室温即转移定容
您最近一年使用:0次
名校
解题方法
6 . 下列有关物质结构和性质变化规律正确的是
| A.还原性:HF>HCl>HBr | B.碱性:KOH>Ca(OH)2>Mg(OH)2 |
| C.沸点:H2O>H2S>H2Se | D.金属活动性:Al>Mg>Na |
您最近一年使用:0次
2020-12-29更新
|
388次组卷
|
4卷引用:黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(1-10)
(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(1-10)上海市嘉定区2021届高三一模化学试题上海市黄浦区格致中学2020-2021学年高二上学期期末化学试题上海市宝山中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
7 . 用如图所示装置进行下列实验,装置正确并能达到实验目的的是
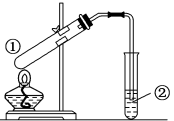

| 选项 | ①中试剂 | 2中溶液 | 实验目的 |
| A | 浓硫酸、无水乙醇(沸石) | 酸性高锰酸钾溶液 | 检验有乙烯气体生成 |
| B | Cu、浓硫酸 | 溴水 | 验证 的还原性 的还原性 |
| C | 乙醇、乙酸、浓硫酸 | 饱和碳酸钠溶液 | 制取乙酸乙酯 |
| D | 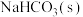 | 澄清石灰水 | 验证 的热稳定性 的热稳定性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-31更新
|
465次组卷
|
5卷引用:黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(11-20)
(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(11-20)(已下线)第九章 化学实验基础及综合实验(测)-2023年高考化学一轮复习讲练测(全国通用)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试化学试题海南省海口市2022届高三学生学科能力诊断(二)化学试题河南省信阳高级中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
8 . 下列实验装置能达到实验目的的是


| A.用甲装置除去CO2中的少量SO2气体 |
| B.用乙装置完成实验室制取乙酸乙酯 |
| C.用丙装置证明温度对化学平衡的影响 |
| D.用丁装置验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、氧化性 |
您最近一年使用:0次
2021-10-12更新
|
479次组卷
|
4卷引用:黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(11-20)
(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(11-20)陕西省西咸新区黄冈泾河中学2022届高三第1次模拟考试化学试题(已下线)一轮巩固卷7-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)内蒙古赤峰市2021-2022学年高三上学期期末考试化学试题
名校
9 . 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。某实验小组模拟工业制备硫氰化钾的方法,设计实验如图:
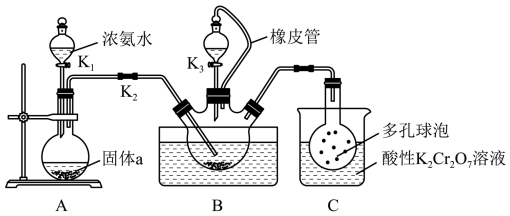
已知: 是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
Ⅰ.制备 溶液
溶液
(1)装置A用于制备 ,圆底烧瓶内的固体a是
,圆底烧瓶内的固体a是_______ (填名称)。
(2)三颈烧瓶内盛放有 、水和固体催化剂,发生反应
、水和固体催化剂,发生反应 。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入
。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入 中,其目的是使反应更充分且
中,其目的是使反应更充分且_______ 。
(3)一段时间后,当观察到三颈烧瓶内_______ 时,停止通入气体,反应完成。
Ⅱ.制备KSCN溶液
(4)关闭K1,将三颈烧瓶继续加热至100℃,待 完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为
完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为_______ ;酸性 溶液除可以吸收
溶液除可以吸收 外,还能吸收的气体是
外,还能吸收的气体是_______ 。
Ⅲ.制备KSCN晶体
先通过过滤除去三颈烧瓶中的固体催化剂,再通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。
(5)测定晶体中KSCN的含量:称取10.0 g样品,配成1000 mL溶液。量取25.00 mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000 mol/L 标准溶液滴定,达到滴定终点,三次滴定平均消耗
标准溶液滴定,达到滴定终点,三次滴定平均消耗 标准溶液20.00 mL。
标准溶液20.00 mL。
①滴定时发生的反应: (白色),则指示剂的化学式为
(白色),则指示剂的化学式为_______ (填序号)。则滴定终点的现象是_______ 。
A. B.
B. C.
C. D.
D.
②晶体中KSCN的质量分数为_______ (计算结果保留三位有效数字)。

已知:
 是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:Ⅰ.制备
 溶液
溶液(1)装置A用于制备
 ,圆底烧瓶内的固体a是
,圆底烧瓶内的固体a是(2)三颈烧瓶内盛放有
 、水和固体催化剂,发生反应
、水和固体催化剂,发生反应 。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入
。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入 中,其目的是使反应更充分且
中,其目的是使反应更充分且(3)一段时间后,当观察到三颈烧瓶内
Ⅱ.制备KSCN溶液
(4)关闭K1,将三颈烧瓶继续加热至100℃,待
 完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为
完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为 溶液除可以吸收
溶液除可以吸收 外,还能吸收的气体是
外,还能吸收的气体是Ⅲ.制备KSCN晶体
先通过过滤除去三颈烧瓶中的固体催化剂,再通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。
(5)测定晶体中KSCN的含量:称取10.0 g样品,配成1000 mL溶液。量取25.00 mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000 mol/L
 标准溶液滴定,达到滴定终点,三次滴定平均消耗
标准溶液滴定,达到滴定终点,三次滴定平均消耗 标准溶液20.00 mL。
标准溶液20.00 mL。①滴定时发生的反应:
 (白色),则指示剂的化学式为
(白色),则指示剂的化学式为A.
 B.
B. C.
C. D.
D.
②晶体中KSCN的质量分数为
您最近一年使用:0次
2022-12-31更新
|
474次组卷
|
5卷引用:黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(21-24)
(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(21-24)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试化学试题(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(实验探究题)福建省三明市2022-2023学年高三上学期期末考试化学试题江苏省盐城市北京师范大学盐城附属学校2023届高三上学期期末考试化学试题
名校
解题方法
10 . 两种有机物的结构简式如下图所示,下列说法正确的是
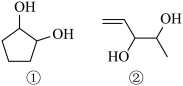

| A.二者都能使Br2的CCl4溶液和酸性高锰酸钾溶液褪色 |
| B.①②都可以和NaOH溶液反应,且①的一氯代物有3种 |
| C.等质量的①和②分别与足量钠反应生成等质量的H2,两者都能氧化成醛 |
| D.两者互为同分异构体,分子式均为C5H10O2 |
您最近一年使用:0次



