名校
1 . 某实验室以烃A为原料合成交联剂H的路线(部分反应条件略去)如图所示:
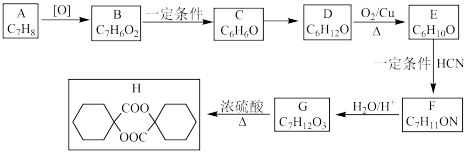
(1)B中C原子的杂化方式是__________ 。
(2)C→D的反应类型为__________ 。
(3)写出E→F的化学方程式:__________ ,F分子中含有的手性碳原子的个数为__________ 。
(4)已知:两个—OH连在同一个碳原子上的结构不稳定。则满足下列条件且具有稳定结构的G的同分异构体有__________ 种(不含立体异构)。
①分子中含六元碳环,不含其他环状结构;
②分子中含有三个取代基且能发生银镜反应。
(5)参照题干中的合成路线,设计以苯乙酮(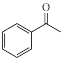 )和甲醇为主要原料制备
)和甲醇为主要原料制备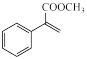 的合成路线
的合成路线__________ (无机试剂任选)。

(1)B中C原子的杂化方式是
(2)C→D的反应类型为
(3)写出E→F的化学方程式:
(4)已知:两个—OH连在同一个碳原子上的结构不稳定。则满足下列条件且具有稳定结构的G的同分异构体有
①分子中含六元碳环,不含其他环状结构;
②分子中含有三个取代基且能发生银镜反应。
(5)参照题干中的合成路线,设计以苯乙酮(
 )和甲醇为主要原料制备
)和甲醇为主要原料制备 的合成路线
的合成路线
您最近一年使用:0次
名校
解题方法
2 . 奥司他韦是一种高效、高选择性神经氨酸酶抑制剂,是目前治疗流感的最常用药物之一,是公认的抗禽流感、甲型H1N1等病毒最有效的药物之一。其合成路线如图所示:
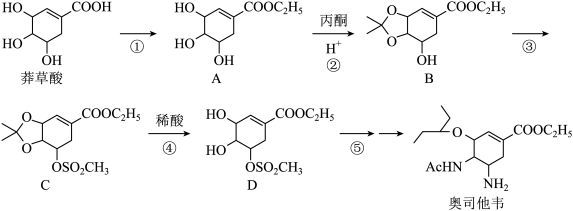
回答下列问题:
(1)莽草酸的含氧官能团名称有_______ ;反应③的反应类型_______ 。
(2)反应①的反应试剂和反应条件_______ 。
(3)1molB最多可以消耗_______ molNaOH溶液。
(4)请写出反应②的化学方程式_______ 。
(5)芳香化合物X是B的同分异构体,则符合官能团只含酚羟基的X有_______ 种。
(6)设计由对甲基苯甲醛制备对醛基苯甲酸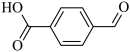 的合成路线
的合成路线_______ 。
(7)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)相对分子质量为Mr)半导体作为吸光材料, 具有钙钛矿
具有钙钛矿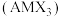 的立方结构,其晶胞如图所示。
的立方结构,其晶胞如图所示。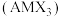 晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则X处于
晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则X处于_______ 位置。 晶体的晶胞参数为a nm,其晶体密度为d g·cm-3,则阿伏加德罗常数的值NA的计算表达式为
晶体的晶胞参数为a nm,其晶体密度为d g·cm-3,则阿伏加德罗常数的值NA的计算表达式为_______ 。


回答下列问题:
(1)莽草酸的含氧官能团名称有
(2)反应①的反应试剂和反应条件
(3)1molB最多可以消耗
(4)请写出反应②的化学方程式
(5)芳香化合物X是B的同分异构体,则符合官能团只含酚羟基的X有
(6)设计由对甲基苯甲醛制备对醛基苯甲酸
 的合成路线
的合成路线(7)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)相对分子质量为Mr)半导体作为吸光材料,
 具有钙钛矿
具有钙钛矿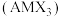 的立方结构,其晶胞如图所示。
的立方结构,其晶胞如图所示。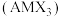 晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则X处于
晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则X处于 晶体的晶胞参数为a nm,其晶体密度为d g·cm-3,则阿伏加德罗常数的值NA的计算表达式为
晶体的晶胞参数为a nm,其晶体密度为d g·cm-3,则阿伏加德罗常数的值NA的计算表达式为
您最近一年使用:0次
名校
3 . 布洛芬在临床上广泛用来治疗感冒发热、头痛、神经痛、风湿性类关节痛等,其人工合成路线如图:

(1)A→B的反应类型为_____ 。
(2)C分子中碳原子的杂化轨道类型为_____ 。
(3)D是C的同分异构体,D→E的另一产物可以循环使用,D结构简式为_____ 。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_____ 。
(i)分子中含有苯环;(ii)分子中只有3种不同化学环境的氢
(5)布洛芬在水中的溶解度_____ (填“大”或“小”)。
(6)写出以乙烯、苯酚为原料制备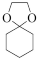 的合成路线流程图。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。_____ 。

(1)A→B的反应类型为
(2)C分子中碳原子的杂化轨道类型为
(3)D是C的同分异构体,D→E的另一产物可以循环使用,D结构简式为
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
(i)分子中含有苯环;(ii)分子中只有3种不同化学环境的氢
(5)布洛芬在水中的溶解度
(6)写出以乙烯、苯酚为原料制备
 的合成路线流程图。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.某气态烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,以A为原料的有机合成路线如下:

已知: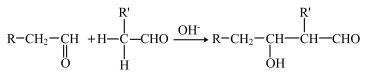
(1)D的核磁共振氢谱中有_______ 组峰,E中官能团名称_______ ,F的结构简式为_______ 。
(2)B→C的化学反应方程式为_______ 。
(3)F→G的反应类型为_______ 。
(4)H→I的化学反应方程式为_______ 。
Ⅱ.碳元素不仅可以形成大量的有机物,也可以形成无机物,例如金刚石。氮化硼晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被B原子代替。根据所学知识回答以下问题。
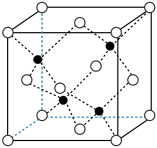
(5)BN晶体其晶胞参数为a pm,与同一个B原子相连的N原子构成的空间结构为_______ ,相邻的N与B之间的最近距离为_______ pm。BN的摩尔质量为M g·mol-1,阿伏加德罗常数的值为 ,则BN晶体的密度为
,则BN晶体的密度为_______ g·cm-3。
(6)晶体中距离同一个B原子最近的其他B原子个数为_______ 。
(7)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,1原子的分数坐标为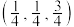 ,则4原子的分数坐标是
,则4原子的分数坐标是_______ 。


已知:

(1)D的核磁共振氢谱中有
(2)B→C的化学反应方程式为
(3)F→G的反应类型为
(4)H→I的化学反应方程式为
Ⅱ.碳元素不仅可以形成大量的有机物,也可以形成无机物,例如金刚石。氮化硼晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被B原子代替。根据所学知识回答以下问题。

(5)BN晶体其晶胞参数为a pm,与同一个B原子相连的N原子构成的空间结构为
 ,则BN晶体的密度为
,则BN晶体的密度为(6)晶体中距离同一个B原子最近的其他B原子个数为
(7)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,1原子的分数坐标为
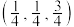 ,则4原子的分数坐标是
,则4原子的分数坐标是
您最近一年使用:0次
解题方法
5 . 抗疟疾药物阿莫地喹的合成路线如下图。

回答下列问题:
(1)A中含氧官能团的名称为__________ 和__________ 。
(2)由A生成C的反应类型为__________ 。
(3)D的结构简式为__________ 。
(4)多聚甲醛可以用甲醛代替,则H、I和甲醛反应生成J的方程式为____________________ 。
(5)H的同分异构体中,含羧基、苯环,不含氨基( )的有
)的有__________ 种(不考虑立体异构)。
(6)抗癌药物乐伐替尼中间体的合成路线如下图(部分反应条件已略去),其中M和N的结构简式分别为__________ 和__________ 。
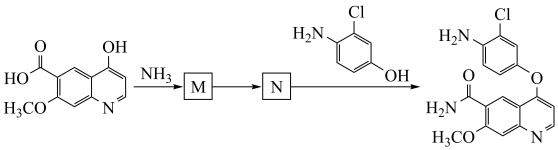

回答下列问题:
(1)A中含氧官能团的名称为
(2)由A生成C的反应类型为
(3)D的结构简式为
(4)多聚甲醛可以用甲醛代替,则H、I和甲醛反应生成J的方程式为
(5)H的同分异构体中,含羧基、苯环,不含氨基(
 )的有
)的有(6)抗癌药物乐伐替尼中间体的合成路线如下图(部分反应条件已略去),其中M和N的结构简式分别为

您最近一年使用:0次
名校
6 . Ⅰ. 3,4 -二羟基肉桂酸乙酯(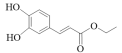 ) 具有抗炎作用和治疗自身免疫性疾病的潜力,由气体A制备该物质的合成路线如下:
) 具有抗炎作用和治疗自身免疫性疾病的潜力,由气体A制备该物质的合成路线如下:
已知:①A与氢气的相对密度为14
② +
+
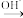
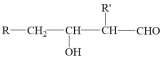
回答下列问题:
(1)A的名称为___________ 。C的结构简式为___________ 。
(2)E→F的化学反应方程式为___________ 。
(3)F→G①的反应类型为___________ 。
(4)H→I的化学反应方程式为___________ 。
Ⅱ.氮元素是地球上含量丰富的一种元素,不仅是制造农药、医药的重要元素,也是构成蛋白质的重要元素。根据所学知识回答以下问题。
(5)基态N原子的成对电子数与未成对电子数之比为_______ , 离子的空间构型为
离子的空间构型为_______ 。
(6)N-甲基咪唑( )是一种有机化合物,可作为有机合成中间体和树脂固化N剂,其中碳原子杂化方式为
)是一种有机化合物,可作为有机合成中间体和树脂固化N剂,其中碳原子杂化方式为________ ,所含元素第一电离能由大到小的顺序是_______ 。
(7)TiO2-aNb是常见的光学活性物质,由TiO2通过氮掺杂反应生成,表示如下图。
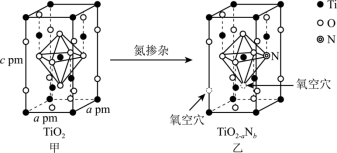
立方晶系TiO2晶胞参数如图甲所示,其晶体的密度为_______ g·cm-3(写计算式, NA代表阿伏加德罗常数)。
 ) 具有抗炎作用和治疗自身免疫性疾病的潜力,由气体A制备该物质的合成路线如下:
) 具有抗炎作用和治疗自身免疫性疾病的潜力,由气体A制备该物质的合成路线如下:
已知:①A与氢气的相对密度为14
②
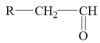 +
+

回答下列问题:
(1)A的名称为
(2)E→F的化学反应方程式为
(3)F→G①的反应类型为
(4)H→I的化学反应方程式为
Ⅱ.氮元素是地球上含量丰富的一种元素,不仅是制造农药、医药的重要元素,也是构成蛋白质的重要元素。根据所学知识回答以下问题。
(5)基态N原子的成对电子数与未成对电子数之比为
 离子的空间构型为
离子的空间构型为(6)N-甲基咪唑(
 )是一种有机化合物,可作为有机合成中间体和树脂固化N剂,其中碳原子杂化方式为
)是一种有机化合物,可作为有机合成中间体和树脂固化N剂,其中碳原子杂化方式为(7)TiO2-aNb是常见的光学活性物质,由TiO2通过氮掺杂反应生成,表示如下图。

立方晶系TiO2晶胞参数如图甲所示,其晶体的密度为
您最近一年使用:0次
名校
解题方法
7 . 吡唑类化合物G是一种重要的医用中间体,也可作为某些光敏材料、染料的原材料。其合成路线如下:
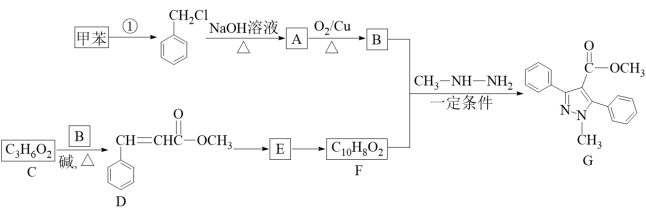
已知:
Ⅰ.R1-CHO+R2CH2-COOR3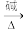
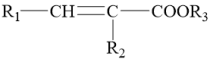
Ⅱ.R1-CHO+R2NH2 R1-CH=N-R2
R1-CH=N-R2
(1)反应①所需试剂、条件分别是_______ ,C的名称是_______
(2)A→B的化学方程式为_______
(3)测定E所含化学键和官能团的仪器应选用_______
(4)若D与液溴发生加成反应生成E,写出在碱醇条件下E生成F的化学方程式_______
(5)X为D的同分异构体,写出满足如下条件X的结构简式_______
①含有苯环;
②核磁共振氢谱有三组峰,峰面积之比为2:2:1;
③1mol X与足量银氨溶液反应生成4mol Ag
(6)吡唑 (C3H4N2)是无色针状晶体,分子中具有类似于苯的5中心6电子π键,可作为配体与金属阳离子形成配位键。分子中两个“N”原子更易形成配位键的是
(C3H4N2)是无色针状晶体,分子中具有类似于苯的5中心6电子π键,可作为配体与金属阳离子形成配位键。分子中两个“N”原子更易形成配位键的是_______ (填“1”或“2”),原因是_______
(7)噻吩 (C4H4S)是一种无色、有恶臭、能催泪的液体,虽相对分子质量大于吡唑但是熔沸点较低的原因是
(C4H4S)是一种无色、有恶臭、能催泪的液体,虽相对分子质量大于吡唑但是熔沸点较低的原因是_______

已知:
Ⅰ.R1-CHO+R2CH2-COOR3
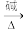

Ⅱ.R1-CHO+R2NH2
 R1-CH=N-R2
R1-CH=N-R2(1)反应①所需试剂、条件分别是
(2)A→B的化学方程式为
(3)测定E所含化学键和官能团的仪器应选用_______
| A.元素分析仪 | B.质谱仪 | C.红外光谱仪 | D.分光光度计 |
(5)X为D的同分异构体,写出满足如下条件X的结构简式
①含有苯环;
②核磁共振氢谱有三组峰,峰面积之比为2:2:1;
③1mol X与足量银氨溶液反应生成4mol Ag
(6)吡唑
 (C3H4N2)是无色针状晶体,分子中具有类似于苯的5中心6电子π键,可作为配体与金属阳离子形成配位键。分子中两个“N”原子更易形成配位键的是
(C3H4N2)是无色针状晶体,分子中具有类似于苯的5中心6电子π键,可作为配体与金属阳离子形成配位键。分子中两个“N”原子更易形成配位键的是(7)噻吩
 (C4H4S)是一种无色、有恶臭、能催泪的液体,虽相对分子质量大于吡唑但是熔沸点较低的原因是
(C4H4S)是一种无色、有恶臭、能催泪的液体,虽相对分子质量大于吡唑但是熔沸点较低的原因是
您最近一年使用:0次
名校
8 . I.利用如图所示装置测定中和热的实验步骤如下:
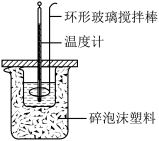
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是_______ (填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)此实验不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_______ 。
II.碘化钾常用作合成有机化合物的原料。某实验小组设计实验探究KI的还原性。探究不同条件下空气中氧气氧化KI的速率。
(3)酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为_______ 。
(4)设计实验组别3的目的是_______ 。
III.探究反应“2Fe3++2I- 2Fe2++I2”为可逆反应。
2Fe2++I2”为可逆反应。
试剂:0.01 mol·L-1KI溶液,0.005 mol·L-1 Fe2SO4溶液,淀粉溶液,0.01 mol·L-1AgNO3溶液,KSCN溶液。实验如下:

(5)甲同学通过试管i和试管ii中现象结合可证明该反应为可逆反应,则试管i中现象为_______ ;乙同学认为该现象无法证明该反应为可逆反应,原因为_______ 。
(6)请选择上述试剂重新设计实验,证明该反应为可逆反应:_______ 。

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)此实验不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是
II.碘化钾常用作合成有机化合物的原料。某实验小组设计实验探究KI的还原性。探究不同条件下空气中氧气氧化KI的速率。
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 蒸馏水 | 淀粉溶液 | ||
| c(KI) | V | c(H2SO4) | V | ||||
| 1 | 298K | 0.01 mol·L-1 | 5 mL | 0.1 mol·L-1 | 5 mL | 10 mL | 3滴 |
| 2 | 313K | 0.01 mol·L-1 | a mL | b mol·L-1 | 5 mL | 10 mL | 3滴 |
| 3 | 298K | 0.05 mol·L-1 | 10 mL | 0.2 mol·L-1 | 5 mL | 5 mL | 3滴 |
(4)设计实验组别3的目的是
III.探究反应“2Fe3++2I-
 2Fe2++I2”为可逆反应。
2Fe2++I2”为可逆反应。试剂:0.01 mol·L-1KI溶液,0.005 mol·L-1 Fe2SO4溶液,淀粉溶液,0.01 mol·L-1AgNO3溶液,KSCN溶液。实验如下:

(5)甲同学通过试管i和试管ii中现象结合可证明该反应为可逆反应,则试管i中现象为
(6)请选择上述试剂重新设计实验,证明该反应为可逆反应:
您最近一年使用:0次
解题方法
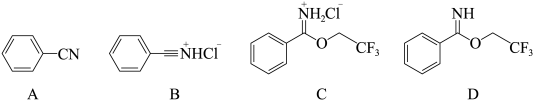
9 . 芳基亚胺酯是重要的有机反应中间体,受热易分解,可由腈在酸催化下与醇发生Pinner反应制备,原理如下图所示。
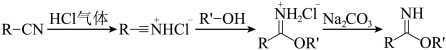
某实验小组以苯甲腈(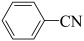 ,
,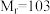 )和三氟乙醇(
)和三氟乙醇(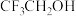 ,
,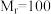 ) 为原料合成苯甲亚胺三氟乙酯。步骤如下:
) 为原料合成苯甲亚胺三氟乙酯。步骤如下:
I.将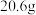 苯甲腈与
苯甲腈与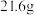 三氟乙醇置于容器中,冰浴降温至
三氟乙醇置于容器中,冰浴降温至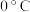 。
。
Ⅱ.向容器中持续通入 气体4小时,密封容器。
气体4小时,密封容器。
Ⅲ.室温下在 氛围中继续搅拌反应液24小时,冷却至
氛围中继续搅拌反应液24小时,冷却至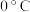 ,抽滤得白色固体,用乙腈洗涤。
,抽滤得白色固体,用乙腈洗涤。
IV.将洗涤后的白色固体加入饱和 溶液中,低温下反应,有机溶剂萃取3次,合并有机相。
溶液中,低温下反应,有机溶剂萃取3次,合并有机相。
V.向有机相中加入无水 ,过滤,蒸去溶剂得产品
,过滤,蒸去溶剂得产品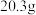 。
。
回答下列问题:
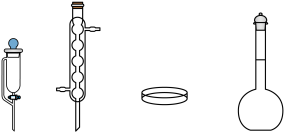
(1)实验室中可用浓盐酸和无水 制备干燥
制备干燥 气体,下列仪器中一定需要的为
气体,下列仪器中一定需要的为__________ (填仪器名称)。
(2)第Ⅱ步通气完毕后,容器密封的原因为__________ 。
(3)第Ⅲ步中得到的白色固体主要成分为__________ 。
(4)第IV步中选择低温的原因为__________ 。
(5)第IV步萃取时可选用的有机溶剂为__________。
(6)第V步中无水 的作用为
的作用为____________________ 。
(7)本实验的产率为__________ 。
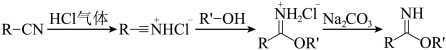
某实验小组以苯甲腈(
 ,
,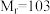 )和三氟乙醇(
)和三氟乙醇(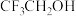 ,
,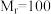 ) 为原料合成苯甲亚胺三氟乙酯。步骤如下:
) 为原料合成苯甲亚胺三氟乙酯。步骤如下:I.将
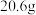 苯甲腈与
苯甲腈与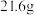 三氟乙醇置于容器中,冰浴降温至
三氟乙醇置于容器中,冰浴降温至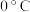 。
。Ⅱ.向容器中持续通入
 气体4小时,密封容器。
气体4小时,密封容器。Ⅲ.室温下在
 氛围中继续搅拌反应液24小时,冷却至
氛围中继续搅拌反应液24小时,冷却至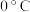 ,抽滤得白色固体,用乙腈洗涤。
,抽滤得白色固体,用乙腈洗涤。IV.将洗涤后的白色固体加入饱和
 溶液中,低温下反应,有机溶剂萃取3次,合并有机相。
溶液中,低温下反应,有机溶剂萃取3次,合并有机相。V.向有机相中加入无水
 ,过滤,蒸去溶剂得产品
,过滤,蒸去溶剂得产品 。
。回答下列问题:
(1)实验室中可用浓盐酸和无水
 制备干燥
制备干燥 气体,下列仪器中一定需要的为
气体,下列仪器中一定需要的为
(2)第Ⅱ步通气完毕后,容器密封的原因为
(3)第Ⅲ步中得到的白色固体主要成分为

(4)第IV步中选择低温的原因为
(5)第IV步萃取时可选用的有机溶剂为__________。
| A.丙酮 | B.乙酸 | C.乙酸乙酯 | D.甲醇 |
(6)第V步中无水
 的作用为
的作用为(7)本实验的产率为
您最近一年使用:0次
名校
解题方法
10 . 二氧化碳的综合利用是实现碳达峰、碳中和的关键。
I.利用 和
和 合成甲醇,涉及的主要反应如下:
合成甲醇,涉及的主要反应如下:
已知:a.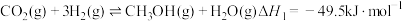
b.
c.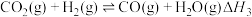
(1)计算
_______ 。
(2)一定条件下,向密闭容器中充入物质的量之比为1:3的 和
和 发生上述反应,使用不同催化剂经相同反应时间,
发生上述反应,使用不同催化剂经相同反应时间, 的转化率和甲醇的选择性随温度的变化如图所示:
的转化率和甲醇的选择性随温度的变化如图所示:

甲醇的选择性
①210-270℃间,在甲醇的选择性上,催化效果较好的是_______ 。
②210-270℃间,催化剂2条件下 的转化率随温度的升高而增大,可能原因为
的转化率随温度的升高而增大,可能原因为_______ 。
II.工业上用 和
和 通过如下反应合成尿素
通过如下反应合成尿素 :
: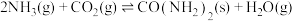 。t℃时,向容积恒定为
。t℃时,向容积恒定为 的密闭容器中充入
的密闭容器中充入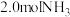 和
和 发生反应。
发生反应。
(3)下列能说明反应达到化学平衡状态的是_______ (填字母)。
a.相同时间内,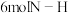 键断裂,同时有
键断裂,同时有 键形成
键形成
b.容器内气体总压强不再变化
c.
d.容器内气体的密度不再改变
(4) 的物质的量随时间的变化如下表所示:
的物质的量随时间的变化如下表所示:
 的平衡转化率为
的平衡转化率为_______ ;t°C时,该反应的平衡常数K=_______ 。
III.中科院研究所利用 和甲酸(HCOOH)的相互转化设计并实现了一种可逆的水系金属二氧化碳电池,结构如图所示:
和甲酸(HCOOH)的相互转化设计并实现了一种可逆的水系金属二氧化碳电池,结构如图所示:
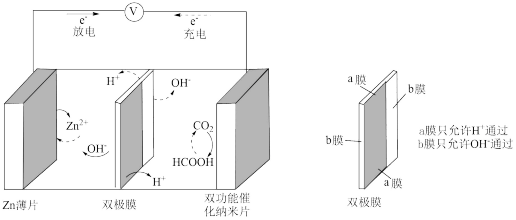
(5)放电时,正极上的电极反应为_______ ;若电池工作时产生a库仑的电量,则理论上消耗锌的质量为_______ g。(已知:转移1mol电子所产生的电量为96500库仑)
I.利用
 和
和 合成甲醇,涉及的主要反应如下:
合成甲醇,涉及的主要反应如下:已知:a.
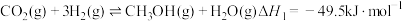
b.

c.
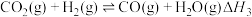
(1)计算

(2)一定条件下,向密闭容器中充入物质的量之比为1:3的
 和
和 发生上述反应,使用不同催化剂经相同反应时间,
发生上述反应,使用不同催化剂经相同反应时间, 的转化率和甲醇的选择性随温度的变化如图所示:
的转化率和甲醇的选择性随温度的变化如图所示:
甲醇的选择性

①210-270℃间,在甲醇的选择性上,催化效果较好的是
②210-270℃间,催化剂2条件下
 的转化率随温度的升高而增大,可能原因为
的转化率随温度的升高而增大,可能原因为II.工业上用
 和
和 通过如下反应合成尿素
通过如下反应合成尿素 :
: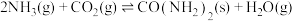 。t℃时,向容积恒定为
。t℃时,向容积恒定为 的密闭容器中充入
的密闭容器中充入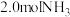 和
和 发生反应。
发生反应。(3)下列能说明反应达到化学平衡状态的是
a.相同时间内,
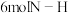 键断裂,同时有
键断裂,同时有 键形成
键形成b.容器内气体总压强不再变化
c.

d.容器内气体的密度不再改变
(4)
 的物质的量随时间的变化如下表所示:
的物质的量随时间的变化如下表所示:| 时间/min | 0 | 30 | 70 | 80 | 100 |
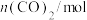 | 1.6 | l.0 | 0.8 | 0.8 | 0.8 |
 的平衡转化率为
的平衡转化率为III.中科院研究所利用
 和甲酸(HCOOH)的相互转化设计并实现了一种可逆的水系金属二氧化碳电池,结构如图所示:
和甲酸(HCOOH)的相互转化设计并实现了一种可逆的水系金属二氧化碳电池,结构如图所示:
(5)放电时,正极上的电极反应为
您最近一年使用:0次



