2014高三·四川·专题练习
1 . 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是______ 。
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为______ mol。
(2)目前已开发出用电解法制取ClO2的新工艺。

①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生ClO2的电极反应式为______ 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为______ mol,用平衡移动原理解释阴极区pH增大的原因:______ 。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN-a mg/L,现用ClO2将CN-氧化,产物中有两种气体生成,其离子反应方程式为______ ;处理100 m3这种污水,至少需要ClO2______ mol。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为
(2)目前已开发出用电解法制取ClO2的新工艺。

①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生ClO2的电极反应式为
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN-a mg/L,现用ClO2将CN-氧化,产物中有两种气体生成,其离子反应方程式为
您最近一年使用:0次
名校
2 . 高铁酸钾(K2FeO4)是一种高效的水处理剂,实验室制备K2FeO4的装置如图所示。(夹持装置略去)
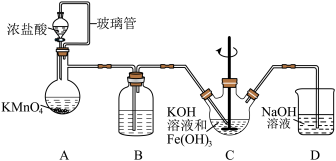
查阅K2FeO4资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,KMnO4体现的性质是___________ ,玻璃管的作用是___________ 。
(2)装置B中盛放的试剂是___________ 。
(3)装置C中KOH溶液过量的目的是___________ 。搅拌操作,除了防止因局部溶液碱性减弱,使K2FeO4与水反应产生Fe(OH)3和O2,另外的作用是___________ 。
(4)装置C中生成K2FeO4的离子方程式为___________ 。该反应放热,不利于K2FeO4固体析出,写出一条实验改进措施___________ 。
(5)反应结束后过滤装置C中浊液,得到K2FeO4粗产品,用冷的3 mo·L-1KOH溶液洗涤粗产品后,再用___________ 除水。(填标号)
a.苯 b.浓硫酸 c.异丙醇
(6)装置D的作用是___________ 。

查阅K2FeO4资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,KMnO4体现的性质是
(2)装置B中盛放的试剂是
(3)装置C中KOH溶液过量的目的是
(4)装置C中生成K2FeO4的离子方程式为
(5)反应结束后过滤装置C中浊液,得到K2FeO4粗产品,用冷的3 mo·L-1KOH溶液洗涤粗产品后,再用
a.苯 b.浓硫酸 c.异丙醇
(6)装置D的作用是
您最近一年使用:0次
2023-09-07更新
|
583次组卷
|
3卷引用:实验综合题
名校
解题方法
3 . 硫代硫酸钠( )是常见的化学试剂,应用广泛。工业上可用反应:
)是常见的化学试剂,应用广泛。工业上可用反应: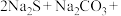
 制得,实验室模拟该工业过程的装置如图所示(夹持装置已略去,C中
制得,实验室模拟该工业过程的装置如图所示(夹持装置已略去,C中 过量):
过量):

已知: 遇酸易分解,离子方程式可以表示为:
遇酸易分解,离子方程式可以表示为: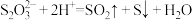
回答下列问题:
(1)仪器M的名称是_______ 。
(2)由装置A制取 ,选用质量分数为70%的浓硫酸的原因
,选用质量分数为70%的浓硫酸的原因_______ (填标号)。
①硫酸浓度太大,溶液中氢离子浓度太小,不利于 的生成;
的生成;
②硫酸浓度太小,溶液中水太多, 易溶于水,损耗太大;
易溶于水,损耗太大;
③硫酸浓度太大,溶液氧化性太强, 还原性强,损耗太大;
还原性强,损耗太大;
(3)该套装置设计最明显的缺陷是_______ 。为了解决该问题,请从下图中选用最合理装置(夹持仪器已略去)为_______ (填标号)。
a. b.
b.  c.
c.  d.
d. 
(4) 还原性较强,在溶液中易被
还原性较强,在溶液中易被 氧化成
氧化成 ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为_______ 。
(5)工业上可用如下方法测定 的纯度:取m g样品溶于稀硫酸,加入足量KI溶液,再加入c mol/L的
的纯度:取m g样品溶于稀硫酸,加入足量KI溶液,再加入c mol/L的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液V mL。
溶液V mL。
相关反应: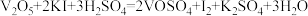 ;
;
①如果稀硫酸过多,测得结果会_______ (填“偏高”“偏低”或“无影响”);
②该样品中 的质量分数为
的质量分数为_______ (假设杂质不参与反应)。
 )是常见的化学试剂,应用广泛。工业上可用反应:
)是常见的化学试剂,应用广泛。工业上可用反应: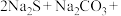
 制得,实验室模拟该工业过程的装置如图所示(夹持装置已略去,C中
制得,实验室模拟该工业过程的装置如图所示(夹持装置已略去,C中 过量):
过量):
已知:
 遇酸易分解,离子方程式可以表示为:
遇酸易分解,离子方程式可以表示为: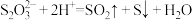
回答下列问题:
(1)仪器M的名称是
(2)由装置A制取
 ,选用质量分数为70%的浓硫酸的原因
,选用质量分数为70%的浓硫酸的原因①硫酸浓度太大,溶液中氢离子浓度太小,不利于
 的生成;
的生成;②硫酸浓度太小,溶液中水太多,
 易溶于水,损耗太大;
易溶于水,损耗太大;③硫酸浓度太大,溶液氧化性太强,
 还原性强,损耗太大;
还原性强,损耗太大;(3)该套装置设计最明显的缺陷是
a.
 b.
b.  c.
c.  d.
d. 
(4)
 还原性较强,在溶液中易被
还原性较强,在溶液中易被 氧化成
氧化成 ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为(5)工业上可用如下方法测定
 的纯度:取m g样品溶于稀硫酸,加入足量KI溶液,再加入c mol/L的
的纯度:取m g样品溶于稀硫酸,加入足量KI溶液,再加入c mol/L的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液V mL。
溶液V mL。相关反应:
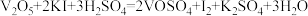 ;
;
①如果稀硫酸过多,测得结果会
②该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
4 . 短周期元素W、X、Y、Z能组成化合物 ,其中W、X、Y均为最高正价,该化合物可用于制备发动机高温涂层。已知W、X、Y位于同一周期且原子序数依次增大,X是地壳中含量最高的金属元素,Y的电子总数是最外层电子数的3倍,
,其中W、X、Y均为最高正价,该化合物可用于制备发动机高温涂层。已知W、X、Y位于同一周期且原子序数依次增大,X是地壳中含量最高的金属元素,Y的电子总数是最外层电子数的3倍,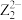 有强氧化性,W与Z的原子序数之和为20。下列说法正确的是
有强氧化性,W与Z的原子序数之和为20。下列说法正确的是
 ,其中W、X、Y均为最高正价,该化合物可用于制备发动机高温涂层。已知W、X、Y位于同一周期且原子序数依次增大,X是地壳中含量最高的金属元素,Y的电子总数是最外层电子数的3倍,
,其中W、X、Y均为最高正价,该化合物可用于制备发动机高温涂层。已知W、X、Y位于同一周期且原子序数依次增大,X是地壳中含量最高的金属元素,Y的电子总数是最外层电子数的3倍,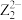 有强氧化性,W与Z的原子序数之和为20。下列说法正确的是
有强氧化性,W与Z的原子序数之和为20。下列说法正确的是A.原子半径: |
B.简单氢化物的稳定性: |
C.最高正价氧化物对应的水化物碱性: |
| D.W、X、Y的最高价氧化物均易溶于过量的稀氨水 |
您最近一年使用:0次
5 . 已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是
A.上述实验证明氧化性:MnO >Cl2>Fe3+>I2 >Cl2>Fe3+>I2 |
| B.上述实验中,共有两个氧化还原反应 |
| C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| D.实验②证明Fe2+既有氧化性又有还原性 |
您最近一年使用:0次
2021-06-22更新
|
1640次组卷
|
19卷引用:四川省南充市阆中中学2020届高三化学选择题专项训练(12)
四川省南充市阆中中学2020届高三化学选择题专项训练(12)吉林油田高级中学2019-2020学年高二下学期期末考试化学试题云南省罗平县第五中学2020-2021学年高一上学期12月月考化学试题陕西省西安市长安区第一中学2020-2021学年高一上学期第二次月考化学试题河南省新蔡县第一高级中学2020-2021学年高一上学期1月月考化学试题福建省福州市闽江口联盟校2021届高三上学期期中联考化学试题江西省赣州市信丰中学2020-2021学年高三上学期第二次月考化学试题福建省武平县第一中学2020-2021学年高一上学期第二次阶段考试(实验班)化学试题江西省九江市柴桑区第一中学2021-2022学年高三上学期第二次月考化学试题黑龙江省哈尔滨市德强高中2021-2022学年高一上学期期中考试化学试题新疆师范大学附属中学2021-2022学年高三9月月考化学试题云南省玉溪市通海县第一中学2021—2022学年高一上学期期末考试化学试题(已下线)1.3 氧化还原反应-同步学习必备知识黑龙江省黑河市第九中学2022-2023学年高三上学期摸底考试化学试题(已下线)2.2.1氯气的性质-同步学习必备知识 山东省济宁市兖州区2022-2023学年高一上学期期中考试化学试题福建省诏安县桥东中学2022-2023学年高三上学期期中考试化学试题云南省广南县第二中学校2021-2022学年高一下学期开学考试化学试题广东省云浮市罗定中学2023-2024学年高一上学期期中考试化学试题
6 . 以软锰矿(主要成分为 ,含少量
,含少量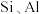 等的氧化物)为原料,某研究所设计由软锰矿制备
等的氧化物)为原料,某研究所设计由软锰矿制备 的生产流程如下:
的生产流程如下: 固体和溶液的颜色均为墨绿色。
固体和溶液的颜色均为墨绿色。
回答下列问题:
(1)“熔融、煅烧”时, 参与反应的化学方程式为
参与反应的化学方程式为___________ 。
(2)向“浸取”液中通入 调节其
调节其 ,经“过滤”得滤渣Ⅰ,滤渣Ⅰ的成分为
,经“过滤”得滤渣Ⅰ,滤渣Ⅰ的成分为_______ (填化学式)。
(3)锰元素的氧化态-吉布斯自由能图如图所示,该图具有多方面的应用。 是锰的最稳定态,则在碱性溶液中
是锰的最稳定态,则在碱性溶液中___________ (填化学式)是锰的最稳定态。
②可预测歧化反应发生的可能性。若某氧化态位于它相邻两氧化态连线的上方,则该氧化态不稳定,能发生歧化反应,生成其相邻两氧化态。反之,若某氧化态位于它相邻两氧化态连线的下方,则该氧化态是相对稳定的。由图可知, 在
在________ (填“酸性”或“碱性”)环境中更易发生歧化反应,由此可知,“歧化”时加入冰醋酸的目的是___________ (结合化学平衡移动原理解释)。“歧化”时,下列酸可以用来代替冰醋酸的是___________ (填字母)。
a.稀硫酸 b.亚硫酸 c.氢溴酸 d.乙二酸
(4)“结晶”时,当___________ (填现象)时,停止加热,待自然冷却后,过滤即可获得紫黑色 晶体。
晶体。
(5)实验室用草酸标准溶液测定产品中高锰酸钾的纯度(已知:杂质不参与反应),进行了如下操作:
步骤ⅰ.配制 的标准氢氧化钠溶液;
的标准氢氧化钠溶液;
步骤ⅱ.取草酸溶液 ,加入几滴酚酞溶液,用
,加入几滴酚酞溶液,用 的标准氢氧化钠溶液标定,消耗氢氧化钠溶液
的标准氢氧化钠溶液标定,消耗氢氧化钠溶液 ;
;
步骤ⅲ.取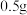 样品溶于水,滴入几滴稀硫酸酸化,用已标定的草酸溶液进行滴定,达到滴定终点消耗草酸溶液
样品溶于水,滴入几滴稀硫酸酸化,用已标定的草酸溶液进行滴定,达到滴定终点消耗草酸溶液 。
。
①样品中高锰酸钾的纯度为___________ 。
②高锰酸钾和草酸反应接近滴定终点时速率较慢,需用水浴加热。若不加热,测定出的高锰酸钾的纯度会偏___________ (填“大”或“小”)。
 ,含少量
,含少量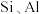 等的氧化物)为原料,某研究所设计由软锰矿制备
等的氧化物)为原料,某研究所设计由软锰矿制备 的生产流程如下:
的生产流程如下: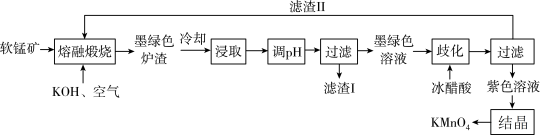
 固体和溶液的颜色均为墨绿色。
固体和溶液的颜色均为墨绿色。回答下列问题:
(1)“熔融、煅烧”时,
 参与反应的化学方程式为
参与反应的化学方程式为(2)向“浸取”液中通入
 调节其
调节其 ,经“过滤”得滤渣Ⅰ,滤渣Ⅰ的成分为
,经“过滤”得滤渣Ⅰ,滤渣Ⅰ的成分为(3)锰元素的氧化态-吉布斯自由能图如图所示,该图具有多方面的应用。
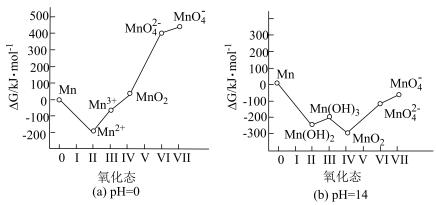
 是锰的最稳定态,则在碱性溶液中
是锰的最稳定态,则在碱性溶液中②可预测歧化反应发生的可能性。若某氧化态位于它相邻两氧化态连线的上方,则该氧化态不稳定,能发生歧化反应,生成其相邻两氧化态。反之,若某氧化态位于它相邻两氧化态连线的下方,则该氧化态是相对稳定的。由图可知,
 在
在a.稀硫酸 b.亚硫酸 c.氢溴酸 d.乙二酸
(4)“结晶”时,当
 晶体。
晶体。(5)实验室用草酸标准溶液测定产品中高锰酸钾的纯度(已知:杂质不参与反应),进行了如下操作:
步骤ⅰ.配制
 的标准氢氧化钠溶液;
的标准氢氧化钠溶液;步骤ⅱ.取草酸溶液
 ,加入几滴酚酞溶液,用
,加入几滴酚酞溶液,用 的标准氢氧化钠溶液标定,消耗氢氧化钠溶液
的标准氢氧化钠溶液标定,消耗氢氧化钠溶液 ;
;步骤ⅲ.取
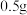 样品溶于水,滴入几滴稀硫酸酸化,用已标定的草酸溶液进行滴定,达到滴定终点消耗草酸溶液
样品溶于水,滴入几滴稀硫酸酸化,用已标定的草酸溶液进行滴定,达到滴定终点消耗草酸溶液 。
。①样品中高锰酸钾的纯度为
②高锰酸钾和草酸反应接近滴定终点时速率较慢,需用水浴加热。若不加热,测定出的高锰酸钾的纯度会偏
您最近一年使用:0次
2023-12-15更新
|
532次组卷
|
3卷引用:T27-工业流程题
11-12高一上·山西忻州·期中
7 . 在溶液中可以发生反应:X+2Y3+=2Y2++X2+,则下列叙述①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+的氧化性强。以下叙述中正确的是( )
| A.②④⑥ | B.①③④ | C.①③⑤⑥ | D.②⑤ |
您最近一年使用:0次
2020-03-06更新
|
328次组卷
|
28卷引用:四川省南充市阆中中学2020届高三化学选择题专项训练(13)
四川省南充市阆中中学2020届高三化学选择题专项训练(13)(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)(已下线)2011-2012学年山西省忻州一中高一上学期期中考试化学试卷(已下线)2011-2012学年山西省临汾一中高一上学期期中考试化学试卷(已下线)2011-2012学年云南省玉溪一中高一下学期期中考试化学试卷(已下线)2013届山西省太原五中高三10月月考理科化学试卷(已下线)2014-2015学年山东省德州市普高高二上学期期中理科化学试卷2016届福建省福州四中高三上学期10月第一次月考化学试卷2015-2016学年山西省大同一中高一上期末考试化学试卷湖南省衡阳县第一中学2018届高三上学期第二次月考化学试题吉林省长春市九台区师范高级中学2018-2019学年高一上学期期中考试化学试题陕西省城固县第一中学2018-2019学年高一上学期期末考试化学试题山西省灵丘县一中2017-2018学年高一上学期期中考试化学试卷北京市昌平区新学道临川学校2019-2020学年高一上学期期中考试化学试题江西省南昌市进贤一中2019-2020学年高一上学期期中考试化学试题步步为赢 高一化学寒假作业:作业七 阶段检测(二)黑龙江省大庆市第十中学2019-2020学年高一上学期10月月考化学试题2019年广东省汕尾市高三第一次模拟考试化学试题(已下线)【南昌新东方】2019 进贤一中 高一上 期中山东省滨州市博兴县第三中学2020-2021学年高一上学期10月月考化学试题江西省宜春市第九中学2020-2021学年高一上学期第二次月考化学试题湖南省临澧县第一中学2020-2021学年高一上学期阶段性考试(二)化学试题新疆乌鲁木齐市第二十中学2020-2021学年高一上学期段考(期中)化学试题安徽省滁州市定远县炉桥中学2020-2021学年高一上学期第一次质量检测化学试题宁夏固原市第一中学2023届高三上学期第一次月考化学试题新疆哈密市第八中学2021-2022学年高一上学期期中考试化学试题山东省利津县高级中学2022-2023学年高一12月月考化学试题北京市第十一中学2021-2022学年高一上学期期中考试化学试题
8 . 兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:

(1)SO2气体还原Fe3+的产物是______ (填离子符号),参加反应的SO2和Fe3+的物质的量之比是______ 。
(2)下列实验方案适用于在实验室制取所需SO2的是______ 。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是______ 。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有______ (填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是______ ,原因是______
(6)能表明I-还原性弱于SO2的现象是______

(1)SO2气体还原Fe3+的产物是
(2)下列实验方案适用于在实验室制取所需SO2的是
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是
(6)能表明I-还原性弱于SO2的现象是
您最近一年使用:0次
名校
9 . 下列叙述中通常不能作为判断两元素非金属性强弱的依据是( )
| A.气态氢化物稳定性强弱 | B.元素氧化性强弱 |
| C.最高价氧化物对应水化物的酸性强弱 | D.单质熔点高低 |
您最近一年使用:0次
名校
解题方法
10 . 氯化亚砜(SOCl2),是一种无色或淡黄色发烟液体,有强烈刺激性气味,其熔点-105℃,沸点79℃,140℃以上时易分解,遇水剧烈反应,常用作脱水剂。某实验小组设计实验制备氯化亚砜并探究其性质。
【资料】①实验室制备原理:在活性炭催化下,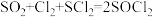
② 。
。
③SCl2是一种重要的化工试剂,遇水易分解。
实验一:制备产品并探究SOCl2的性质
根据下图所示装置设计实验(装置可以重复使用)。_______
a→___________→d、e→___________→h。
(2)实验室用亚硫酸钠固体与70%硫酸制备SO2,不用稀硫酸的原因为___________ 。
(3)A装置中发生反应的离子方程式为___________ 。
(4)SOCl2水解后无残留物,是常用的脱水剂。乙同学设计实验利用SOCl2和ZnCl2·xH2O制取无水ZnCl2。
①解释SOCl2在该实验中的作用有___________ 。
②实验室常用NaOH溶液吸收SOCl2,该反应的离子方程式是___________ 。
(5)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使产品不纯,理由是___________ 。
实验二:测定产品纯度。
利用下图装置测定产品纯度。
(6)VmL产品中含___________ mol SOCl2。(列计算式)
【资料】①实验室制备原理:在活性炭催化下,
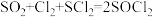
②
 。
。③SCl2是一种重要的化工试剂,遇水易分解。
实验一:制备产品并探究SOCl2的性质
根据下图所示装置设计实验(装置可以重复使用)。
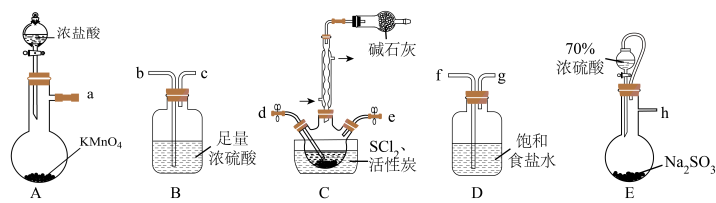
a→___________→d、e→___________→h。
(2)实验室用亚硫酸钠固体与70%硫酸制备SO2,不用稀硫酸的原因为
(3)A装置中发生反应的离子方程式为
(4)SOCl2水解后无残留物,是常用的脱水剂。乙同学设计实验利用SOCl2和ZnCl2·xH2O制取无水ZnCl2。
①解释SOCl2在该实验中的作用有
②实验室常用NaOH溶液吸收SOCl2,该反应的离子方程式是
(5)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使产品不纯,理由是
实验二:测定产品纯度。
利用下图装置测定产品纯度。

(6)VmL产品中含
您最近一年使用:0次



