名校
解题方法
1 . 某化学实验兴趣小组在实验室用酒精与氢碘酸(HI)制取少量碘乙烷,装置如图所示(部分夹持装置已略去)。
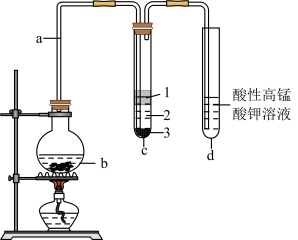
已知:①碘乙烷的密度: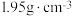 ,沸点:72℃;
,沸点:72℃;
②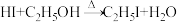 。
。
回答下列问题:
(1)导管a的作用是导气和_______ ,仪器b的名称为_______ 。
(2)仪器b中加入的反应物为NaI、酒精及浓硫酸(体积比为1∶1)。
①配制体积比为1∶1的酒精与浓硫酸时,需要用到的主要玻璃仪器有量筒、玻璃棒和_______ ,玻璃棒的作用是_______ 。
②仪器b中发生的反应为 ,该反应利用了浓硫酸的
,该反应利用了浓硫酸的_______ (填“吸水性”、“脱水性”、“难挥发性”或“强氧化性”)。
③将生成物导入盛有大量冰块的试管c中,反应结束后,试管内物质分3层,其中有机产物在第_______ (填“1”、“2”或“3”)层,水层形成的溶液主要显_______ (填“酸性”、“碱性”或“中性”)。
(3)试管d中酸性高锰酸钾溶液的作用是_______ 。
(4)实验结束后,某同学发现该实验装置存在缺陷,该缺陷是_______ ,请写出改进措施:_______ 。

已知:①碘乙烷的密度:
 ,沸点:72℃;
,沸点:72℃;②
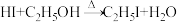 。
。回答下列问题:
(1)导管a的作用是导气和
(2)仪器b中加入的反应物为NaI、酒精及浓硫酸(体积比为1∶1)。
①配制体积比为1∶1的酒精与浓硫酸时,需要用到的主要玻璃仪器有量筒、玻璃棒和
②仪器b中发生的反应为
 ,该反应利用了浓硫酸的
,该反应利用了浓硫酸的③将生成物导入盛有大量冰块的试管c中,反应结束后,试管内物质分3层,其中有机产物在第
(3)试管d中酸性高锰酸钾溶液的作用是
(4)实验结束后,某同学发现该实验装置存在缺陷,该缺陷是
您最近一年使用:0次
名校
2 . 可闻声波诱导液体振动产生的法拉第波可以调节氧气分子在水中的溶解,从而诱导有差别的时空分布,有的区域呈氧化性,而同时有的区域呈还原性。研究人员选择了如图所示的氧化还原平衡体系。已知:声波频率提高可促进氧气的溶解。下列说法错误的是
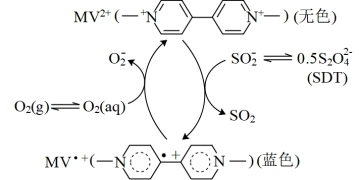

A.向体系中加入 ,转移电子为2mol ,转移电子为2mol |
B.开启可闻声波能够促进 再生 再生 |
| C.持续补充SDT才能维持蓝色 |
D.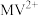 被 被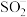 还原形成自由基阳离子 还原形成自由基阳离子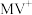 的过程伴随着颜色的改变 的过程伴随着颜色的改变 |
您最近一年使用:0次
名校
3 . 用化学方法降解水中有机物已成为污水处理领域的重要研究方向。
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。
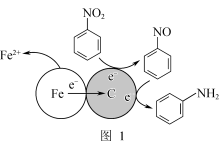
①该物质转化示意图可以描述为_______ 。
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是_______ 。

(2)向含Fe2+和苯胺( )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O,HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O,HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:_______ 。
(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是_______ 。[已知氧化性:HClO(H+)>ClO-(OH-)]
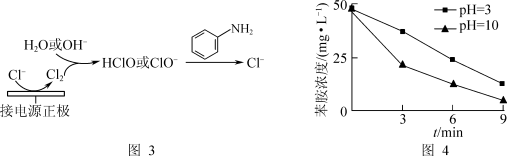
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。

①该物质转化示意图可以描述为
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是

(2)向含Fe2+和苯胺(
 )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O,HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O,HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是

您最近一年使用:0次
2022-04-18更新
|
1263次组卷
|
5卷引用:2022年湖南卷高考真题变式题(15-19)
(已下线)2022年湖南卷高考真题变式题(15-19)(已下线)第六章 化学反应与能量(测)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题四 氧化还原反应-实战高考·二轮复习核心突破江苏省扬州中学2021-2022学年高三下学期4月月考化学试题江苏省徐州市第七中学2021-2022学年高三下学期考前模拟化学试题
解题方法
4 . 某小组探究FeCl3和Na2S竟色反应。
【查阅资料】
①硫单质微溶于乙醇,难溶于水;
②FeS、Fe2S3均为黑色固体,难溶于水:
③Fe3++6F-=[FeF6]3-,[FeF6]3-为无色离子。
【设计实验】
下列推断正确的是
【查阅资料】
①硫单质微溶于乙醇,难溶于水;
②FeS、Fe2S3均为黑色固体,难溶于水:
③Fe3++6F-=[FeF6]3-,[FeF6]3-为无色离子。
【设计实验】
| 序号 | I | II | III |
| 操作 | 在1mL0.1mol·L-1Na2S溶液中加入1mL0.1mol·L-1FeCl3溶液 | 在1.5mL0.1mol·L-1 溶液中加入0.5mL0.1mol·L-1FeCl3溶液 溶液中加入0.5mL0.1mol·L-1FeCl3溶液 | 在2mLlmol·L-1NaF溶液中加入0.5mL0.1mol·L-1FeCl3溶液,得无色溶液,再加入1.5mL0.1mol·L-1Na2S溶液 |
| 现象 | 迅速产生黑色沉淀X,振荡,黑色沉淀溶解,放出臭鸡蛋气味气体,最终得到棕黄色浊液Y | 产生棕黑色沉淀Z | 产生黑色沉淀W |
| 结论 | 分离Y得到Fe(OH)3和S | 经检验,Z的主要成分是Fe2S3,含少量Fe(OH)3 | 经检验,W为Fe2S3 |
| A.黑色沉淀X溶解只发生复分解反应 |
| B.实验II不生成S可能是氧化还原速率较大 |
| C.生成黑色沉淀W的反应为2Fe3++3S2-=Fe2S3↓ |
D.反应物中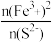 越小,氧化还原的趋势越小 越小,氧化还原的趋势越小 |
您最近一年使用:0次
名校
5 . 某小组研究 溶液与
溶液与 溶液反应,探究过程如下。
溶液反应,探究过程如下。
资料:ⅰ.MnO 在强酸性条件下被还原为
在强酸性条件下被还原为 ,在近中性条件下被还原为
,在近中性条件下被还原为 。
。
ⅱ.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
下列说法正确的是
 溶液与
溶液与 溶液反应,探究过程如下。
溶液反应,探究过程如下。| 实验序号 | Ⅰ | Ⅱ |
| 实验过程 | 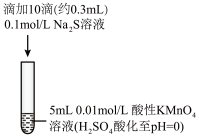 | 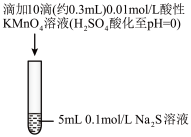 |
| 实验现象 | 紫色变浅(pH<1),生成棕褐色沉淀(MnO2) | 溶液呈淡黄色(pH=8),生成浅粉色沉淀(MnS) |
 在强酸性条件下被还原为
在强酸性条件下被还原为 ,在近中性条件下被还原为
,在近中性条件下被还原为 。
。ⅱ.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
下列说法正确的是
A.根据实验可知, 被还原 被还原 |
B.取实验Ⅰ中少量溶液进行实验,检测到有 ,得出 ,得出 被氧化成 被氧化成 |
C.实验Ⅰ中反应的离子方程式之一为: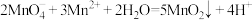 |
D.实验Ⅱ中反应结束后溶液呈淡黄色,有 生成 生成 |
您最近一年使用:0次
2022-12-12更新
|
126次组卷
|
5卷引用:2022年湖南卷高考真题变式题(11-14)
真题
名校
6 . FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检查装置的气密性;②通入干燥的Cl2,赶尽装置中的空气;③用酒精灯在铁屑下方加热至反应完成;④…… ⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为___________ 。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积得FeCl3进入收集器,第④步操作是___________ 。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)___________ 。
(4)装置B中的冷水作用为___________ ;装置C的名称为___________ ;装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:___________ 。
(5)在虚线框内画出尾气吸收装置E并注明试剂______
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为___________ 。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应为___________ 。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率100%;②___________ 。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检查装置的气密性;②通入干燥的Cl2,赶尽装置中的空气;③用酒精灯在铁屑下方加热至反应完成;④…… ⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积得FeCl3进入收集器,第④步操作是
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)
(4)装置B中的冷水作用为
(5)在虚线框内画出尾气吸收装置E并注明试剂
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为
(7)电解池中H+在阴极放电产生H2,阳极的电极反应为
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率100%;②
您最近一年使用:0次
2019-01-30更新
|
2071次组卷
|
7卷引用:2022年湖南卷高考真题变式题(15-19)
(已下线)2022年湖南卷高考真题变式题(15-19)(已下线)2014届高考化学二轮复习必做训练 元素及其化合物练习卷(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第3讲 铁及其化合物 (题型专练)2013年全国普通高等学校招生统一考试理科综合能力测试化学(天津卷)(已下线)2014届广东省揭阳一中高三上学期第二次段考理综化学试卷天津市耀华中学2022届高三下学期一模化学试题天津市耀华中学2022届高三下学期第一次校模拟考化学试题
名校
7 . 为了探究溶有 的
的 溶液的性质,某实验小组设计了如下实验:
溶液的性质,某实验小组设计了如下实验:
下列推断正确的是
 的
的 溶液的性质,某实验小组设计了如下实验:
溶液的性质,某实验小组设计了如下实验:| 装置 | 实验 | 试剂W | 部分实验现象 |
 | ① |  溶液 溶液 | 溶液中产生白色沉淀 |
| ② | 烧碱溶液 | 溶液中产生白色沉淀 | |
| ③ | 含 的淀粉溶液 的淀粉溶液 | 蓝色溶液变为无色 | |
| ④ |  溶液 溶液 | 溶液变浑浊 |
A.实验①中仅发生反应: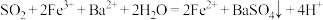 |
| B.实验②中产生的白色沉淀难溶于盐酸 |
C.由实验③可推知,还原性: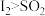 |
| D.实验④中因生成了S而使溶液变浑浊 |
您最近一年使用:0次
2022-03-22更新
|
481次组卷
|
3卷引用:2022年湖南卷高考真题变式题(11-14)
(已下线)2022年湖南卷高考真题变式题(11-14)江苏省泰州中学2021-2022学年高一下学期第一次月考检测化学试题江苏省南通市通州区金沙中学2022-2023学年高一下学期3月质量监测化学试题
真题
名校
8 . 日光灯中用到的某种荧光粉的主要成分为3W3(ZX4)2·WY2。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2:1:3。下列说法正确的是
| A.电负性:X>Y>Z>W |
| B.原子半径:X<Y<Z<W |
| C.Y和W的单质都能与水反应生成气体 |
| D.Z元素最高价氧化物对应的水化物具有强氧化性 |
您最近一年使用:0次
2023-06-16更新
|
11450次组卷
|
25卷引用:2023年湖南卷高考真题变式题(选择题6-10)
(已下线)2023年湖南卷高考真题变式题(选择题6-10)2023年高考湖南卷化学真题(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第19讲元素周期律与元素周期表(已下线)专题12 物质结构与性质(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)题型01 元素位-构-性推断-2024年高考化学答题技巧与模板构建(已下线)题型08 元素周期律推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)FHgkyldyjhx12安徽省亳州市第二完全中学2022-2023学年高二下学期期末考试化学(A卷)试题湖北省武汉市第六中学2023-2024学年高三上学期第一次月考化学试题江西省宜春市宜丰中学2023-2024学年高三上学期开学考试化学试题天津市耀华中学2023-2024学年高三上学期第一次月考化学试题福建省厦门第一中学2024届高三上学期10 月月考化学试题河北省迁安市2023-2024学年高三上学期期中考试化学试题福州市福州高级中学2023-2024学年高三上学期10月月考化学试题福建省厦门第一中学2024届高三上学期第一次月考化学试题重庆市第七中学校2023-2024学年高三上学期11月月考化学试卷北京市第二十中学2023-2024学年高三上学期10月月考化学试题福建省福州高级中学2023-2024学年高三上学期第一阶段考试化学试卷山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题
9 . 在碱性条件下,硫砷铁矿主要采取氧压浸出的方法脱砷,有关反应的离子方程式:FeAsS+OH-+O2→Fe2O3+AsO +SO
+SO +H2O(未配平),下列说法不正确的是
+H2O(未配平),下列说法不正确的是
 +SO
+SO +H2O(未配平),下列说法不正确的是
+H2O(未配平),下列说法不正确的是| A.该反应中O2是氧化剂,FeAsS被氧化 | B.参加反应的n(FeAsS):n(OH-)=1:5 |
C.SO 的空间结构为正四面体形 的空间结构为正四面体形 | D.基态As原子核外未成对电子数为5 |
您最近一年使用:0次
名校
解题方法
10 . 有研究称金粉溶于过氧化氢 浓盐酸也可以安全环保地制备氯金酸
浓盐酸也可以安全环保地制备氯金酸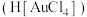 ,其化学方程式为
,其化学方程式为 ,下列有关说法错误的是
,下列有关说法错误的是
 浓盐酸也可以安全环保地制备氯金酸
浓盐酸也可以安全环保地制备氯金酸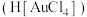 ,其化学方程式为
,其化学方程式为 ,下列有关说法错误的是
,下列有关说法错误的是A.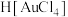 有强氧化性,其中 有强氧化性,其中 与4个氯离子形成4个σ键 与4个氯离子形成4个σ键 |
B.该反应中, 的作用是与 的作用是与 配合,使其更易被氧化 配合,使其更易被氧化 |
C.当反应中溶解  时,有 时,有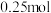 过氧化氢发生还原反应 过氧化氢发生还原反应 |
D.该反应的氧化产物和还原产物的物质的量之比为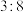 |
您最近一年使用:0次



