名校
1 . 如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题。
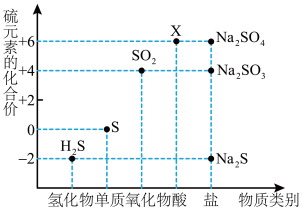
(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的_______ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有_______ (填化学式)。
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为_______ 。
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目______ 。
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
(6)设 NA为阿伏加德罗常数的值。下列说法正确的是
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
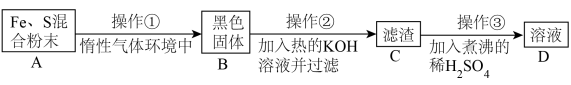
请回答以下问题:
(7)操作②的作用是_______ ,也可改用_______ 。
(8)混合粉末 A 中硫粉过量的原因是_______ 。
(9)下列溶液中通入SO2一定不会产生沉淀的是
(10)区别浓H2SO4和稀H2SO4,既简单又可靠的方法是

(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
| A.试管内壁残留的硫可用酒精洗涤 | B.SO2的水溶液长期放置,酸性会增强 |
| C.SO2有毒,不可以做食品添加剂 | D.浓硫酸在空气中敞口放置,质量会减小 |
| A.1mol 铁单质与足量的硫单质充分反应,转移电子的数目为3NA |
| B.常温下,22.4LSO2与足量的O2反应,生成的SO3分子数为NA |
| C.常温下,将5.6g铁片投入足量的浓硫酸中,铁失去的电子数为0.3NA |
| D.1 molNa2O2与足量H2O反应,转移的电子数为NA |
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:

请回答以下问题:
(7)操作②的作用是
(8)混合粉末 A 中硫粉过量的原因是
(9)下列溶液中通入SO2一定不会产生沉淀的是
| A.Ba(OH)2 | B.澄清石灰水 | C.Na2S | D.BaCl2 |
| A.各取少许溶液分别放入铜片 | B.分别与石蕊试液作用 |
| C.用玻璃棒各蘸少许液涂在纸上 | D.观察溶液的颜色 |
您最近一年使用:0次
2 . A、B、C、D均为中学化学常见物质且均含有同一种元素,它们之间的部分转化关系如图所示(反应条件及其他物质已经略去):
(1)若A为淡黄色固体单质,且D为强酸。
①则A为_______ ,写出一个证明该物质具有氧化性的化学方程式_______ 。
②写出B→C化学方程式_______ ;D的浓溶液与金属铜的反应中,还原剂与氧化剂的物质的量之比为_______ 。
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,D的稀溶液能使湿润的蓝色石蕊试纸变红。
①写出A→B的化学方程式_______ 。
②D的浓溶液需保存在棕色试剂瓶中的原因是_______ (写化学方程式)。
③B、C都是大气污染物,它们对环境造成的危害表现在_______ (填序号)。
A.引起酸雨 B.引起温室效应 C.形成光化学烟雾 D.引起水体富营养化

(1)若A为淡黄色固体单质,且D为强酸。
①则A为
②写出B→C化学方程式
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,D的稀溶液能使湿润的蓝色石蕊试纸变红。
①写出A→B的化学方程式
②D的浓溶液需保存在棕色试剂瓶中的原因是
③B、C都是大气污染物,它们对环境造成的危害表现在
A.引起酸雨 B.引起温室效应 C.形成光化学烟雾 D.引起水体富营养化
您最近一年使用:0次
3 . 为了证明铁和硫反应产物中铁的化合价是+2价还是+3价,下面是某同学设计的实验过程的一部分。(已知Fe3+与KSCN溶液反应,溶液显血红色,而Fe2+与KSCN溶液无明显现象。)
请回答下列问题:

(1)混合粉末A中硫粉过量的原因是_______ ;
(2)反应在“惰性环境中”进行的原因是_______ ;
(3)操作I是用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明了_______ ;
(4)操作II是用热氢氧化钾溶液除去多余的硫。除此法外,请再提供一种除去硫的物理方法_______ ;
(5)操作III的稀硫酸加热煮沸的目的是_______ ;
(6)为了证明产物中铁的价态,对D溶液的实验操作是_______ 。
请回答下列问题:

(1)混合粉末A中硫粉过量的原因是
(2)反应在“惰性环境中”进行的原因是
(3)操作I是用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明了
(4)操作II是用热氢氧化钾溶液除去多余的硫。除此法外,请再提供一种除去硫的物理方法
(5)操作III的稀硫酸加热煮沸的目的是
(6)为了证明产物中铁的价态,对D溶液的实验操作是
您最近一年使用:0次
名校
解题方法
4 . 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
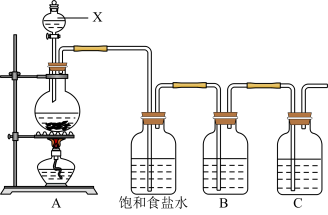
(1)请写出A装置中发生反应的离子方程式___________ 。
(2)饱和食盐水的作用是___________ 。
(3)装置B中盛放的试剂是___________ (选填下列所给试剂的编号),反应离子方程式是___________ 。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)装置C中盛放的是烧碱溶液,目的是:___________ 。
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强___________ (填编号)
①HCl比H2S稳定 ②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强 ④HCl酸性比H2S强
⑤氯原子最外层有7个电子,硫原子最外层有6个电子
⑥铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(6)此装置有多种用途,若用此装置验证氯元素的非金属性比碘元素的强,需要在B装置中加入KI溶液,通入一段时间气体后向B中加入少量CCl4,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是___________ 。

(1)请写出A装置中发生反应的离子方程式
(2)饱和食盐水的作用是
(3)装置B中盛放的试剂是
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)装置C中盛放的是烧碱溶液,目的是:
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强
①HCl比H2S稳定 ②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强 ④HCl酸性比H2S强
⑤氯原子最外层有7个电子,硫原子最外层有6个电子
⑥铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(6)此装置有多种用途,若用此装置验证氯元素的非金属性比碘元素的强,需要在B装置中加入KI溶液,通入一段时间气体后向B中加入少量CCl4,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是
您最近一年使用:0次
解题方法
5 . 已知六种短周期元素A、B、C、D、E、F的原子序数依次增大,A的原子核内没有中子,A、D同主族,C、F同主族,A和B可形成5核10电子的阳离子,C与D形成的离子化合物D2C中所有离子的电子数相同,E的最高价氧化物的水化物可与D、F的最高价氧化物的水化物反应。试回答下列问题:
(1)E在元素周期表中的位置是___________ 。
(2)写出A和B形成4核10电子分子的电子式和结构式___________ 、___________ 。
(3)C、D、F的简单离子半径由大到小的顺序为(用离子符号表示)___________ 。
(4)根据“对角线规则”,铍(Be)的性质与上述六种元素中的___________ (填名称)相似,能溶于氢氧化钠溶液,生成Na2BeO2与H2。请写出氢氧化铍与氢氧化钠溶液反应的化学方程式___________ 。
(5)A、C、D可形成多种二元化合物。下列说法不正确的是___________(填字母)。
(6)能说明氯的非金属性比F强的事实是___________(填字母)。
①F的最高价氧化物水化物比次氯酸稳定
②高氯酸的酸性比F的最高价氧化物的水化物的酸性强
③F的简单阴离子比Cl—易被氧化
④HCl比F的氢化物稳定
⑤铜与盐酸不反应,但能与F的最高价氧化物的水化物的浓溶液反应
⑥铁与氯气在加热条件下反应生成氯化铁,铁与F单质在加热条件下反应生成某化亚铁
(1)E在元素周期表中的位置是
(2)写出A和B形成4核10电子分子的电子式和结构式
(3)C、D、F的简单离子半径由大到小的顺序为(用离子符号表示)
(4)根据“对角线规则”,铍(Be)的性质与上述六种元素中的
(5)A、C、D可形成多种二元化合物。下列说法不正确的是___________(填字母)。
| A.A2C2和D2C2中都含共价键 |
| B.A、D可形成离子化合物 |
C.D2C、D2C2中阴阳离子个数比均为 |
| D.D2C和D2C2均能溶于A2C,并发生化合反应 |
①F的最高价氧化物水化物比次氯酸稳定
②高氯酸的酸性比F的最高价氧化物的水化物的酸性强
③F的简单阴离子比Cl—易被氧化
④HCl比F的氢化物稳定
⑤铜与盐酸不反应,但能与F的最高价氧化物的水化物的浓溶液反应
⑥铁与氯气在加热条件下反应生成氯化铁,铁与F单质在加热条件下反应生成某化亚铁
| A.全部 | B.②③④⑥ | C.①②④⑤⑥ | D.②③④⑤⑥ |
您最近一年使用:0次



