名校
1 . 元素周期表是化学史上重要的里程碑之一,下表是现行长式周期表的一部分。结合下表用化学用语回答问题:
(1)上表元素①~⑦中,非金属性最强的是___________ 。
(2)元素⑦为铁元素,其在周期表中的位置为___________ ,写出其单质与⑤的单质反应的化学方程式___________ 。
(3)可以用元素③的氢化物的水溶液溶蚀玻璃生产磨砂玻璃,写出反应的化学方程式___________ 。
(4)元素②④⑥简单离子半径由大到小为___________ 。
(5)元素④与元素①形成化合物X,写出X的电子式___________ ,其化学键类型为___________ ,X在野外能做生氢剂,其与水反应生氢的反应中,氧化剂为___________ 。
| ① | |||||||||||||||||
| ② | ③ | ||||||||||||||||
| ④ | ⑤ | ||||||||||||||||
| ⑥ | ⑦ | ||||||||||||||||
(2)元素⑦为铁元素,其在周期表中的位置为
(3)可以用元素③的氢化物的水溶液溶蚀玻璃生产磨砂玻璃,写出反应的化学方程式
(4)元素②④⑥简单离子半径由大到小为
(5)元素④与元素①形成化合物X,写出X的电子式
您最近半年使用:0次
名校
2 . 如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题。
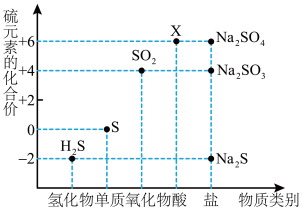
(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的_______ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有_______ (填化学式)。
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为_______ 。
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目______ 。
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
(6)设 NA为阿伏加德罗常数的值。下列说法正确的是
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
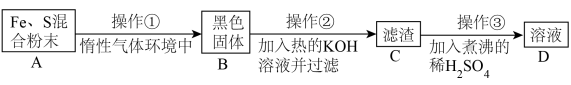
请回答以下问题:
(7)操作②的作用是_______ ,也可改用_______ 。
(8)混合粉末 A 中硫粉过量的原因是_______ 。
(9)下列溶液中通入SO2一定不会产生沉淀的是
(10)区别浓H2SO4和稀H2SO4,既简单又可靠的方法是

(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
| A.试管内壁残留的硫可用酒精洗涤 | B.SO2的水溶液长期放置,酸性会增强 |
| C.SO2有毒,不可以做食品添加剂 | D.浓硫酸在空气中敞口放置,质量会减小 |
| A.1mol 铁单质与足量的硫单质充分反应,转移电子的数目为3NA |
| B.常温下,22.4LSO2与足量的O2反应,生成的SO3分子数为NA |
| C.常温下,将5.6g铁片投入足量的浓硫酸中,铁失去的电子数为0.3NA |
| D.1 molNa2O2与足量H2O反应,转移的电子数为NA |
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:

请回答以下问题:
(7)操作②的作用是
(8)混合粉末 A 中硫粉过量的原因是
(9)下列溶液中通入SO2一定不会产生沉淀的是
| A.Ba(OH)2 | B.澄清石灰水 | C.Na2S | D.BaCl2 |
| A.各取少许溶液分别放入铜片 | B.分别与石蕊试液作用 |
| C.用玻璃棒各蘸少许液涂在纸上 | D.观察溶液的颜色 |
您最近半年使用:0次
名校
3 . 生活中我们都会发现,煮鸡蛋时间太久或放置时间过长,蛋黄上会产生一层“黑膜”,该黑膜的成分是硫化亚铁。这是由于鸡蛋里的蛋白质受热分解成小分子的氨基酸,有的氨基酸含硫元素,会形成硫化氢,而蛋黄中富含铁元素,当硫化氢遇到铁元素就形成了硫化亚铁,也就是蛋黄上覆盖的那层“黑膜”。

某同学由此联想到铁与硫单质的反应,为了验证铁与硫单质反应产物中铁元素的化合价,该同学设计了以下实验:

已知:①FeS固体难溶于水,可与稀盐酸、稀硫酸发生反应:FeS+2H+=Fe2++H2S↑。
②3S+6NaOH 2Na2S+Na2SO3+3H2O。
2Na2S+Na2SO3+3H2O。
请回答以下问题:
(1)混合粉末A中硫粉必须过量的原因是_______ 。
(2)反应在“惰性环境”中进行的原因是_______ 。
(3)操作②的作用是_______ ,也可改用_______ 。
(4)操作③稀硫酸煮沸的目的是_______ 。
(5)为检验产物中铁元素的价态,对D溶液的实验操作最好是_______ 。

某同学由此联想到铁与硫单质的反应,为了验证铁与硫单质反应产物中铁元素的化合价,该同学设计了以下实验:

已知:①FeS固体难溶于水,可与稀盐酸、稀硫酸发生反应:FeS+2H+=Fe2++H2S↑。
②3S+6NaOH
 2Na2S+Na2SO3+3H2O。
2Na2S+Na2SO3+3H2O。请回答以下问题:
(1)混合粉末A中硫粉必须过量的原因是
(2)反应在“惰性环境”中进行的原因是
(3)操作②的作用是
(4)操作③稀硫酸煮沸的目的是
(5)为检验产物中铁元素的价态,对D溶液的实验操作最好是
您最近半年使用:0次
2023-03-06更新
|
369次组卷
|
2卷引用:河南省郑州外国语学校2022-2023学年高一下学期第一次月考化学试题
4 . A、B、C、D均为中学化学常见物质且均含有同一种元素,它们之间的部分转化关系如图所示(反应条件及其他物质已经略去):
(1)若A为淡黄色固体单质,且D为强酸。
①则A为_______ ,写出一个证明该物质具有氧化性的化学方程式_______ 。
②写出B→C化学方程式_______ ;D的浓溶液与金属铜的反应中,还原剂与氧化剂的物质的量之比为_______ 。
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,D的稀溶液能使湿润的蓝色石蕊试纸变红。
①写出A→B的化学方程式_______ 。
②D的浓溶液需保存在棕色试剂瓶中的原因是_______ (写化学方程式)。
③B、C都是大气污染物,它们对环境造成的危害表现在_______ (填序号)。
A.引起酸雨 B.引起温室效应 C.形成光化学烟雾 D.引起水体富营养化

(1)若A为淡黄色固体单质,且D为强酸。
①则A为
②写出B→C化学方程式
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,D的稀溶液能使湿润的蓝色石蕊试纸变红。
①写出A→B的化学方程式
②D的浓溶液需保存在棕色试剂瓶中的原因是
③B、C都是大气污染物,它们对环境造成的危害表现在
A.引起酸雨 B.引起温室效应 C.形成光化学烟雾 D.引起水体富营养化
您最近半年使用:0次
5 . 为了证明铁和硫反应产物中铁的化合价是+2价还是+3价,下面是某同学设计的实验过程的一部分。(已知Fe3+与KSCN溶液反应,溶液显血红色,而Fe2+与KSCN溶液无明显现象。)
请回答下列问题:

(1)混合粉末A中硫粉过量的原因是_______ ;
(2)反应在“惰性环境中”进行的原因是_______ ;
(3)操作I是用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明了_______ ;
(4)操作II是用热氢氧化钾溶液除去多余的硫。除此法外,请再提供一种除去硫的物理方法_______ ;
(5)操作III的稀硫酸加热煮沸的目的是_______ ;
(6)为了证明产物中铁的价态,对D溶液的实验操作是_______ 。
请回答下列问题:

(1)混合粉末A中硫粉过量的原因是
(2)反应在“惰性环境中”进行的原因是
(3)操作I是用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明了
(4)操作II是用热氢氧化钾溶液除去多余的硫。除此法外,请再提供一种除去硫的物理方法
(5)操作III的稀硫酸加热煮沸的目的是
(6)为了证明产物中铁的价态,对D溶液的实验操作是
您最近半年使用:0次
名校
6 . 某兴趣小组对化合物 开展探究实验。
开展探究实验。
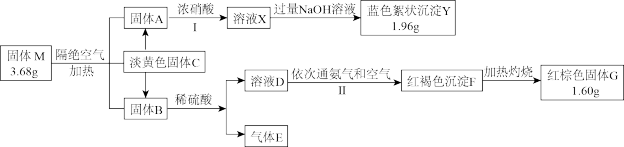
其中: 由3种元素组成;
由3种元素组成; 为单质且可通过直接化合的方式生成
为单质且可通过直接化合的方式生成 和
和 。
。
请回答:
(1)组成 的3种元素是
的3种元素是________ (填元素符号), 的化学式是
的化学式是________ 。
(2)请写出步骤Ⅱ的离子方程式______ 。
(3)请写出检验溶液 中金属阳离子的方法
中金属阳离子的方法_______ 。
(4)工业上利用带一份结晶水的 脱除工业生产尾气中的气体
脱除工业生产尾气中的气体 ,可以生成
,可以生成 和
和 ,请写出该过程的化学方程式
,请写出该过程的化学方程式________ 。
 开展探究实验。
开展探究实验。
其中:
 由3种元素组成;
由3种元素组成; 为单质且可通过直接化合的方式生成
为单质且可通过直接化合的方式生成 和
和 。
。请回答:
(1)组成
 的3种元素是
的3种元素是 的化学式是
的化学式是(2)请写出步骤Ⅱ的离子方程式
(3)请写出检验溶液
 中金属阳离子的方法
中金属阳离子的方法(4)工业上利用带一份结晶水的
 脱除工业生产尾气中的气体
脱除工业生产尾气中的气体 ,可以生成
,可以生成 和
和 ,请写出该过程的化学方程式
,请写出该过程的化学方程式
您最近半年使用:0次
2022-08-16更新
|
219次组卷
|
2卷引用:浙江省浦江中学、长兴中学、余杭高中2021-2022学年高一下学期三校联考(3月)化学试题
解题方法
7 . 已知六种短周期元素A、B、C、D、E、F的原子序数依次增大,A的原子核内没有中子,A、D同主族,C、F同主族,A和B可形成5核10电子的阳离子,C与D形成的离子化合物D2C中所有离子的电子数相同,E的最高价氧化物的水化物可与D、F的最高价氧化物的水化物反应。试回答下列问题:
(1)E在元素周期表中的位置是___________ 。
(2)写出A和B形成4核10电子分子的电子式和结构式___________ 、___________ 。
(3)C、D、F的简单离子半径由大到小的顺序为(用离子符号表示)___________ 。
(4)根据“对角线规则”,铍(Be)的性质与上述六种元素中的___________ (填名称)相似,能溶于氢氧化钠溶液,生成Na2BeO2与H2。请写出氢氧化铍与氢氧化钠溶液反应的化学方程式___________ 。
(5)A、C、D可形成多种二元化合物。下列说法不正确的是___________(填字母)。
(6)能说明氯的非金属性比F强的事实是___________(填字母)。
①F的最高价氧化物水化物比次氯酸稳定
②高氯酸的酸性比F的最高价氧化物的水化物的酸性强
③F的简单阴离子比Cl—易被氧化
④HCl比F的氢化物稳定
⑤铜与盐酸不反应,但能与F的最高价氧化物的水化物的浓溶液反应
⑥铁与氯气在加热条件下反应生成氯化铁,铁与F单质在加热条件下反应生成某化亚铁
(1)E在元素周期表中的位置是
(2)写出A和B形成4核10电子分子的电子式和结构式
(3)C、D、F的简单离子半径由大到小的顺序为(用离子符号表示)
(4)根据“对角线规则”,铍(Be)的性质与上述六种元素中的
(5)A、C、D可形成多种二元化合物。下列说法不正确的是___________(填字母)。
| A.A2C2和D2C2中都含共价键 |
| B.A、D可形成离子化合物 |
C.D2C、D2C2中阴阳离子个数比均为 |
| D.D2C和D2C2均能溶于A2C,并发生化合反应 |
①F的最高价氧化物水化物比次氯酸稳定
②高氯酸的酸性比F的最高价氧化物的水化物的酸性强
③F的简单阴离子比Cl—易被氧化
④HCl比F的氢化物稳定
⑤铜与盐酸不反应,但能与F的最高价氧化物的水化物的浓溶液反应
⑥铁与氯气在加热条件下反应生成氯化铁,铁与F单质在加热条件下反应生成某化亚铁
| A.全部 | B.②③④⑥ | C.①②④⑤⑥ | D.②③④⑤⑥ |
您最近半年使用:0次
8 . 某实验小组学习了反应 的相关知识后,欲探究镁是否与
的相关知识后,欲探究镁是否与 气体反应,设计了下列实验装置图(注:石棉绒是一种耐火材料,不参与反应)。
气体反应,设计了下列实验装置图(注:石棉绒是一种耐火材料,不参与反应)。
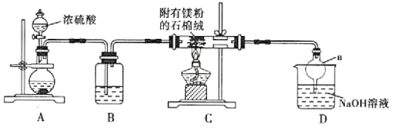
请回答下列问题:
(1)若可供选择的固体试剂有:木炭、铜片、亚硫酸钠固体。则装置A中发生反应的化学方程式为___________ 。
(2)装置B中所盛放的药品是___________ 。
(3)仪器a的名称是___________ ,其作用是___________ 。
(4)实验完毕后观察到石棉绒上有黄色物质生成,将石棉绒及其附着物投入到稀盐酸中,会产生具有臭鸡蛋气味的气态氢化物,则镁与 除了发生反应
除了发生反应 外,还发生的反应是
外,还发生的反应是___________ 。
(5)在装置C、D间插入下图所示装置,可以获得亚硫酸(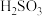 )溶液。
)溶液。
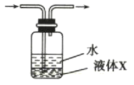
①液体X可以是下列试剂中的___________ (填序号)。
A.苯 B.汽油 C.四氯化碳 D.酒精
②向亚硫酸溶液中通入空气,溶液的pH___________ (填“增大”“减小”或“不变”),其原因是___________ (用化学方程式表示)。
 的相关知识后,欲探究镁是否与
的相关知识后,欲探究镁是否与 气体反应,设计了下列实验装置图(注:石棉绒是一种耐火材料,不参与反应)。
气体反应,设计了下列实验装置图(注:石棉绒是一种耐火材料,不参与反应)。
请回答下列问题:
(1)若可供选择的固体试剂有:木炭、铜片、亚硫酸钠固体。则装置A中发生反应的化学方程式为
(2)装置B中所盛放的药品是
(3)仪器a的名称是
(4)实验完毕后观察到石棉绒上有黄色物质生成,将石棉绒及其附着物投入到稀盐酸中,会产生具有臭鸡蛋气味的气态氢化物,则镁与
 除了发生反应
除了发生反应 外,还发生的反应是
外,还发生的反应是(5)在装置C、D间插入下图所示装置,可以获得亚硫酸(
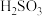 )溶液。
)溶液。
①液体X可以是下列试剂中的
A.苯 B.汽油 C.四氯化碳 D.酒精
②向亚硫酸溶液中通入空气,溶液的pH
您最近半年使用:0次
2021高三·全国·专题练习
9 . 以黄铁矿(主要成分FeS2)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如图所示。
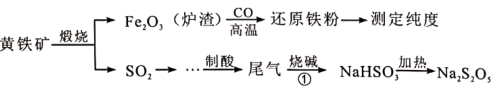
回答下列问题:
(1)黄铁矿中硫元素的化合价为_______  。
。
(2)由炉渣制备还原铁粉的化学方程式为_______ 。
(3)欲得到更纯的NaHSO3,反应①应通入_______ (填 “过量”或“不足量”)的SO2气体。
(4)因为Na2S2O5具有_______ 性, 导致商品Na2S2O5中不可避免地存在Na2SO4。检验其中含有 的方法是
的方法是_______ 。

回答下列问题:
(1)黄铁矿中硫元素的化合价为
 。
。(2)由炉渣制备还原铁粉的化学方程式为
(3)欲得到更纯的NaHSO3,反应①应通入
(4)因为Na2S2O5具有
 的方法是
的方法是
您最近半年使用:0次
名校
解题方法
10 . 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
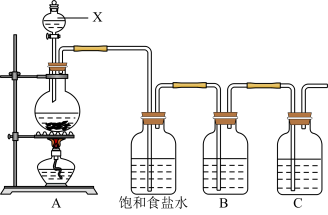
(1)请写出A装置中发生反应的离子方程式___________ 。
(2)饱和食盐水的作用是___________ 。
(3)装置B中盛放的试剂是___________ (选填下列所给试剂的编号),反应离子方程式是___________ 。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)装置C中盛放的是烧碱溶液,目的是:___________ 。
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强___________ (填编号)
①HCl比H2S稳定 ②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强 ④HCl酸性比H2S强
⑤氯原子最外层有7个电子,硫原子最外层有6个电子
⑥铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(6)此装置有多种用途,若用此装置验证氯元素的非金属性比碘元素的强,需要在B装置中加入KI溶液,通入一段时间气体后向B中加入少量CCl4,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是___________ 。

(1)请写出A装置中发生反应的离子方程式
(2)饱和食盐水的作用是
(3)装置B中盛放的试剂是
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)装置C中盛放的是烧碱溶液,目的是:
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强
①HCl比H2S稳定 ②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强 ④HCl酸性比H2S强
⑤氯原子最外层有7个电子,硫原子最外层有6个电子
⑥铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(6)此装置有多种用途,若用此装置验证氯元素的非金属性比碘元素的强,需要在B装置中加入KI溶液,通入一段时间气体后向B中加入少量CCl4,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是
您最近半年使用:0次



