1 . 某实验小组在探究SO2性质的时候,发现若将SO2气体通入足量的Ba(OH)2溶液中,有白色沉淀生成,再滴入稀硝酸,沉淀无明显变化,但有无色气体生成,遇空气无色气体变为红棕色。
回答下列问题:
(1)写出上述实验中通入SO2生成白色沉淀的离子方程式:___________ 。请用离子方程式表示加入稀硝酸后生成无色气体的原因:___________ 。
(2)若将SO2气体通入足量的BaCl2溶液中,则无明显现象产生。
①同时向BaCl2溶液中通入NH3和SO2有白色沉淀产生,产生沉淀的化学式___________ 。
②同时向BaCl2溶液中通入SO2和Cl2有白色沉淀产生,产生沉淀的化学式___________ 。
③同时向BaCl2溶液中通入SO2和NO2是否有白色沉淀生成,请判断并说明原因___________ 。
(3)若将SO2通入H2S溶液中,有淡黄色沉淀生成,请写出反应的化学方程式:___________ ,该反应中体现了SO2的___________ (填"还原性"或"氧化性")。
回答下列问题:
(1)写出上述实验中通入SO2生成白色沉淀的离子方程式:
(2)若将SO2气体通入足量的BaCl2溶液中,则无明显现象产生。
①同时向BaCl2溶液中通入NH3和SO2有白色沉淀产生,产生沉淀的化学式
②同时向BaCl2溶液中通入SO2和Cl2有白色沉淀产生,产生沉淀的化学式
③同时向BaCl2溶液中通入SO2和NO2是否有白色沉淀生成,请判断并说明原因
(3)若将SO2通入H2S溶液中,有淡黄色沉淀生成,请写出反应的化学方程式:
您最近一年使用:0次
名校
解题方法
2 . 将SO2分别通入下列五种溶液中:

回答下列问题:
(1)试管①中的实验现象:KMnO4溶液____ ,证明SO2具有___ 性。
(2)试管②中的实验现象:溶液____ ,证明SO2具有____ 性。
(3)试管③中的实验现象:溶液____ ,证明SO2能中和NaOH,写出该反应的离子方程式:____ 。
(4)试管④中能产生____ 沉淀,该沉淀是____ 。
(5)试管⑤中能产生白色沉淀,该沉淀是____ 。

回答下列问题:
(1)试管①中的实验现象:KMnO4溶液
(2)试管②中的实验现象:溶液
(3)试管③中的实验现象:溶液
(4)试管④中能产生
(5)试管⑤中能产生白色沉淀,该沉淀是
您最近一年使用:0次
2022-03-02更新
|
731次组卷
|
3卷引用:课前-5.1.1 硫和二氧化硫-人教2019必修第二册
2022高三·全国·专题练习
解题方法
3 . 按用量要求书写下列离子方程式:
(1)可溶性多元弱酸(或其酸酐)与碱溶液反应。如SO2通入NaOH溶液中:
碱过量:___________ ;
碱不足:___________ 。
(2)多元弱酸盐与强酸反应。如Na2CO3溶液与稀盐酸:
盐酸不足:___________ ;
盐酸过量:___________ 。
(1)可溶性多元弱酸(或其酸酐)与碱溶液反应。如SO2通入NaOH溶液中:
碱过量:
碱不足:
(2)多元弱酸盐与强酸反应。如Na2CO3溶液与稀盐酸:
盐酸不足:
盐酸过量:
您最近一年使用:0次
21-22高一·全国·课时练习
名校
解题方法
4 . 将SO2分别通入下列五种溶液中

回答下列问题:
(1)试管①中的实验现象:KMnO4酸性溶液________ ,证明SO2具有________ 性。
(2)试管②中的实验现象:溶液________ ,证明SO2具有________ 性。
(3)试管③中的实验现象:溶液________ ,证明SO2能中和NaOH,具有酸性氧化物的性质,写出该反应的离子方程式:____________________________________________________ 。
(4)试管④中能产生________ 沉淀。
(5)试管⑤中能产生________ 沉淀。

回答下列问题:
(1)试管①中的实验现象:KMnO4酸性溶液
(2)试管②中的实验现象:溶液
(3)试管③中的实验现象:溶液
(4)试管④中能产生
(5)试管⑤中能产生
您最近一年使用:0次
名校
解题方法
5 . 价-类二维图是梳理元素及其化合物性质的重要工具,以下是S及其常见化合物的价-类二维图,图示中横坐标表示物质类别,纵坐标表示其中硫元素的化合价
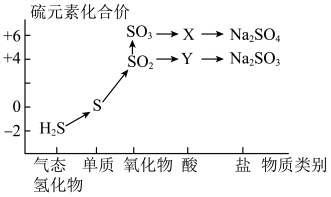
根据图示回答下列问题:
(1)Y的化学式为___________ 。
(2)根据“价-类”二维图预测,下列能与 反应且
反应且 表现还原性的物质是
表现还原性的物质是___________ (填序号)
a. b.酸性
b.酸性 溶液 c.
溶液 c. 溶液 d.
溶液 d.
(3)分析 的物质类别,写出它和过量
的物质类别,写出它和过量 溶液反应的离子方程式
溶液反应的离子方程式___________ 。
(4)欲制备 ,从氧化还原角度分析,合理的是
,从氧化还原角度分析,合理的是___________ (填序号)。
a. b.
b. c.
c. d.
d.

根据图示回答下列问题:
(1)Y的化学式为
(2)根据“价-类”二维图预测,下列能与
 反应且
反应且 表现还原性的物质是
表现还原性的物质是a.
 b.酸性
b.酸性 溶液 c.
溶液 c. 溶液 d.
溶液 d.
(3)分析
 的物质类别,写出它和过量
的物质类别,写出它和过量 溶液反应的离子方程式
溶液反应的离子方程式(4)欲制备
 ,从氧化还原角度分析,合理的是
,从氧化还原角度分析,合理的是a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
6 . 某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O)
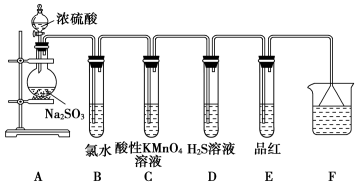
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是_______ 。
(2)反应后,装置B中发生反应的离子方程式为_______ ,装置C中的现象是_______ ,表现了SO2的_______ ;装置D中现象是_______ ,发生反应的化学方程式为_______ 。
(3)F装置的作用是_______ ,漏斗的作用是_______ 。

请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是
(2)反应后,装置B中发生反应的离子方程式为
(3)F装置的作用是
您最近一年使用:0次
7 . 二氧化硫的化学性质
从氧化物、化合价的角度推测SO2的可能具有的性质_______
(1)酸性氧化物的通性
根据酸性氧化物的性质,试写出以下化学反应方程式:
①酸性氧化物 + 碱 → 盐 + 水 SO2+ Ca(OH)2(少量)=_______ (注意:SO2也可以使澄清石灰水变浑浊)
②酸性氧化物+碱性氧化物→盐 SO2 +CaO =_______
③酸性氧化物 + 水 → 酸 SO2 +H2O⇌_______
【实验5-1】二氧化硫与水的反应
从氧化物、化合价的角度推测SO2的可能具有的性质
(1)酸性氧化物的通性
根据酸性氧化物的性质,试写出以下化学反应方程式:
①酸性氧化物 + 碱 → 盐 + 水 SO2+ Ca(OH)2(少量)=
②酸性氧化物+碱性氧化物→盐 SO2 +CaO =
③酸性氧化物 + 水 → 酸 SO2 +H2O⇌
【实验5-1】二氧化硫与水的反应
| 实验操作 | 现象 | 结论 |
| ①把盛有SO2的试管倒立于水中,打开胶塞 | 试管内液面 | SO2 |
| ②用pH试纸测定溶液的酸碱度 | 试纸变 | 二氧化硫水溶液呈 |
您最近一年使用:0次
8 . 分类法在化学学习中应用广泛。
(1)为了保护环境,应减少SO2在大气中的排放。SO2属于酸性氧化物,可与NaOH、___ (填与NaOH不同类别的一种具体物质)等反应。写出SO2与NaOH反应的化学方程式___ 。
(2)氯化铁(FeCl3)可用于金属蚀刻、污水处理等,是重要的化工原料。写出两个生成FeCl3的化学方程式(以含铁元素的不同类别物质 为原料)。
①___ 。
②___ 。
(1)为了保护环境,应减少SO2在大气中的排放。SO2属于酸性氧化物,可与NaOH、
(2)氯化铁(FeCl3)可用于金属蚀刻、污水处理等,是重要的化工原料。写出两个生成FeCl3的化学方程式(以含铁元素的
①
②
您最近一年使用:0次
解题方法
9 . SO2在生产、生活中具有重要的作用,据所学知识回答相关问题。
(1) SO2通入Na2CO3溶液中有CO2生成,说明H2SO3具有___________ (填“酸性”、“氧化性”、“还原性”或“漂白性”,下同),SO2通入品红溶液中,品红溶液褪色,说明SO2具有___________ 。
(2)已知SO2通入FeCl3溶液会发生反应,还原产物为___________ (填化学式,下同),氧化产物为___________ 。
(3)向含锌粉的悬浊液中通入SO2可制备ZnS2O4。
①该反应的化学方程式为___________ ,若反应中有0.1mol电子转移,则生成ZnS2O4___________ g。
②向反应后的溶液中加入过量盐酸,溶液出现黄色浑浊,且有刺激性气体产生,反应的化学方程式为___________ 。
(4)已知室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水。ZnO水悬浊液常用于吸收烟气中的SO2。向ZnO水悬浊液中缓慢匀速通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH的变化如图。0~20min内,溶液pH几乎不变的原因是___________ ,SO2吸收率在30min后迅速降低,其原因是___________ 。

(1) SO2通入Na2CO3溶液中有CO2生成,说明H2SO3具有
(2)已知SO2通入FeCl3溶液会发生反应,还原产物为
(3)向含锌粉的悬浊液中通入SO2可制备ZnS2O4。
①该反应的化学方程式为
②向反应后的溶液中加入过量盐酸,溶液出现黄色浑浊,且有刺激性气体产生,反应的化学方程式为
(4)已知室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水。ZnO水悬浊液常用于吸收烟气中的SO2。向ZnO水悬浊液中缓慢匀速通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH的变化如图。0~20min内,溶液pH几乎不变的原因是

您最近一年使用:0次
2021-01-21更新
|
575次组卷
|
4卷引用:陕西省安康市2021届高三第一次教学质量联考化学试题
陕西省安康市2021届高三第一次教学质量联考化学试题(已下线)第06讲 氧化还原反应(精练)-2022年高考化学一轮复习讲练测(已下线)第06讲 氧化还原反应(练)-2023年高考化学一轮复习讲练测(全国通用)新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年高三上学期第二次月考化学试题
解题方法
10 . 二氧化硫的化学性质
(1)SO2具有酸性氧化物的通性
①写出下列反应的化学方程式:
a.和水反应:____ 。
b.和澄清石灰水反应:___ 。
c.和CaO反应:____ 。
②可逆反应:在____ 条件下,既能向____ 方向进行,____ 又能向____ 方向进行的反应。在可逆反应的化学方程式中用“ ”代替“=”。
”代替“=”。
(2)从元素化合价变化角度分析SO2性质
①强还原性
与氯水反应:____ 。
与O2反应:____ 。
②弱氧化性
与H2S反应:____ 。
(3)SO2的特性——漂白性
它能与某些有色物质(如品红溶液)生成不稳定的无色物质。这些无色物质容易分解而使有色物质恢复原来的颜色。
(1)SO2具有酸性氧化物的通性
①写出下列反应的化学方程式:
a.和水反应:
b.和澄清石灰水反应:
c.和CaO反应:
②可逆反应:在
 ”代替“=”。
”代替“=”。(2)从元素化合价变化角度分析SO2性质
①强还原性
与氯水反应:
与O2反应:
②弱氧化性
与H2S反应:
(3)SO2的特性——漂白性
它能与某些有色物质(如品红溶液)生成不稳定的无色物质。这些无色物质容易分解而使有色物质恢复原来的颜色。
您最近一年使用:0次



