真题
1 . 学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:
(1)铜与浓硝酸反应的装置如下图,仪器A的名称为_______ ,装置B的作用为_______ 。 反应的探究如下:
反应的探究如下:_______ ;产生的气体为_______ 。比较实验①和②,从氧化还原角度说明 的作用是
的作用是_______ 。
(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,mgX完全分解为ng黑色氧化物Y,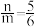 。X的化学式为
。X的化学式为_______ 。
(4)取含X粗品0.0500g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液15.00mL。(已知:
标准溶液15.00mL。(已知: ,
, )标志滴定终点的现象是
)标志滴定终点的现象是_______ ,粗品中X的相对含量为_______ 。
(1)铜与浓硝酸反应的装置如下图,仪器A的名称为

 反应的探究如下:
反应的探究如下:
 的作用是
的作用是(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,mgX完全分解为ng黑色氧化物Y,
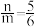 。X的化学式为
。X的化学式为(4)取含X粗品0.0500g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用
 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液15.00mL。(已知:
标准溶液15.00mL。(已知: ,
, )标志滴定终点的现象是
)标志滴定终点的现象是
您最近一年使用:0次
2023-06-14更新
|
7267次组卷
|
14卷引用:专题19 实验综合题
(已下线)专题19 实验综合题(已下线)考点08 物质的量在化学方程式计算中的应用(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)第13讲氮及其化合物(已下线)考点16 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点46 定量分析实验(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)四川省眉山市仁寿第一中学校(北校区)2023-2024学年高三上学期11月期中考试理综化学试题(已下线)题型二 实验中常考滴定计算-备战2024年高考化学答题技巧与模板构建(已下线)第03讲 物质的量在化学方程式计算中的应用(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)2023年高考湖北卷化学真题(已下线)T18-实验题
真题
2 . 回答下列问题:
(1)两种有机物的相关数据如表:
HCON(CH3)2的相对分子质量比HCONH2的大,但其沸点反而比HCONH2的低,主要原因是______ 。
(2)四种晶体的熔点数据如表:
CF4和SiF4熔点相差较小,BF3和AlF3熔点相差较大,原因是______ 。
(1)两种有机物的相关数据如表:
| 物质 | HCON(CH3)2 | HCONH2 |
| 相对分子质量 | 73 | 45 |
| 沸点/℃ | 153 | 220 |
(2)四种晶体的熔点数据如表:
| 物质 | CF4 | SiF4 | BF3 | AlF3 |
| 熔点/℃ | -183 | -90 | -127 | >1000 |
您最近一年使用:0次
2022-01-12更新
|
4614次组卷
|
5卷引用:2022年浙江1月高考真题变式题(26-31)
(已下线)2022年浙江1月高考真题变式题(26-31)(已下线)考点08 微粒间相互作用力-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间相互作用力(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)2022 年1月浙江省普通高校招生选考科目考试化学试题海南省五指山中学2021-2022学年高二下学期期中考试化学试题
真题
解题方法
3 . 回答下列问题:
(1)乙醇的挥发性比水的强,原因是_______ 。
(2)金属氢化物是应用广泛的还原剂。KH的还原性比NaH的强,原因是_______ 。
(1)乙醇的挥发性比水的强,原因是
(2)金属氢化物是应用广泛的还原剂。KH的还原性比NaH的强,原因是
您最近一年使用:0次
名校
4 . 高铁酸盐是一种新型、高效、多功能绿色水处理剂,工业上可用湿法制备高铁酸钾。
2Fe(OH)3+3ClO-+4OH-=2FeO +3Cl-+5H2O
+3Cl-+5H2O
(1)FeO 中铁元素化合价为
中铁元素化合价为____ ,在该反应中氧化剂是____ ,还原剂是____ ,氧化产物是____ 。
(2)请用双线桥表示反应中电子转移情况:____ 。
(3)根据化合价,推测FeO 能和下列
能和下列____ 反应(填序号)。
2Fe(OH)3+3ClO-+4OH-=2FeO
 +3Cl-+5H2O
+3Cl-+5H2O(1)FeO
 中铁元素化合价为
中铁元素化合价为(2)请用双线桥表示反应中电子转移情况:
(3)根据化合价,推测FeO
 能和下列
能和下列| A.KMnO4 | B.SO2 | C.H2S | D.O2 |
您最近一年使用:0次
2022-04-14更新
|
3134次组卷
|
5卷引用:四川省自贡市2021-2022学年高一上学期期末考试化学试题
四川省自贡市2021-2022学年高一上学期期末考试化学试题(已下线)1.3.1 氧化还原反应的基本概念(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)(已下线)第一章《物质及其变化》基础过关单元检测-【帮课堂】2022-2023学年高一化学必修第一册精品讲义(人教版2019)(已下线)1.3.1 氧化还原反应概念与电子转移-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)河北省石家庄市第十五中学2023-2024学年高一上学期第一次月考化学试题
真题
5 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)基态Na原子的价层电子轨道表示式为___________ 。
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na,电解反应方程式: ,加入
,加入 的目的是
的目的是___________ 。
(3) 的电子式为
的电子式为___________ 。在25℃和101kPa时,Na与 反应生成1mol
反应生成1mol  放热510.9kJ,写出该反应的热化学方程式:
放热510.9kJ,写出该反应的热化学方程式:___________ 。
(4)采用空气和Na为原料可直接制备 。空气与熔融金属Na反应前需依次通过
。空气与熔融金属Na反应前需依次通过___________ 、___________ (填序号)
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d. 溶液
溶液
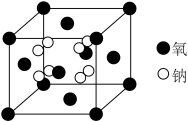
(5)钠的某氧化物晶胞如下图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为___________ 。
(6)天然碱的主要成分为 ,1mol
,1mol  经充分加热得到
经充分加热得到 的质量为
的质量为___________ g。
(1)基态Na原子的价层电子轨道表示式为
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na,电解反应方程式:
 ,加入
,加入 的目的是
的目的是(3)
 的电子式为
的电子式为 反应生成1mol
反应生成1mol  放热510.9kJ,写出该反应的热化学方程式:
放热510.9kJ,写出该反应的热化学方程式:(4)采用空气和Na为原料可直接制备
 。空气与熔融金属Na反应前需依次通过
。空气与熔融金属Na反应前需依次通过a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.
 溶液
溶液(5)钠的某氧化物晶胞如下图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为

(6)天然碱的主要成分为
 ,1mol
,1mol  经充分加热得到
经充分加热得到 的质量为
的质量为
您最近一年使用:0次
2023-03-16更新
|
4115次组卷
|
5卷引用:2022年天津市普通高中学业水平等级性考试化学试题
2022年天津市普通高中学业水平等级性考试化学试题2022年天津高考化学真题(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(结构与性质)(已下线)第4讲 钠及其重要化合物(已下线)考点09 钠及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
6 . 随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
I.以CO2和NH3为原料合成尿素2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。
CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。
(1)有利于提高CO2平衡转化率的措施是_______(填序号)。
(2)研究发现,合成尿素反应分两步完成,其能量变化如下图甲所示:
第一步: 2NH3(g)+CO2(g) NH2COONH4(s) ∆H1
NH2COONH4(s) ∆H1
第二步:NH2COONH4(s) CO(NH2)2(s)+H2O(g) ∆H2
CO(NH2)2(s)+H2O(g) ∆H2
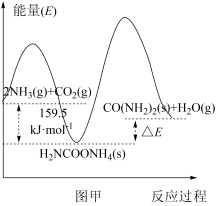
①图中ΔE=_______ kJ/mol。
②反应速率较快的是_______ 反应(填“第一步”或“第二步”),理由是_______ 。
II.以CO2和CH4催化重整制备合成气: CO2(g)+CH4(g) 2CO(g)+ 2H2(g)。
(3)在密闭容器中通入物质的量均为0.2 mol的CH4和CO2,在一定条件下发生反应CH4(g) +CO2 (g) 2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
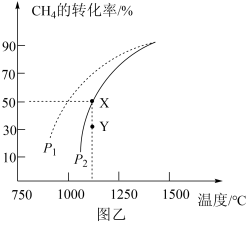
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是_______ (填序号)。
A容器中混合气体的密度保持不变 B. 容器内混合气体的压强保持不变
C.反应速率: 2v正(CO2)=v正 (H2) D.同时断裂2molC- H键和1 molH-H键
②由图乙可知,压强P1_______ P2 (填“>”“<”或“=”,下同); Y点速率v正_______ v逆。
③已知气体分压=气体总压x气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=_______ (用含P2的代数式表示)。
III. 电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:
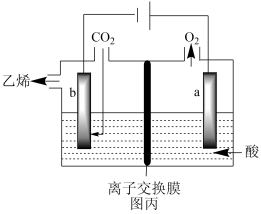
(4)阴极电极反应式为_______ ,该装置中使用的是_______ (填“阴”或“阳”)离子交换膜。
I.以CO2和NH3为原料合成尿素2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。
CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。(1)有利于提高CO2平衡转化率的措施是_______(填序号)。
| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
第一步: 2NH3(g)+CO2(g)
 NH2COONH4(s) ∆H1
NH2COONH4(s) ∆H1第二步:NH2COONH4(s)
 CO(NH2)2(s)+H2O(g) ∆H2
CO(NH2)2(s)+H2O(g) ∆H2
①图中ΔE=
②反应速率较快的是
II.以CO2和CH4催化重整制备合成气: CO2(g)+CH4(g) 2CO(g)+ 2H2(g)。
(3)在密闭容器中通入物质的量均为0.2 mol的CH4和CO2,在一定条件下发生反应CH4(g) +CO2 (g)
 2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是
A容器中混合气体的密度保持不变 B. 容器内混合气体的压强保持不变
C.反应速率: 2v正(CO2)=v正 (H2) D.同时断裂2molC- H键和1 molH-H键
②由图乙可知,压强P1
③已知气体分压=气体总压x气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=
III. 电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:

(4)阴极电极反应式为
您最近一年使用:0次
2022-05-12更新
|
3102次组卷
|
3卷引用:四川省南充市2022届高三适应性考试(三诊)理综化学试题
解题方法
7 . 写出下列反应的离子方程式。
(1)氢氧化钠溶液与硝酸溶液反应:___________ ;
(2)氯化钠溶液与硝酸银溶液反应:___________ ;
(3)氢氧化钡溶液和硫酸铜溶液反应:___________ ;
(4)铜与硝酸银溶液反应:___________ ;
(5)碳酸钠溶液与氢氧化钙溶液反应:___________ ;
(6)碳酸钙与稀硝酸反应:___________ 。
(1)氢氧化钠溶液与硝酸溶液反应:
(2)氯化钠溶液与硝酸银溶液反应:
(3)氢氧化钡溶液和硫酸铜溶液反应:
(4)铜与硝酸银溶液反应:
(5)碳酸钠溶液与氢氧化钙溶液反应:
(6)碳酸钙与稀硝酸反应:
您最近一年使用:0次
21-22高一下·上海浦东新·阶段练习
8 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
___________ ___________KI+___________=___________NO↑+___________
___________KI+___________=___________NO↑+___________ ___________
___________ ___________
___________ ___________
___________
(1)请完成该化学方程式并配平。___________
(2)从物质分类角度来看, 是
是___________ (填字母代号)。
a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质 f.离子化合物 g.共价化合物
(3)用上述反应来处理 并不是最佳方法,其原因是
并不是最佳方法,其原因是___________ 。从环保角度来讲,要将 转化为氮气,所用物质的
转化为氮气,所用物质的___________ (填“氧化性”或“还原性”)应该比KI更___________ (填“强”或“弱”)。
(4)下列方法不能用来区分固体 和NaCl的是___________(填序号)。
和NaCl的是___________(填序号)。
(5)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。
(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:___________ 。
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:___________
 ___________KI+___________=___________NO↑+___________
___________KI+___________=___________NO↑+___________ ___________
___________ ___________
___________ ___________
___________
(1)请完成该化学方程式并配平。
(2)从物质分类角度来看,
 是
是a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质 f.离子化合物 g.共价化合物
(3)用上述反应来处理
 并不是最佳方法,其原因是
并不是最佳方法,其原因是 转化为氮气,所用物质的
转化为氮气,所用物质的(4)下列方法不能用来区分固体
 和NaCl的是___________(填序号)。
和NaCl的是___________(填序号)。| A.分别溶于水 |
B.分别溶于水并滴加 酸化的 酸化的 溶液 溶液 |
| C.分别加强热并收集气体检验 |
| D.用筷子分别蘸取固体品尝味道 |
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。A. |
B. |
C. |
D. |
您最近一年使用:0次
名校
9 . 按要求回答下列问题:
(1)乙烷的结构式为____ 。
(2)丙烷的结构简式为_____ 。
(3)分子中含有30个氢原子的饱和链状烷烃的分子式为____ 。
(4)相对分子质量为58的饱和链状烷烃的结构有____ 种,分别写出它们的结构简式:_____ 。
(5)分子式为C5H12的直链烷烃的习惯命名为____ ,其一氯代物只有一种的同分异构体的结构简式为___ 。
(1)乙烷的结构式为
(2)丙烷的结构简式为
(3)分子中含有30个氢原子的饱和链状烷烃的分子式为
(4)相对分子质量为58的饱和链状烷烃的结构有
(5)分子式为C5H12的直链烷烃的习惯命名为
您最近一年使用:0次
2022-03-29更新
|
2555次组卷
|
3卷引用:课后-7.1.1 碳原子的成键特点 烷烃的结构-人教2019必修第二册
课后-7.1.1 碳原子的成键特点 烷烃的结构-人教2019必修第二册山东省临沂第一中学2021-2022学年高一下学期第二次教学检测(4月线上)化学试题(已下线)7.1.1 有机化合物中碳原子的成键特点 烷烃的结构-2021-2022学年高一化学课后培优练(人教版2019必修第二册)
名校
10 . 已知二氧化碳、二氧化硫等都只能与碱反应生成相应的盐和水,这些氧化物为酸性氧化物;氧化铜、氧化铁等都只能与酸反应生成盐和水,这些氧化物为碱性氧化物;而氧化铝既能与酸反应又能与碱反应生成盐和水,因此氧化铝为两性氧化物。
(1)现有①七氧化二锰、②二氧化硅、③氧化钠、④氧化钙、⑤氧化锌5种氧化物,其中七氧化二锰、二氧化硅、氧化锌可与碱反应生成盐和水;氧化钠、氧化钙、氧化锌可与酸反应生成盐和水。这5种氧化物中:属于酸性氧化物的是___________ (填序号,下同);属于碱性氧化物的是___________ ;属于两性氧化物的是___________ 。
(2)请写出下列反应的化学方程式:
①二氧化硫和氧化钙____________________ ;
②二氧化硫和过量氢氧化钠溶液_________________ ;
③氧化钠和二氧化碳__________________ ;
④氧化钠和稀盐酸____________________ ;
⑤氧化钠和水____________________ 。
(3)下列说法正确的是___________(填字母)。
(1)现有①七氧化二锰、②二氧化硅、③氧化钠、④氧化钙、⑤氧化锌5种氧化物,其中七氧化二锰、二氧化硅、氧化锌可与碱反应生成盐和水;氧化钠、氧化钙、氧化锌可与酸反应生成盐和水。这5种氧化物中:属于酸性氧化物的是
(2)请写出下列反应的化学方程式:
①二氧化硫和氧化钙
②二氧化硫和过量氢氧化钠溶液
③氧化钠和二氧化碳
④氧化钠和稀盐酸
⑤氧化钠和水
(3)下列说法正确的是___________(填字母)。
| A.金属氧化物都是碱性氧化物 | B.非金属氧化物都是酸性氧化物 |
| C.碱性氧化物都是金属氧化物 | D.酸性氧化物都是非金属氧化物 |
您最近一年使用:0次
2023-09-03更新
|
1812次组卷
|
3卷引用:作业(一) 物质的分类



