名校
解题方法
1 . 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。
(1)可以用电镀法在钢制品上电镀铝,为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应消耗2mol NaOH时,所得气体的物质的量为_______ mol。
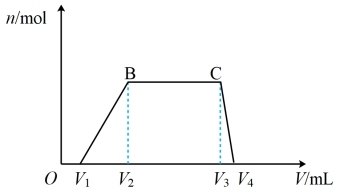
(2)双羟基铝碳酸钠[NaAl(OH)2CO3]是一种常用的抗酸药,它与胃酸反应的化学方程式为_______ 。
(3)如图是从铝土矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程:
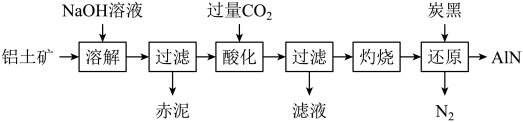
①“溶解”时,SiO2与NaOH溶液反应生成的硅酸钠与溶液中偏铝酸钠发生反应: ,“赤泥”的主要成分为
,“赤泥”的主要成分为_______ (写出化学式)。
②“酸化”时,通入过量CO2与NaAlO2反应,生成滤液的主要成分是_______ (写化学式)。
③“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为_______ 。
(4)1L某混合溶液,可能含有的离子如下表:
往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。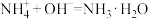
①该溶液中一定不含有的离子是_______ 。
②V1、V2、V3、V4之间的关系为_______ 。
(1)可以用电镀法在钢制品上电镀铝,为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应消耗2mol NaOH时,所得气体的物质的量为
(2)双羟基铝碳酸钠[NaAl(OH)2CO3]是一种常用的抗酸药,它与胃酸反应的化学方程式为
(3)如图是从铝土矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程:

①“溶解”时,SiO2与NaOH溶液反应生成的硅酸钠与溶液中偏铝酸钠发生反应:
 ,“赤泥”的主要成分为
,“赤泥”的主要成分为②“酸化”时,通入过量CO2与NaAlO2反应,生成滤液的主要成分是
③“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为
(4)1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、Mg2+、Al3+、 |
| 可能大量含有的阴离子 | Cl-、 |
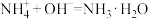

①该溶液中一定不含有的离子是
②V1、V2、V3、V4之间的关系为
您最近一年使用:0次
2020-11-19更新
|
1611次组卷
|
6卷引用:安徽省六安第一中学2023-2024学年高一上学期期末考试化学试题
名校
解题方法
2 . 下列表示对应化学反应的离子方程式正确的是
A.NaOH溶液与足量NaHCO3溶液反应:OH- + HCO = CO = CO + H2O + H2O |
B.Fe2(SO4)3溶液中加入足量Ba(OH)2溶液:Fe3+ + SO + Ba2+ + 3OH-=Fe(OH)3↓ + BaSO4↓ + Ba2+ + 3OH-=Fe(OH)3↓ + BaSO4↓ |
| C.碳酸钡中加入稀硫酸:BaCO3 + 2H+= Ba2+ + H2O + CO2↑ |
| D.氯化铝溶液与过量氨水反应 Al3+ + 3OH-=Al(OH)3↓ |
您最近一年使用:0次
2020-09-11更新
|
644次组卷
|
3卷引用:安徽省滁州市定远县育才学校2020-2021学年高一上学期期末考试化学试题
3 . 在给定条件下,下列选项所示的物质间转化均能实现的是
A.N2 NO2 NO2 HNO3 HNO3 |
B.石油 CH3CH3 CH3CH3 CH2BrCH2Br CH2BrCH2Br |
C.Al  Al(NO3)3(aq) Al(NO3)3(aq) Al(OH)3(s) Al(OH)3(s) |
D.CH2=CH2  CH3CH2OH CH3CH2OH CH3CHO CH3CHO |
您最近一年使用:0次
4 . 铝元素含量居金属首位,主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领域应用广泛。
Ⅰ、工业上用铝土矿制备铝的某种化合物的工艺流程如下:

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
Fe2++□ClO-+□ ═□Fe(OH)3↓+□Cl-+□__________
②检验滤液B中是否还含有铁元素的方法为:_________________________
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________ (选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、__________ (填操作名称)、过滤、洗涤。
Ⅱ、明矾(KAl(SO4)2·12H2O)在日常生活、生产中也占有一席之地。
(1)明矾曾经是净水明星,用离子方程式表示其净水原理_____________________________ 。
(2)明矾净水时,若不慎过量会有一定程度的副作用。将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,并且过滤,就可以避免,请用离子反方程式描述其过程______________ 。
Ⅰ、工业上用铝土矿制备铝的某种化合物的工艺流程如下:

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
Fe2++□ClO-+□ ═□Fe(OH)3↓+□Cl-+□
②检验滤液B中是否还含有铁元素的方法为:
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、
Ⅱ、明矾(KAl(SO4)2·12H2O)在日常生活、生产中也占有一席之地。
(1)明矾曾经是净水明星,用离子方程式表示其净水原理
(2)明矾净水时,若不慎过量会有一定程度的副作用。将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,并且过滤,就可以避免,请用离子反方程式描述其过程
您最近一年使用:0次
2017-11-30更新
|
917次组卷
|
4卷引用:安徽省定远县育才学校2021届高三8月月考化学试题
安徽省定远县育才学校2021届高三8月月考化学试题山西省吕梁市2018届高三上学期第一次阶段性测试化学试题陕西省延安市吴起高级中学2019-2020学年高二下学期第三次质量检测化学试题(已下线)第6讲 铝及其化合物-2021年高考化学一轮复习名师精讲练



