解题方法
1 . 某待测液中可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 12种离子中的某几种.为探究其组成现设计如图流程.
12种离子中的某几种.为探究其组成现设计如图流程.
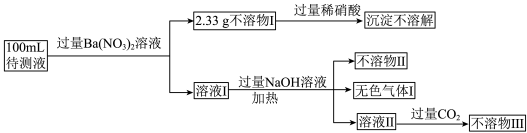
已知该待测液中所有离子的浓度均相等.
(1)待测液中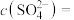
______  .
.
(2)生成不溶物Ⅰ的离子方程式为______ .
(3)不溶物Ⅱ和不溶物Ⅲ的化学式分别为______ 、______ .
(4)若向溶液Ⅰ中加入过量的稀盐酸,观察到的现象为______ ;若向不溶物Ⅲ中加入过量的NaOH溶液,反应的离子方程式为______ .
(5)待测液中一定不含的离子是______ .
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 12种离子中的某几种.为探究其组成现设计如图流程.
12种离子中的某几种.为探究其组成现设计如图流程.
已知该待测液中所有离子的浓度均相等.
(1)待测液中
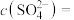
 .
.(2)生成不溶物Ⅰ的离子方程式为
(3)不溶物Ⅱ和不溶物Ⅲ的化学式分别为
(4)若向溶液Ⅰ中加入过量的稀盐酸,观察到的现象为
(5)待测液中一定不含的离子是
您最近半年使用:0次
名校
解题方法
2 . 以稀硫酸、NaOH和1mol Al为原料,用三种不同途径制取1mol Al(OH)3。
甲:Al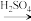 Al2(SO4)3
Al2(SO4)3 Al(OH)3
Al(OH)3
乙:Al NaAl(OH)4
NaAl(OH)4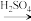 Al(OH)3
Al(OH)3
丙: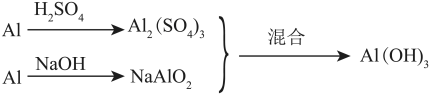
乙的第一步反应中的氧化剂是___________ 。消耗原料由多至少的方案顺序为___________ (用甲、乙、丙表示)。
甲:Al
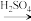 Al2(SO4)3
Al2(SO4)3 Al(OH)3
Al(OH)3乙:Al
 NaAl(OH)4
NaAl(OH)4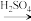 Al(OH)3
Al(OH)3丙:
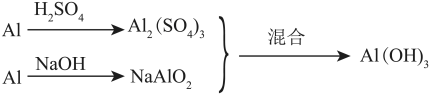
乙的第一步反应中的氧化剂是
您最近半年使用:0次
名校
解题方法
3 . 下列离子方程式书写正确的是
| A.向氧化亚铁中加入稀盐酸:FeO+2H+ = Fe3++H2O |
| B.向FeI2溶液中通入足量的Cl2:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 |
C.AlCl3溶液中滴加过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH |
D.向NaHCO3溶液中滴入少量澄清石灰水:HCO +Ca2++OH-=CaCO3↓+H2O +Ca2++OH-=CaCO3↓+H2O |
您最近半年使用:0次
2022-12-30更新
|
941次组卷
|
5卷引用:辽宁省六校协作体2022-2023学年高一上学期12月月考化学试题
名校
解题方法
4 . 下列反应对应的离子方程式书写正确的是
A.将等物质的量浓度的 和 和 溶液以体积比1:2混合: 溶液以体积比1:2混合: |
B.向 溶液中通入少量的 溶液中通入少量的 : : |
C. 溶于过量氢碘酸溶液中: 溶于过量氢碘酸溶液中: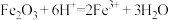 |
D.明矾溶液与过量氨水混合: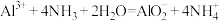 |
您最近半年使用:0次
2022-11-25更新
|
573次组卷
|
2卷引用:河南省三门峡市2022-2023学年高三上学期11月阶段性考试化学试题
5 . 固体化合物X由3种元素组成,某学以小组开展如图探究实验。

其中,白色沉淀B能溶于NaOH溶液。下列说法不正确的是

其中,白色沉淀B能溶于NaOH溶液。下列说法不正确的是
| A.化合物X所含元素是Cu、Al、Cl |
| B.深蓝色溶液中含有[Cu(NH3)4]Cl2 |
| C.白色沉淀E可溶于任何碱溶液 |
D.蓝色溶液A与N2H 作用,生成一种气体,溶液蓝色褪去,同时生成易溶于硝酸的白色沉淀,该反应的离子方程式:4Cu2++N2H 作用,生成一种气体,溶液蓝色褪去,同时生成易溶于硝酸的白色沉淀,该反应的离子方程式:4Cu2++N2H +4Cl-=4CuCl↓+N2↑+5H+ +4Cl-=4CuCl↓+N2↑+5H+ |
您最近半年使用:0次
名校
6 . 下列离子方程式书写正确的是
A.用酸性高锰酸钾标准溶液滴定草酸:2 +16H++5 +16H++5 =2Mn2++10CO2↑+8H2O =2Mn2++10CO2↑+8H2O |
| B.向含1mol FeBr2的溶液中通入标准状况下22.4L Cl2时,发生的反应为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
C.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O= +4 +4 +2H2O +2H2O |
D.向稀硝酸中滴加少量亚硫酸钠溶液: +2H+=SO2↑+H2O +2H+=SO2↑+H2O |
您最近半年使用:0次
2022-03-16更新
|
1689次组卷
|
3卷引用:重庆市育才中学校2021-2022学年高三下学期3月月考化学试题
7 . 为探究由3种短周期元素构成的化合物X的性质。完成以下实验:
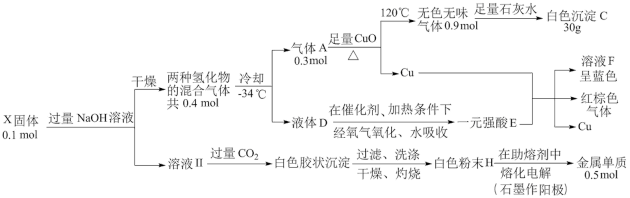
(1)X的化学式为___________ 。
(2)气体A与足量CuO反应的化学方程式为___________ 。
(3)溶液II通入过量CO2时,发生反应的离子方程式为___________ 、___________ 。
(4)将F溶液通过一系列操作获得结晶水合物(含有结晶水的盐),加热该结晶水合物。将生成的红棕色混合气体(>100°C)全部收集并冷却。气体全部反应无剩余,得到一元强酸E的水溶液(其中E与水的物质的量之比1∶1)写出该结晶水合物受热分解的化学方程式___________ 。
(5)设计实验证明F溶液的阴离子(OH—除外)___________ 。

(1)X的化学式为
(2)气体A与足量CuO反应的化学方程式为
(3)溶液II通入过量CO2时,发生反应的离子方程式为
(4)将F溶液通过一系列操作获得结晶水合物(含有结晶水的盐),加热该结晶水合物。将生成的红棕色混合气体(>100°C)全部收集并冷却。气体全部反应无剩余,得到一元强酸E的水溶液(其中E与水的物质的量之比1∶1)写出该结晶水合物受热分解的化学方程式
(5)设计实验证明F溶液的阴离子(OH—除外)
您最近半年使用:0次
解题方法
8 . 重铬酸钠是一种用途极广的氧化剂,以铬铁矿[主要成分Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体,同时回收Cr的主要工艺流程如图:
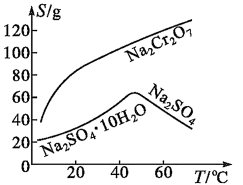
已知部分物质的溶解度曲线如图所示。
请回答下列问题:
(1)煅烧生成Na2CrO4的化学方程式为___________ 。
(2)将Fe2O3溶于稀硫酸后得到对应盐溶液,检验该溶液中金属阳离子的方法是___________ 。
(3)若通过加入稀硫酸调节溶液pH使铝元素转化为Al(OH)3,所发生反应的离子方程式为___________ 。
(4)Na2CrO4经酸化转化为Na2Cr2O7的原理为___________ (结合离子方程式用平衡移动原理解释)。
(5)操作a的实验步骤为___________ 。
(6)加入Na2S溶液反应后,硫元素全部以S2O 的形式存在,该反应中氧化剂和还原剂的物质的量之比为
的形式存在,该反应中氧化剂和还原剂的物质的量之比为___________ 。
(7)含铬废水会对环境造成污染,要经过化学处理才能排放。现将含CrO 的废水加入可溶性钡盐生成BaCrO4沉淀,加入可溶性钡盐后,废水中Ba2+的浓度应不小于
的废水加入可溶性钡盐生成BaCrO4沉淀,加入可溶性钡盐后,废水中Ba2+的浓度应不小于___________ mol•L−1,CrO 才能沉淀完全[当溶液中c(CrO
才能沉淀完全[当溶液中c(CrO )≤1×10-5 mol•L−1时,可视作该离子沉淀完全,已知Ksp(BaCrO4)=1.2×10−10]
)≤1×10-5 mol•L−1时,可视作该离子沉淀完全,已知Ksp(BaCrO4)=1.2×10−10]

已知部分物质的溶解度曲线如图所示。

请回答下列问题:
(1)煅烧生成Na2CrO4的化学方程式为
(2)将Fe2O3溶于稀硫酸后得到对应盐溶液,检验该溶液中金属阳离子的方法是
(3)若通过加入稀硫酸调节溶液pH使铝元素转化为Al(OH)3,所发生反应的离子方程式为
(4)Na2CrO4经酸化转化为Na2Cr2O7的原理为
(5)操作a的实验步骤为
(6)加入Na2S溶液反应后,硫元素全部以S2O
 的形式存在,该反应中氧化剂和还原剂的物质的量之比为
的形式存在,该反应中氧化剂和还原剂的物质的量之比为(7)含铬废水会对环境造成污染,要经过化学处理才能排放。现将含CrO
 的废水加入可溶性钡盐生成BaCrO4沉淀,加入可溶性钡盐后,废水中Ba2+的浓度应不小于
的废水加入可溶性钡盐生成BaCrO4沉淀,加入可溶性钡盐后,废水中Ba2+的浓度应不小于 才能沉淀完全[当溶液中c(CrO
才能沉淀完全[当溶液中c(CrO )≤1×10-5 mol•L−1时,可视作该离子沉淀完全,已知Ksp(BaCrO4)=1.2×10−10]
)≤1×10-5 mol•L−1时,可视作该离子沉淀完全,已知Ksp(BaCrO4)=1.2×10−10]
您最近半年使用:0次
20-21高二上·浙江绍兴·阶段练习
解题方法
9 . 某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾晶体,具体流程如下:
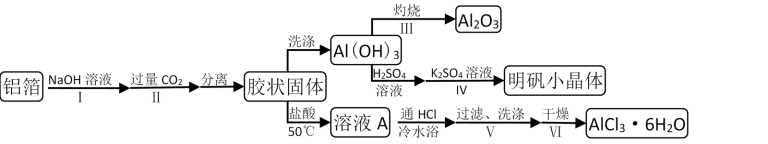
已知:AlCl3·6H2O易溶于水、乙醇及乙醚;请回答:
(1)步骤I中发生的化学方程式______ ;步骤II中发生的离子方程式________
(2)步骤III,下列操作合理的是________ (多选)
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.需用坩埚钳移动灼热的坩埚
D.坩埚取下后放在石棉网上冷却待用
(3)依次加入硫酸溶液、硫酸钾溶液后,步骤IV的操作是__ 、________ 过滤、洗涤、干燥。
(4)步骤V,过滤时,用到的玻璃仪器有________ ;
(5)步骤VI,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是________
A.常温干燥B.低温干燥C.高温干燥

已知:AlCl3·6H2O易溶于水、乙醇及乙醚;请回答:
(1)步骤I中发生的化学方程式
(2)步骤III,下列操作合理的是
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.需用坩埚钳移动灼热的坩埚
D.坩埚取下后放在石棉网上冷却待用
(3)依次加入硫酸溶液、硫酸钾溶液后,步骤IV的操作是
(4)步骤V,过滤时,用到的玻璃仪器有
(5)步骤VI,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是
A.常温干燥B.低温干燥C.高温干燥
您最近半年使用:0次
解题方法
10 . 下列指定反应的离子方程式正确的是
A.向NaAlO2溶液中滴入足量Ca(HCO3)2溶液: + + +H2O=Al(OH)3↓+ +H2O=Al(OH)3↓+ |
B.铬酸钾溶液中滴入稀盐酸:2 +2H+ +2H+  +H2O +H2O |
C.向Na2S溶液中通入少量SO2[已知:H2SO3 的Ka1=1.3×10-2,Ka2=6.3×10-8;H2S 的Ka1= 5.7×10-8,Ka2=1.2×10-15]:S2-+SO2+H2O= +H2S +H2S |
D.向二元弱酸亚磷酸(H3PO3)溶液中滴入足量烧碱溶液:H3PO3+2OH-= +2H2O +2H2O |
您最近半年使用:0次



