解题方法
1 . 明矾[KAl(SO4)2∙12H2O]在造纸、净水等方面应用广泛,实验室以铝灰为原料制备明矾的流程如下图所示,

已知:①铝灰含Al、Al2O3和少量FeO、Fe2O3、SiO2;
②SiO2不溶于强酸;
③不同温度KAl(SO4)2∙12H2O的溶解度:
回答下列问题:
(1)“酸浸”后溶液中主要的金属离子有Fe3+、___________ 。“滤渣Ⅰ”的主要成分为___________ (填化学式)。
(2)①“氧化”过程中H2O2的作用是___________ (用离子方程式表示)。
②Fe2+的“氧化效率”与温度的关系如图所示,试解释温度过高,“氧化效率”降低的可能原因是___________ 。

(3)溶液的pH对铝、铁沉淀率的影响如图所示。“调pH”时应控制溶液的pH范围为___________ 。
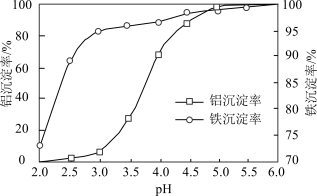
A.3.0~3.5 B.4.0~4.5 C.4.5~5.0
(4)“沉铝”中发生的离子方程式为___________ 。
(5)得到明矾晶体的“系列操作”包括___________ 、___________ 、过滤、洗涤、干燥。

已知:①铝灰含Al、Al2O3和少量FeO、Fe2O3、SiO2;
②SiO2不溶于强酸;
③不同温度KAl(SO4)2∙12H2O的溶解度:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
| KAl(SO4)2∙12H2O/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
(1)“酸浸”后溶液中主要的金属离子有Fe3+、
(2)①“氧化”过程中H2O2的作用是
②Fe2+的“氧化效率”与温度的关系如图所示,试解释温度过高,“氧化效率”降低的可能原因是

(3)溶液的pH对铝、铁沉淀率的影响如图所示。“调pH”时应控制溶液的pH范围为

A.3.0~3.5 B.4.0~4.5 C.4.5~5.0
(4)“沉铝”中发生的离子方程式为
(5)得到明矾晶体的“系列操作”包括
您最近一年使用:0次
11-12高一·全国·课时练习
名校
2 . 某校化学兴趣小组用如图所示过程除去AlCl3中含有Mg2+、K+杂质离子并尽可能减少AlCl3的损失。
请回答下列问题:
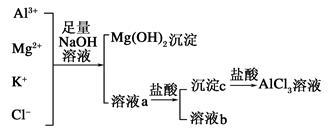
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:____________ 。
(2)氢氧化钠溶液能否用氨水代替,为什么?_________________ 。
(3)溶液a中存在的离子有________ ;在溶液a中加入盐酸时需控制盐酸的量,其原因为_________________ 。为此,改进方法是_____________________ 。
请回答下列问题:

(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:
(2)氢氧化钠溶液能否用氨水代替,为什么?
(3)溶液a中存在的离子有
您最近一年使用:0次
2017-11-27更新
|
1246次组卷
|
7卷引用:2012年人教版高中化学必修一3.2 几种重要的金属化合物练习卷
(已下线)2012年人教版高中化学必修一3.2 几种重要的金属化合物练习卷(已下线)同步君 必修1 第3章 第2节 铝的化合物高中化学人教版 必修1 第三章 金属及其化合物 2.几种重要的金属化合物 铝的重要化合物2018年高一化学(人教版)必修1综合题型练习卷:几种重要的金属化合物(已下线)2018年11月4日 《每日一题》人教必修1- 每周一测(已下线)2018年11月10日 ——《每日一题》人教必修1 周末培优山西省实验中学2019届高三上学期第二次月考化学试题



