解题方法
1 . 铜广泛应用于电气、轻工、机械制造、国防工业等。回答下列问题:
(1)用黄铜矿冶铜原理如图所示:

①反应Ⅱ中每消耗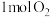 转移电子的物质的量为
转移电子的物质的量为______ 。
②反应Ⅲ的化学方程式为______ 。
(2)铜锈中有无害的 和有害的“粉状锈”
和有害的“粉状锈” 。
。
① 和
和 均属于
均属于______ 填“正”“酸式”或“碱式")盐; 在湿的空气中生成
在湿的空气中生成 的化学方程式为
的化学方程式为______ 。
②某铜锈样品可能由 、
、 和
和 组成,测定其组成的步骤如图所示,则铜锈样品中
组成,测定其组成的步骤如图所示,则铜锈样品中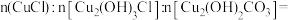
______ 。
(1)用黄铜矿冶铜原理如图所示:

①反应Ⅱ中每消耗
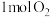 转移电子的物质的量为
转移电子的物质的量为②反应Ⅲ的化学方程式为
(2)铜锈中有无害的
 和有害的“粉状锈”
和有害的“粉状锈” 。
。①
 和
和 均属于
均属于 在湿的空气中生成
在湿的空气中生成 的化学方程式为
的化学方程式为②某铜锈样品可能由
 、
、 和
和 组成,测定其组成的步骤如图所示,则铜锈样品中
组成,测定其组成的步骤如图所示,则铜锈样品中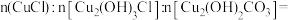

您最近一年使用:0次
名校
解题方法
2 . 中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银铜合金切割废料中回收银并制备铜化工产品的工艺如下:

注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为___________ 。
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为___________ (写出两种)。
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为______________________ 。
(4)过滤操作需要的玻璃仪器除烧杯外还有___________ 。
(5)固体混合物B的组成为___________ ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为___________ 。
(6)煅烧阶段通入惰性气体的原因___________ 。

注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为
(4)过滤操作需要的玻璃仪器除烧杯外还有
(5)固体混合物B的组成为
(6)煅烧阶段通入惰性气体的原因
您最近一年使用:0次
2019-04-08更新
|
523次组卷
|
9卷引用:贵州省威宁阳光高级中学2022届高三第一次月考化学试题
名校
解题方法
3 . 信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70% Cu、25% Al、4% Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:

回答下列问题:
(1)第①步Cu与酸反应的化学方程式为_______________________________________ ;
得到滤渣1的主要成分为________________ 。
(2)第②步加入H2O2的的离子方程式为______________________________________ ;使用H2O2的优点是______________________________________________ ;调节pH所产生的沉淀的化学式为______ 、______ 。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________ 。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
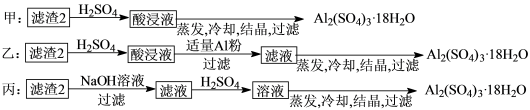
上述三种方案中,可行方案是______ ,其中不可行方案的原因是______________________ 。

回答下列问题:
(1)第①步Cu与酸反应的化学方程式为
得到滤渣1的主要成分为
(2)第②步加入H2O2的的离子方程式为
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
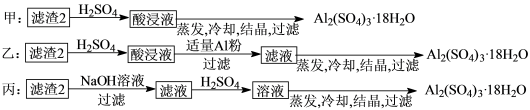
上述三种方案中,可行方案是
您最近一年使用:0次



