解题方法
1 . 已知: ,氢氧化铜悬浊液受热易分解生成
,氢氧化铜悬浊液受热易分解生成 。蚀刻含铜电路板有多种方法,用蚀刻废液可制备
。蚀刻含铜电路板有多种方法,用蚀刻废液可制备 。
。
(1)酸性蚀刻液法(过氧化氢-盐酸法)。
①用过氧化氢和盐酸蚀刻含铜电路板时发生的离子反应方程式为_______ 。
②反应后有气泡产生,且反应一段时间后,随着溶液变蓝,产生气泡的速率加快,可能的原因是_______ 。
(2)碱性蚀刻液法。碱性含铜蚀刻液主要成分为 、氨水、氯化铵等。蚀刻过程中,
、氨水、氯化铵等。蚀刻过程中, 与电路板上的铜发生反应生成
与电路板上的铜发生反应生成 ,失去蚀刻能力,通入空气可恢复蚀刻能力。
,失去蚀刻能力,通入空气可恢复蚀刻能力。
①
 中
中 键的数目为
键的数目为_______ 。
②蚀刻能力恢复的化学方程式为_______ 。
(3)酸性蚀刻废液与碱性蚀刻废液混和可析出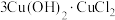 沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
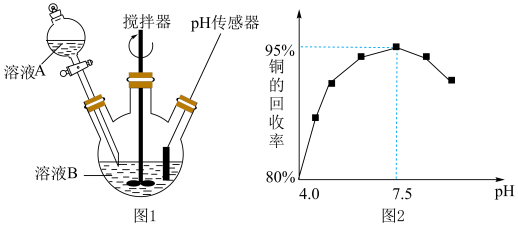
①为减少 胶体形成而影响后续操作,溶液A为
胶体形成而影响后续操作,溶液A为_______ (选填“酸性”或“碱性”)蚀刻废液。
② 时,铜元素回收率下降的原因为
时,铜元素回收率下降的原因为_______ 。
(4)设计从酸性蚀刻废液中制备氧化铜的实验方案。向一定质量的酸性蚀刻废液中_______ 。(实验中必须 使用的试剂:20% 溶液、硝酸银溶液、稀硝酸、蒸馏水)
溶液、硝酸银溶液、稀硝酸、蒸馏水)
 ,氢氧化铜悬浊液受热易分解生成
,氢氧化铜悬浊液受热易分解生成 。蚀刻含铜电路板有多种方法,用蚀刻废液可制备
。蚀刻含铜电路板有多种方法,用蚀刻废液可制备 。
。(1)酸性蚀刻液法(过氧化氢-盐酸法)。
①用过氧化氢和盐酸蚀刻含铜电路板时发生的离子反应方程式为
②反应后有气泡产生,且反应一段时间后,随着溶液变蓝,产生气泡的速率加快,可能的原因是
(2)碱性蚀刻液法。碱性含铜蚀刻液主要成分为
 、氨水、氯化铵等。蚀刻过程中,
、氨水、氯化铵等。蚀刻过程中, 与电路板上的铜发生反应生成
与电路板上的铜发生反应生成 ,失去蚀刻能力,通入空气可恢复蚀刻能力。
,失去蚀刻能力,通入空气可恢复蚀刻能力。①

 中
中 键的数目为
键的数目为②蚀刻能力恢复的化学方程式为
(3)酸性蚀刻废液与碱性蚀刻废液混和可析出
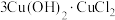 沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
①为减少
 胶体形成而影响后续操作,溶液A为
胶体形成而影响后续操作,溶液A为②
 时,铜元素回收率下降的原因为
时,铜元素回收率下降的原因为(4)设计从酸性蚀刻废液中制备氧化铜的实验方案。向一定质量的酸性蚀刻废液中
 溶液、硝酸银溶液、稀硝酸、蒸馏水)
溶液、硝酸银溶液、稀硝酸、蒸馏水)
您最近一年使用:0次
2 . 某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2。利用该固体废渣制取Cu(NO3)2溶液的工艺流程如图所示:
②SiO2是酸性氧化物,难于水和酸。
(1)写出Cu2O与稀硝酸反应的离子反应方程式为___________ ;
(2)酸溶时,反应温度不宜超过70℃,其主要原因是___________ ;
(3)将酸溶步骤排放的NO循环利用既环保又能提高产量,具体操作流程是___________ ;
(4)酸溶试剂改用绿色氧化剂(10%H2O2和20%稀硝酸的混合液),基本无氮氧化物排放,写出废渣中Cu与绿色氧化剂反应的离子反应方程式___________ ;
(5)中和试剂选择Cu(OH)2,若改为NaOH,缺点是___________ ;
(6)以某工业废水(主要含Cu2+、Na+、SO )为原料,设计制取Cu(NO3)2·3H2O晶体的实验方案:向工业废水中加入
)为原料,设计制取Cu(NO3)2·3H2O晶体的实验方案:向工业废水中加入___________ ,洗涤,干燥。(须使用的试剂有:蒸馏水、1mol/L NaOH溶液、1mol/LHNO3溶液;Cu(NO3)2的溶解度曲线如图所示。)
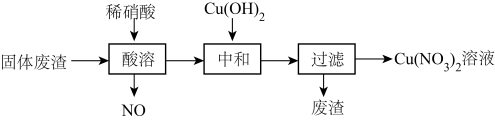
②SiO2是酸性氧化物,难于水和酸。
(1)写出Cu2O与稀硝酸反应的离子反应方程式为
(2)酸溶时,反应温度不宜超过70℃,其主要原因是
(3)将酸溶步骤排放的NO循环利用既环保又能提高产量,具体操作流程是
(4)酸溶试剂改用绿色氧化剂(10%H2O2和20%稀硝酸的混合液),基本无氮氧化物排放,写出废渣中Cu与绿色氧化剂反应的离子反应方程式
(5)中和试剂选择Cu(OH)2,若改为NaOH,缺点是
(6)以某工业废水(主要含Cu2+、Na+、SO
 )为原料,设计制取Cu(NO3)2·3H2O晶体的实验方案:向工业废水中加入
)为原料,设计制取Cu(NO3)2·3H2O晶体的实验方案:向工业废水中加入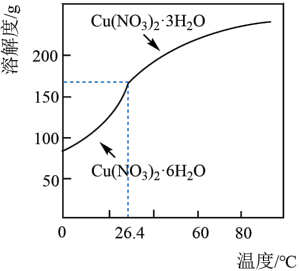
您最近一年使用:0次
名校
解题方法
3 . CuCl可用作有机合成的催化剂。工业上用黄铜矿(主要成分是CuFeS2,还含有少量SiO2)制备CuCl的工艺流程如下:
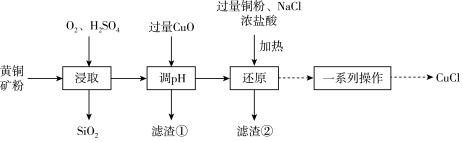
回答下列问题:
(1) 的电子排布式是:
的电子排布式是:_______ 。
(2)“浸取”时,硫元素转化为硫酸根离子,则反应的离子方程式为_______ 。
(3)“滤渣①”的成分是_______ (填化学式)
(4)已知在水溶液中存在平衡: (无色)。“还原”时使用浓盐酸和
(无色)。“还原”时使用浓盐酸和 固体的原因是
固体的原因是_______ ;当出现_______ 现象时,表明“还原”进行完全。
(5)制备 。请补充由还原所得的滤液液制备
。请补充由还原所得的滤液液制备 的操作步骤:
的操作步骤:_______ ,真空干燥。[已知 是一种难溶于水和乙醇的白色固体,潮湿时易被氧化。实验中必须使用的试剂:水、
是一种难溶于水和乙醇的白色固体,潮湿时易被氧化。实验中必须使用的试剂:水、 、
、 、
、 ]。
]。

回答下列问题:
(1)
 的电子排布式是:
的电子排布式是:(2)“浸取”时,硫元素转化为硫酸根离子,则反应的离子方程式为
(3)“滤渣①”的成分是
(4)已知在水溶液中存在平衡:
 (无色)。“还原”时使用浓盐酸和
(无色)。“还原”时使用浓盐酸和 固体的原因是
固体的原因是(5)制备
 。请补充由还原所得的滤液液制备
。请补充由还原所得的滤液液制备 的操作步骤:
的操作步骤: 是一种难溶于水和乙醇的白色固体,潮湿时易被氧化。实验中必须使用的试剂:水、
是一种难溶于水和乙醇的白色固体,潮湿时易被氧化。实验中必须使用的试剂:水、 、
、 、
、 ]。
]。
您最近一年使用:0次
2021-09-15更新
|
383次组卷
|
2卷引用:江苏省如东高级中学2022届高三第一次学情检测化学试题
名校
解题方法
4 . 现有 与
与 的混合溶液,为了分析混合溶液中
的混合溶液,为了分析混合溶液中 与
与 的质量分数,设计如下实验方案:取四份混合溶液各
的质量分数,设计如下实验方案:取四份混合溶液各 ,分别缓慢加入到
,分别缓慢加入到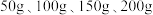 某
某 溶液中,测得四组实验数据如表:
溶液中,测得四组实验数据如表:
(1) 混合溶液与
混合溶液与 溶液完全反应生成沉淀的质量为
溶液完全反应生成沉淀的质量为______ g。
(2)试求出混合溶液中 的溶质质量分数是
的溶质质量分数是______ ?(写出计算过程)
(3)混合溶液中 的溶质质量分数为
的溶质质量分数为______ 。
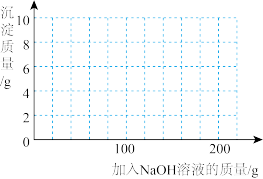
(4)若在 混合溶液中不断加入上述
混合溶液中不断加入上述 的溶液,请画出加入
的溶液,请画出加入 溶液的质量与所产生沉淀质量的关系图
溶液的质量与所产生沉淀质量的关系图______ 。(在答题卡的坐标图中作图)
 与
与 的混合溶液,为了分析混合溶液中
的混合溶液,为了分析混合溶液中 与
与 的质量分数,设计如下实验方案:取四份混合溶液各
的质量分数,设计如下实验方案:取四份混合溶液各 ,分别缓慢加入到
,分别缓慢加入到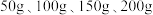 某
某 溶液中,测得四组实验数据如表:
溶液中,测得四组实验数据如表: | 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | 第Ⅳ组 | |
 溶液的质量 溶液的质量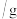 | 50 | 100 | 150 | 200 |
生成沉淀的质量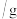 | 0 | 2.45 | 7.35 | 9.8 |
(1)
 混合溶液与
混合溶液与 溶液完全反应生成沉淀的质量为
溶液完全反应生成沉淀的质量为(2)试求出混合溶液中
 的溶质质量分数是
的溶质质量分数是(3)混合溶液中
 的溶质质量分数为
的溶质质量分数为(4)若在
 混合溶液中不断加入上述
混合溶液中不断加入上述 的溶液,请画出加入
的溶液,请画出加入 溶液的质量与所产生沉淀质量的关系图
溶液的质量与所产生沉淀质量的关系图
您最近一年使用:0次
名校
解题方法
5 . 以铜片(含少量杂质铁)为原料制取Cu(NO3)2溶液的实验流程如图:
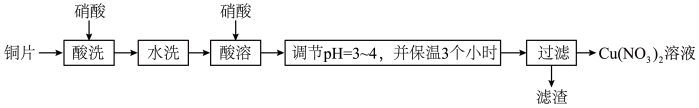
(1)“酸洗”的目的是除去铜片表面难溶的Cu2(OH)2SO4,写出“酸洗”时反应的离子方程式:___ 。
(2)“水洗”后检验铜片表面是否洗涤干净的方法是___ 。
(3)“酸溶”时的装置如图所示,烧杯内所发生的反应为:
NO+NO2+2OH-=2NO2-+H2O
2NO2+2OH-=NO2-+NO3-+H2O
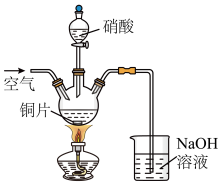
①“酸溶”时为防止反应过于剧烈,可以采取的方法有___ 和___ 。
②通入空气的作用是___ 、___ 。
(4)“调节pH=3~4,并保温3个小时”的目的是___ 。
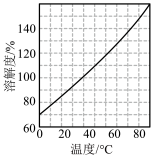
(5)烧杯中所得溶液经多步处理得到NaNO3固体。设计以烧杯中所得溶液为原料,制取NaNO3固体的实验方案:___ 。
[已知3NaNO2+2HNO3=3NaNO3+2NO↑+H2O;NaNO3的溶解度随温度变化如图所示。实验中必须使用的试剂:硝酸和NaOH溶液]。

(1)“酸洗”的目的是除去铜片表面难溶的Cu2(OH)2SO4,写出“酸洗”时反应的离子方程式:
(2)“水洗”后检验铜片表面是否洗涤干净的方法是
(3)“酸溶”时的装置如图所示,烧杯内所发生的反应为:
NO+NO2+2OH-=2NO2-+H2O
2NO2+2OH-=NO2-+NO3-+H2O

①“酸溶”时为防止反应过于剧烈,可以采取的方法有
②通入空气的作用是
(4)“调节pH=3~4,并保温3个小时”的目的是
(5)烧杯中所得溶液经多步处理得到NaNO3固体。设计以烧杯中所得溶液为原料,制取NaNO3固体的实验方案:
[已知3NaNO2+2HNO3=3NaNO3+2NO↑+H2O;NaNO3的溶解度随温度变化如图所示。实验中必须使用的试剂:硝酸和NaOH溶液]。

您最近一年使用:0次
2020-05-09更新
|
134次组卷
|
2卷引用:江苏省如皋中学2020届高三阶段检测化学试题
2020·江苏·模拟预测
解题方法
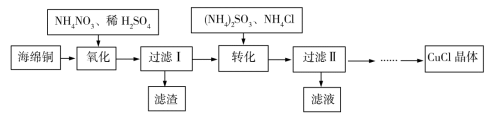
6 . 实验室以海绵铜(主要成分为Cu和CuO)为原料制取CuCl的主要流程如图所示。
已知:①CuCl微溶于水,不溶于乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl露置于潮湿的空气中易被氧化。
回答下列问题。
(1)“氧化”时温度应控制在60~70℃,原因是____________________ 。
(2)写出“转化”过程中的离子方程式____________________ 。
(3)“过滤Ⅱ”所得滤液经__________ 、__________ 、过滤等操作获得(NH4)2SO4晶体,可用作化学肥料。“过滤Ⅱ”所得滤渣主要成分为CuCl,用乙醇洗涤的优点是________________ 。
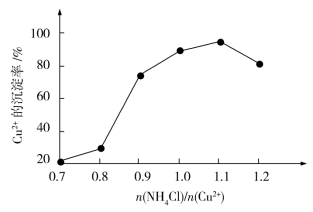
(4)氯化铵用量[ ]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是
]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是__________ 。
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:__________ 。(实验中可选试剂:0.1 mol·L−1盐酸、10 mol·L−1盐酸、蒸馏水、无水乙醇)

已知:①CuCl微溶于水,不溶于乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl露置于潮湿的空气中易被氧化。
回答下列问题。
(1)“氧化”时温度应控制在60~70℃,原因是
(2)写出“转化”过程中的离子方程式
(3)“过滤Ⅱ”所得滤液经
(4)氯化铵用量[
 ]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是
]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:
您最近一年使用:0次
10-11高三上·江苏南京·阶段练习
7 . 硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。
(1)工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式_________ ;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是___________ 。
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式______________________ 。
(2)测定硫酸铜晶体中结晶水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5:_________________ ;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜晶体受热可以逐步失去结晶水,温度升高还可以分解生成铜的氧化物。现取25.0g CuSO4·5H2O晶体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:

在110℃时所得固体的成分为________________ ;在1200℃并恒温1小时,反应所得气态产物除去水后,物质的量为_______________ 。(填字母)
(1)工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式
(2)测定硫酸铜晶体中结晶水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5:
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜晶体受热可以逐步失去结晶水,温度升高还可以分解生成铜的氧化物。现取25.0g CuSO4·5H2O晶体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:

在110℃时所得固体的成分为
| A.0 mol | B.0.1mol | C.0.125mol | D.大于0.125mol |
您最近一年使用:0次



