 、硒
、硒 、碲
、碲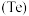 外,还含有少量稀贵金属,主要物质为
外,还含有少量稀贵金属,主要物质为 、
、 和
和 。
。(1)
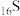 、
、 、
、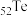 为同主族元素,其中
为同主族元素,其中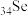 在元素周期表中的位置
在元素周期表中的位置其中铜、硒、碲的主要回收流程如图:
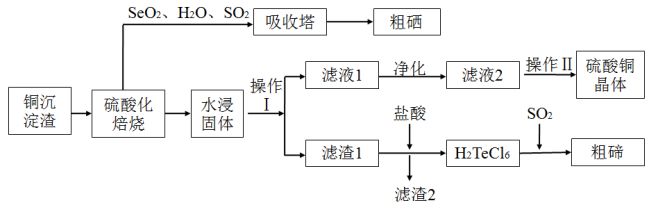
(2)经过
①写出
 硫酸化焙烧的化学方程式
硫酸化焙烧的化学方程式②“水浸固体”过程中补充少量氯化钠固体,可减少固体中的银(硫酸银)进入浸出液中,结合化学用语,从平衡移动原理角度解释其原因
③滤液2经过
(3)所得粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示。蒸馏操作中控制的最佳温度是
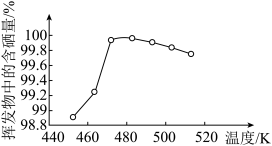
a.455℃ b.462℃ c.475℃ d.515℃
(4)目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着
 浓度的增加,促进了
浓度的增加,促进了 的沉积。写出
的沉积。写出 的沉积的电极反应式为
的沉积的电极反应式为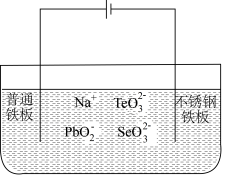
题号 | 题型 | 分值 | 能力层次 | 知识点 | |
1 | 单选 | 2 | 了解 | 常见 | |
2 | 单选 | 2 | 了解 | 化学符号及名称的综合 | |
3 | 单选 | 2 | 了解 | 物质的性质与用途 | |
4 | 单选 | 2 | 了解 | 离子共存 | |
5 | 单选 | 2 | 了解 | 化学实验方案的评价 | |
6 | 单选 | 2 | 了解 | 离子方程式的书写判断 | |
7 | 单选 | 2 | 理解 | 常见元素单质及其化合物的综合应用 | |
8 | 单选 | 2 | 理解 | 元素周期律 | |
9 | 单选 | 2 | 理解 | 物质间的转化 | |
10 | 单选 | 2 | 理解 | 化学反应中的能量变化、化学反应速率、反应限度、弱电解质的电离 | |
11 | 不定项 | 4 | 理解 | 燃料电池 | |
12 | 不定项 | 4 | 理解 | 有机化学 | |
13 | 不定项 | 4 | 理解 | 实验原理和操作 | |
14 | 不定项 | 4 | 综合运用 | 弱电解质的电离平衡、水解平衡 | |
15 | 不定项 | 4 | 综合运用 | 化学平衡 | |
16 | 16-1 | 填空 | 2 | 了解 | 工业流程条件控制 |
16-2 | 填空 | 2 | 理解 | 实验操作分析 | |
16-3 | 填空 | 2 | 综合运用 | 离子方程式书写 | |
16-4 | 填空 | 2 | 理解 | 图像分析 | |
16-5 | 填空 | 2 | 理解 | 产物分析 | |
16-6 | 填空 | 2 | 理解 | 化学方程式书写 | |
17 | 17-1 | 填空 | 2 | 了解 | 常见有机化合物的官能团 |
17-2 | 填空 | 2 | 了解 | 判断有机反应类型 | |
17-3 | 填空 | 3 | 理解 | 同分异构体的书写 | |
17-4 | 填空 | 3 | 综合运用 | 有机物的结构推断 | |
17-5 | 填空 | 5 | 综合运用 | 设计合理路线合成简单有机物 | |
18 | 18-1-1 | 填空 | 2 | 综合运用 | Ksp计算 |
18-1-2 | 填空 | 2 | 理解 | 平衡常数计算 | |
18-2-1 | 填空 | 2 | 理解 | 滴定过程的误差分析 | |
18-2-2 | 填空 | 6 | 综合运用 | 化学计算 | |
19 | 19-1 | 填空 | 2 | 理解 | 加热方式的选择 |
19-2 | 填空 | 2 | 理解 | 实验分析 | |
19-3-1 | 填空 | 2 | 理解 | 化学方程式书写 | |
19-3-2 | 填空 | 2 | 了解 | 容器名称 | |
19-4 | 填空 | 2 | 综合运用 | 实验条件控制 | |
19-5 | 填空 | 5 | 综合运用 | 运用实验原理设计实验方案 | |
20 | 20-I-1 | 填空 | 2 | 理解 | 图像分析,论据推理 |
20-I-2 | 填空 | 2 | 理解 | 根据方程式计算 | |
20-Ⅱ-1-1-1 | 填空 | 2 | 理解 | 物质稳定性分析 | |
20-Ⅱ-1-1-2 | 填空 | 2 | 综合运用 | 离子的判断 | |
20-Ⅱ-1-2 | 填空 | 2 | 综合运用 | pH计算 | |
20-Ⅱ-2-1 | 填空 | 2 | 综合运用 | 离子方程式书写 | |
20-Ⅱ-2-2 | 填空 | 2 | 综合运用 | 根据图像论据推理 | |
21A | 21-1 | 填空 | 2 | 理解 | 电子排布式的书写 |
21-2 | 填空 | 2 | 理解 | 空间构型判断 | |
21-3 | 填空 | 2 | 理解 | 杂化方式判断 | |
21-4 | 填空 | 2 | 理解 | 键型数目比较 | |
21-5 | 填空 | 2 | 理解 | 电负性大小比较 | |
21-6 | 填空 | 2 | 理解 | 方程式书写 | |
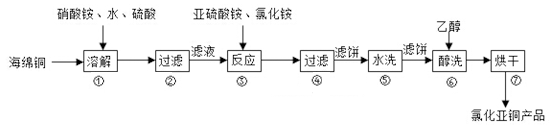
回答下列问题:
(1)CuCl中Cu元素在周期表中的位置为
(2)步骤①中N元素被还原为最低价,则Cu溶解的离子方程式为
(3)写出步骤③中主要反应的离子方程式
 与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是
与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是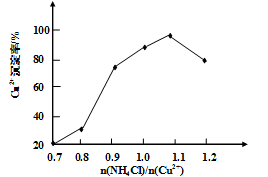
(4)步骤⑥加入乙醇洗涤的目的是
(5)氯化亚铜的定量分析:
①称取样品0.250g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解;
②用0.100mol·L-1硫酸铈[Ce(SO4)2]标准溶液测定。已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。
三次平衡实验结果如下表(平衡实验结果相差不能超过1%):
| 平衡实验次数 | 1 | 2 | 3 |
| 0.250g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为



