1 . “水煤气(CO和 )”是化学工业常用的原料气,请回答:
)”是化学工业常用的原料气,请回答:
I.已知:焦炭、CO的标准燃烧热分别为 、
、 ,氢气燃烧的热化学反应方程式:
,氢气燃烧的热化学反应方程式: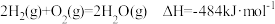
(1)试写出由焦炭和水蒸气生成水煤气的热化学反应方程式:___________
(2)下列说法正确的是___________
II.合成氨工厂以“水煤气”为原料,采用两段间接换热式绝热反应器(反应器中的催化剂对原料气的吸附时间长短,对原料气的转化率会造成一定影响)在常压下进行转换合成氨,装置如图。
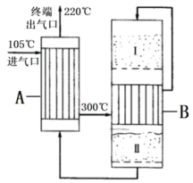
A反应器中主要发生的反应为: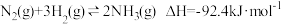
B反应器中主要发生的反应为:
主反应: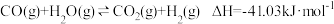
副反应:
由进气口充入一定量含CO、 、
、 、
、 的混合气体,在B中充分反应,在T℃下,反应达到平衡后,测得混合气体各组分的物质的量分别为CO0.2mol、
的混合气体,在B中充分反应,在T℃下,反应达到平衡后,测得混合气体各组分的物质的量分别为CO0.2mol、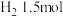 、
、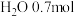 、
、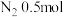 、
、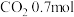 和
和 。
。
已知标准平衡常数: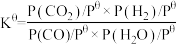 ,其中
,其中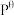 表示标准压强(
表示标准压强( )
)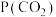 、
、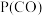 、
、 、
、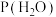 表示各组分的分压,如
表示各组分的分压,如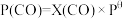 ,
, 为体系中CO的物质的量分数
为体系中CO的物质的量分数
(3)T℃时,主反应的压强平衡常数
___________
(4)平衡时CO的转化率为___________
(5)进气空速对反应产品的收率有一定的影响,实验测得在不同进气空速下,测得平衡时 的收率如下图所示
的收率如下图所示
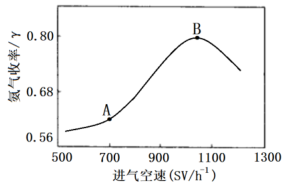
①曲线中A点到B点变化的原因是:___________
②若将绝热转换反应器改为恒温转换反应器,试在图中画出随进气空速变化的 收率曲线
收率曲线___ 。
 )”是化学工业常用的原料气,请回答:
)”是化学工业常用的原料气,请回答:I.已知:焦炭、CO的标准燃烧热分别为
 、
、 ,氢气燃烧的热化学反应方程式:
,氢气燃烧的热化学反应方程式: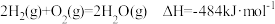
(1)试写出由焦炭和水蒸气生成水煤气的热化学反应方程式:
(2)下列说法正确的是___________
| A.将煤炭在空气中直接加强热进行干馏,制备生成水煤气的原料焦炭 |
| B.水煤气可经过催化合成获得液体燃料、碳氢化合物和含氧有机物 |
| C.水煤气也可采用高温下煤和水蒸气直接作用制得 |
| D.在恒压反应釜中,利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成 |
II.合成氨工厂以“水煤气”为原料,采用两段间接换热式绝热反应器(反应器中的催化剂对原料气的吸附时间长短,对原料气的转化率会造成一定影响)在常压下进行转换合成氨,装置如图。

A反应器中主要发生的反应为:
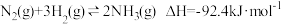
B反应器中主要发生的反应为:
主反应:
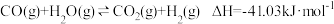
副反应:

由进气口充入一定量含CO、
 、
、 、
、 的混合气体,在B中充分反应,在T℃下,反应达到平衡后,测得混合气体各组分的物质的量分别为CO0.2mol、
的混合气体,在B中充分反应,在T℃下,反应达到平衡后,测得混合气体各组分的物质的量分别为CO0.2mol、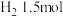 、
、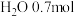 、
、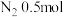 、
、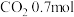 和
和 。
。已知标准平衡常数:
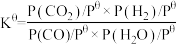 ,其中
,其中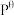 表示标准压强(
表示标准压强( )
)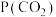 、
、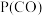 、
、 、
、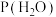 表示各组分的分压,如
表示各组分的分压,如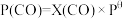 ,
, 为体系中CO的物质的量分数
为体系中CO的物质的量分数(3)T℃时,主反应的压强平衡常数

(4)平衡时CO的转化率为
(5)进气空速对反应产品的收率有一定的影响,实验测得在不同进气空速下,测得平衡时
 的收率如下图所示
的收率如下图所示
①曲线中A点到B点变化的原因是:
②若将绝热转换反应器改为恒温转换反应器,试在图中画出随进气空速变化的
 收率曲线
收率曲线
您最近一年使用:0次
2021-10-20更新
|
637次组卷
|
3卷引用:2021年海南高考化学试题变式题11-19
名校
解题方法
2 . Ⅰ.铁及铁的氧化物广泛应于生产、生活、航天、科研领域。
(1)铁的氧化物循环分解水制H2
已知:H2O(l)=H2(g)+1/2 O2(g) ΔH1=a kJ•mol-1
6FeO(s)+O2(g)=2Fe3O4(s) ΔH2=b kJ•mol-1
则:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH3=_______
(2)Fe2O3与CH4反应可制备“纳米级”金属铁。已知,恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+Fe2O3(s)⇌2Fe(s)+6H2(g)+3CO(g)
①此反应的化学平衡常数表达式为_______
②下列条件能判断该反应达到平衡状态的是_______
a.消耗1molFe2O3的同时,消耗3molCO
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2)
Ⅱ.用CH4还原NO2的反应为CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),向两个容积均为2L温度分别为T1、T2的恒温恒容密闭容器中分别加入1mol CH4和2mol NO2,测得各容器中n(NO2)随反应时间t的变化如图所示:
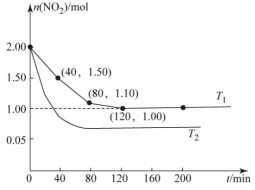
①T1_______ T2(填“>”或“<”)。
②T1时,40~80 min内,用N2的浓度变化表示的平均反应速率为v(N2)=_______
③T1下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡_______ 移动(填“正向”“逆向”或“不”)。
Ⅲ.CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使其转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO =CaCO3+SO
=CaCO3+SO ,室温下,该反应的化学平衡常数为
,室温下,该反应的化学平衡常数为_______ (室温下,Ksp(CaCO3)=3×10-9,Ksp(CaSO4)=9×10-6)。
(1)铁的氧化物循环分解水制H2
已知:H2O(l)=H2(g)+1/2 O2(g) ΔH1=a kJ•mol-1
6FeO(s)+O2(g)=2Fe3O4(s) ΔH2=b kJ•mol-1
则:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH3=
(2)Fe2O3与CH4反应可制备“纳米级”金属铁。已知,恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+Fe2O3(s)⇌2Fe(s)+6H2(g)+3CO(g)
①此反应的化学平衡常数表达式为
②下列条件能判断该反应达到平衡状态的是
a.消耗1molFe2O3的同时,消耗3molCO
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2)
Ⅱ.用CH4还原NO2的反应为CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),向两个容积均为2L温度分别为T1、T2的恒温恒容密闭容器中分别加入1mol CH4和2mol NO2,测得各容器中n(NO2)随反应时间t的变化如图所示:

①T1
②T1时,40~80 min内,用N2的浓度变化表示的平均反应速率为v(N2)=
③T1下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡
Ⅲ.CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使其转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO
 =CaCO3+SO
=CaCO3+SO ,室温下,该反应的化学平衡常数为
,室温下,该反应的化学平衡常数为
您最近一年使用:0次
2021-06-27更新
|
1003次组卷
|
8卷引用:2021年海南高考化学试题变式题11-19
2021年海南高考化学试题变式题11-19四川省广安市2019-2020学年高二下学期期末(零诊)化学试题(已下线)理综化学-2021年秋季高三开学摸底考试卷01(课标全国专用)(已下线)备战2022年高考化学精准检测卷【全国卷】08广东省湛江市第二十一中学2021—2022学年高三上学期11月月考化学试题四川省资中县球溪高级中学2022-2023学年高三上学期10月月考化学试题湖北省天门外国语学校2022-2023学年高二上学期12月月考化学试题四川省内江市威远中学校2022-2023学年高二下学期第二次阶段性考试理综化学试题



