解题方法
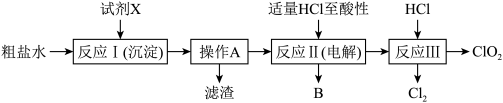
1 . 二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)粗食盐水中含有Ca2+、Mg2+、SO 等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是
等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__________ (填化学式),充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO ,其原因是
,其原因是__________________ 。
(已知:Ksp(BaSO4)=1.1×10-10 ;Ksp(BaCO3)=5.1×10-9)
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是________ ;电解时阳极反应式为_________________ 。反应Ⅲ的化学方程式为___________________ 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O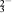 =2I-+S4O
=2I-+S4O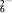 )
)
①准确量取10.00 mL ClO2溶液的玻璃仪器是_______________ 。
②上述步骤3中滴定终点的现象是______________ 。
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果________________ (填“偏高”、“偏低”或“无影响”)
④根据上述步骤可计算出原ClO2溶液的浓度为________ mol·L-1(用含字母的代数式表示)。
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为___ 。(计算结果保留两位小数)
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)粗食盐水中含有Ca2+、Mg2+、SO
 等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是
等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是 ,其原因是
,其原因是(已知:Ksp(BaSO4)=1.1×10-10 ;Ksp(BaCO3)=5.1×10-9)
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O
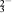 =2I-+S4O
=2I-+S4O )
)①准确量取10.00 mL ClO2溶液的玻璃仪器是
②上述步骤3中滴定终点的现象是
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果
④根据上述步骤可计算出原ClO2溶液的浓度为
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为
您最近一年使用:0次
解题方法
2 . 硼(B)及其化合物在化学工业中有诸多用途。请回答下列问题:
(1)硼氢化钠(NaBH4)是硼的重要化合物。
①NaBH4中B元素的化合价为___ 。
 工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为
工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为___ 。NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为___ 。
(2)工业上以铁硼矿(主要成分为Mg2B2O5·H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备单质B的工艺流程如图所示:
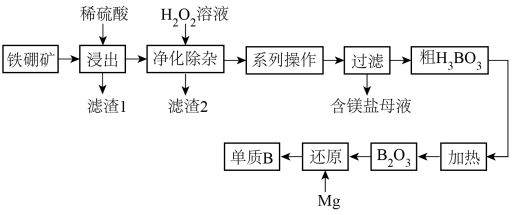
已知:
 “浸出”时,将铁硼矿石粉碎的目的为
“浸出”时,将铁硼矿石粉碎的目的为___ 。
 滤渣1的主要成分为
滤渣1的主要成分为___ 。
 “净化除杂”时需先加H2O2溶液,其目的为
“净化除杂”时需先加H2O2溶液,其目的为___ ,然后再调节溶液的pH≈5.0的目的是___ 。
 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用___ (填“酸式”或“碱式”)滴定管,该粗硼样品的纯度为___ 。
(1)硼氢化钠(NaBH4)是硼的重要化合物。
①NaBH4中B元素的化合价为
 工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为
工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为(2)工业上以铁硼矿(主要成分为Mg2B2O5·H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备单质B的工艺流程如图所示:

已知:
| 金属离子 | Fe3+ | Al3+ |
| 开始沉淀的PH | 2.7 | 3.1 |
| 沉淀完全的PH | 3.7 | 4.9 |
 “浸出”时,将铁硼矿石粉碎的目的为
“浸出”时,将铁硼矿石粉碎的目的为 滤渣1的主要成分为
滤渣1的主要成分为 “净化除杂”时需先加H2O2溶液,其目的为
“净化除杂”时需先加H2O2溶液,其目的为 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用
您最近一年使用:0次



