1 . 钒在生物医学、机械、催化等领域具有广泛的应用。多钒酸盐阴离子具有生物活性。溶液中五价钒的存在形体与溶液酸度和浓度有关,在弱酸性溶液中易形成多钒酸根阴离子,如十钒酸根V10O 、HV10O
、HV10O 和H2V10O
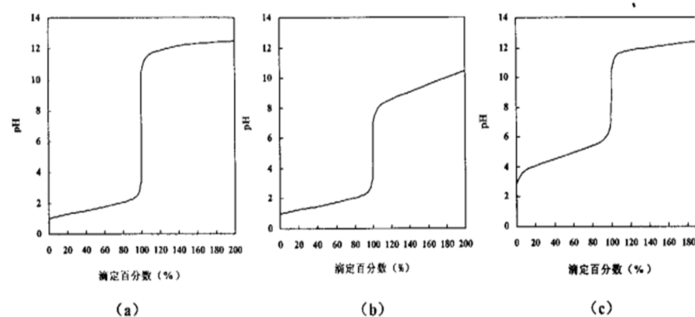
和H2V10O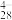 等。将NH4VO3溶于弱酸性介质中,加入乙醇可以得到橙色的十钒酸铵晶体(NH4)xH6-xV10O28·nH2O(用A表示)。元素分析结果表明,A中氢的质量分数为3.13%。用下述实验对该化合物进行分析,以确定其组成。
等。将NH4VO3溶于弱酸性介质中,加入乙醇可以得到橙色的十钒酸铵晶体(NH4)xH6-xV10O28·nH2O(用A表示)。元素分析结果表明,A中氢的质量分数为3.13%。用下述实验对该化合物进行分析,以确定其组成。
实验1:准确称取0.9291gA于三颈瓶中,加入100mL蒸馏水和150mL20%NaOH溶液,加热煮沸,生成的氨气用50.00mL0.1000mol·L-1HCl标准溶液吸收。加入酸碱指示剂,用0.1000mol·L-1NaOH标准溶液滴定剩余的HCl标准溶液,终点时消耗19.88mLNaOH标准溶液。
实验2:准确称取0.3097gA于锥形瓶中,加入40mL1.5mol·L-1H2SO4,微热使之溶解。加入50mL蒸馏水和1gNaHSO3,搅拌5分钟,便反应完全,五价钒被还原成四价。加热煮沸15分钟,然后用0.02005mol·L-1KMnO4标准溶液滴定,终点时消耗25.10mLKMnO4标准溶液。
(1)如图为滴定曲线图,请回答哪一个图为实验1的滴定曲线_______ ;请根据此滴定曲线选择一种最佳酸碱指示剂,并简述做出选择的理由_______ 。有关指示剂的变色范围如下:甲基橙(pH3.1~4.4),溴甲酚绿(pH3.8~5.4),酚酞(pH8.0~10.0)。
(2)在实验2中,加NaHSO3还原V10O ,反应完全后需要加热煮沸15分钟。煮沸的目的是
,反应完全后需要加热煮沸15分钟。煮沸的目的是_______ ?写出KMnO4滴定反应的离子方程式_______ 。
(3)根据实验结果,计算试样A中NH 和V10O
和V10O 的质量分数,确定A的化学式
的质量分数,确定A的化学式_______ (x和n取整数)。
 、HV10O
、HV10O 和H2V10O
和H2V10O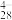 等。将NH4VO3溶于弱酸性介质中,加入乙醇可以得到橙色的十钒酸铵晶体(NH4)xH6-xV10O28·nH2O(用A表示)。元素分析结果表明,A中氢的质量分数为3.13%。用下述实验对该化合物进行分析,以确定其组成。
等。将NH4VO3溶于弱酸性介质中,加入乙醇可以得到橙色的十钒酸铵晶体(NH4)xH6-xV10O28·nH2O(用A表示)。元素分析结果表明,A中氢的质量分数为3.13%。用下述实验对该化合物进行分析,以确定其组成。实验1:准确称取0.9291gA于三颈瓶中,加入100mL蒸馏水和150mL20%NaOH溶液,加热煮沸,生成的氨气用50.00mL0.1000mol·L-1HCl标准溶液吸收。加入酸碱指示剂,用0.1000mol·L-1NaOH标准溶液滴定剩余的HCl标准溶液,终点时消耗19.88mLNaOH标准溶液。
实验2:准确称取0.3097gA于锥形瓶中,加入40mL1.5mol·L-1H2SO4,微热使之溶解。加入50mL蒸馏水和1gNaHSO3,搅拌5分钟,便反应完全,五价钒被还原成四价。加热煮沸15分钟,然后用0.02005mol·L-1KMnO4标准溶液滴定,终点时消耗25.10mLKMnO4标准溶液。
(1)如图为滴定曲线图,请回答哪一个图为实验1的滴定曲线

(2)在实验2中,加NaHSO3还原V10O
 ,反应完全后需要加热煮沸15分钟。煮沸的目的是
,反应完全后需要加热煮沸15分钟。煮沸的目的是(3)根据实验结果,计算试样A中NH
 和V10O
和V10O 的质量分数,确定A的化学式
的质量分数,确定A的化学式
您最近一年使用:0次
解题方法
2 . 甲烷-CO2重整反应可以得到用途广泛的合成气,已知方程式如下。回答下列问题:
CH4(g)+CO2(g)=2H2(g)+2CO(g) ΔH>0
(1)相关物质的燃烧热数据如下表所示:
① ΔH=___________ kJ·mol-1
② 用Ni基双金属催化,反应的活化能降低,ΔH___________ (填“变大”、“变小”或者“不变”)
(2)控制其它条件不变,改变温度对合成气中甲烷质量分数的影响如图。

若充入a molCH4,经过2小时后达到如右图A点,2小时内用CH4表示的平均反应速率为___________ mol/h(用a表示);假设A为平衡态,此时压强为2MPa,平衡常数Kp=___________ (用平衡分压代替平衡浓度,分压=总压x物质的量分数,保留2位小数)。
(3)甲烷的重整反应速率可以表示为η=k·p(CH4) [p(CH4)是指甲烷的分压],其中k为速率常数。下列说法正确的是___________ 。
a.增加甲烷的浓度,η增大 b.增加CO2浓度,η增大
c.及时分离合成气,η增大 d.通过升高温度,提升k
(4)已知在高温的条件下,会发生如下副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.0 kJ·mol-1,且温度越高副反应的转化率越高,化学上称之为“温度的选择性”。不同n(CO2)/n(CH4)配比随温度变化对平衡时n(H2)/n(CO)配比的影响如图所示。

按n(CO2)/n(CH4)=2.5的配比进料,随温度升高,合成气n(H2)/n(CO)配比“先增加后减小”。增加是因为高温有利甲烷分解的积碳反应,请解释“减小”的可能原因___________ 。
(5)一定温度下反应会出现积碳现象而降低催化剂活性。如图是Ni基双金属催化剂抗积碳的示意图。

结合图示:
①写出一个可能的积碳反应方程式___________ 。
② 金属钴能有效消碳的原因是___________ 。
CH4(g)+CO2(g)=2H2(g)+2CO(g) ΔH>0
(1)相关物质的燃烧热数据如下表所示:
| 物质 | CH4(g) | CO(g) | H2(g) |
| 燃烧热(kJ·mol-1) | 890.3 | 283.0 | 285.8 |
② 用Ni基双金属催化,反应的活化能降低,ΔH
(2)控制其它条件不变,改变温度对合成气中甲烷质量分数的影响如图。

若充入a molCH4,经过2小时后达到如右图A点,2小时内用CH4表示的平均反应速率为
(3)甲烷的重整反应速率可以表示为η=k·p(CH4) [p(CH4)是指甲烷的分压],其中k为速率常数。下列说法正确的是
a.增加甲烷的浓度,η增大 b.增加CO2浓度,η增大
c.及时分离合成气,η增大 d.通过升高温度,提升k
(4)已知在高温的条件下,会发生如下副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.0 kJ·mol-1,且温度越高副反应的转化率越高,化学上称之为“温度的选择性”。不同n(CO2)/n(CH4)配比随温度变化对平衡时n(H2)/n(CO)配比的影响如图所示。

按n(CO2)/n(CH4)=2.5的配比进料,随温度升高,合成气n(H2)/n(CO)配比“先增加后减小”。增加是因为高温有利甲烷分解的积碳反应,请解释“减小”的可能原因
(5)一定温度下反应会出现积碳现象而降低催化剂活性。如图是Ni基双金属催化剂抗积碳的示意图。

结合图示:
①写出一个可能的积碳反应方程式
② 金属钴能有效消碳的原因是
您最近一年使用:0次
解题方法
3 . 氮的循环在自然界元素的循环中具有重要的意义,但减少含氮化合物对空气的污染也是重要的课题之一。
已知:N2(g)+O2(g)⇌2NO(g) ΔH1=+180.0kJ·mol-1
N2(g)+3H2(g)⇌2NH3(g) ΔH2=-92.4kJ·mol-1
H2的燃烧热为285.8kJ·mol-1。
回答下列问题:
(1)写出NO与NH3反应生成N2和液态水的热化学方程式_______ 。
(2)研究者用负载Cu的ZSM-5分子筛作催化剂对NO催化分解,M表示催化剂表面活性中心,对该反应提出如下反应机理。分解产生的O2浓度增大易占据催化剂活性中心M。
I:NO+M→NO-M 快;
II:2NO-M→N2+2O-M 慢;
III:20-M⇌O2+2M 快。
三个反应中,活化能较高的是_______ (填“I”、“II”或“III”);反应要及时分离出O2其目的是_______ 。
(3)一密闭容器中,加入1molN2、3molH2发生反应:N2(g)+3H2(g)⇌2NH3(g),t0时达到平衡,在t1、t3、t4时均只改变某一个条件,如图是某一时间段中反应速率与反应进程的曲线关系图。

①t1、t3时改变的条件分别是_______ 、_______ 。
②下列时间段中,氨的百分含量最低的是_______ (填标号)。
a.t0~t1 b.t2~t3 c.t3~t4 d.t5-t6
③在恒温密闭容器中,进料浓度比c(H2):c(N2)分别等于3:2、3:1、7:2时N2平衡转化率随体系压强的变化如下图所示:

表示进料浓度比c(H2):c(N2)=7:2的对应曲线是_______ (填标号),设R点c(NH3)=xmol/L,则化学平衡常数K=_______ (列出计算式)。
已知:N2(g)+O2(g)⇌2NO(g) ΔH1=+180.0kJ·mol-1
N2(g)+3H2(g)⇌2NH3(g) ΔH2=-92.4kJ·mol-1
H2的燃烧热为285.8kJ·mol-1。
回答下列问题:
(1)写出NO与NH3反应生成N2和液态水的热化学方程式
(2)研究者用负载Cu的ZSM-5分子筛作催化剂对NO催化分解,M表示催化剂表面活性中心,对该反应提出如下反应机理。分解产生的O2浓度增大易占据催化剂活性中心M。
I:NO+M→NO-M 快;
II:2NO-M→N2+2O-M 慢;
III:20-M⇌O2+2M 快。
三个反应中,活化能较高的是
(3)一密闭容器中,加入1molN2、3molH2发生反应:N2(g)+3H2(g)⇌2NH3(g),t0时达到平衡,在t1、t3、t4时均只改变某一个条件,如图是某一时间段中反应速率与反应进程的曲线关系图。

①t1、t3时改变的条件分别是
②下列时间段中,氨的百分含量最低的是
a.t0~t1 b.t2~t3 c.t3~t4 d.t5-t6
③在恒温密闭容器中,进料浓度比c(H2):c(N2)分别等于3:2、3:1、7:2时N2平衡转化率随体系压强的变化如下图所示:

表示进料浓度比c(H2):c(N2)=7:2的对应曲线是
您最近一年使用:0次



