名校
解题方法
1 . 天然气、煤炭气(CO、H2)的研究在世界上相当普遍。其中天然气和二氧化碳可合成二甲醚,二甲醚与水蒸气制氢气作为燃料电池的氢能源,比其他制氢技术更有优势.主要反应为:
①CH3OCH3(g)+H2O(g)⇌2CH3OH(g);△H=37kJ•mol-1
②CH3OH(g)+H2O(g)⇌3H2(g)+CO2(g);△H=49kJ•mol-1
③CO2(g)+H2(g)⇌CO(g)+H2O(g);△H=41.3kJ•mol-1
其中反应③是主要的副反应,产生的CO对燃料电池Pt电极有不利影响.
请回答下列问题:
(1)二甲醚可以通过天然气和CO2合成制得,该反应的化学方程式为______________ .
(2)CH3OCH3(g)与水蒸气制氢气的热化学方程式为______________ .
(3)下列采取的措施和解释正确的是______________ (填字母).
A.反应过程在低温进行,可减少CO的产生
B.增加进水量,有利于二甲醚的转化,并减少CO的产生
C.选择在高温具有较高活性的催化剂,有助于提高反应②CH3OH的转化率
D.体系压强升高,虽然对制取氢气不利,但能减少CO的产生
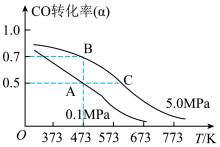
(4)煤炭气在一定条件下可合成燃料电池的另一种重要原料甲醇,反应的化学方程式为CO(g)+2H2(g)⇌CH3OH(g);△H<0.现将10mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度、压强的关系如图所示.
①自反应开始到达平衡状态所需的时间tA________ tB(填“大于”“小于”或“等于”).
②A、C两点的平衡常数KA____ KC(填“大于”“小于”或“等于”).
①CH3OCH3(g)+H2O(g)⇌2CH3OH(g);△H=37kJ•mol-1
②CH3OH(g)+H2O(g)⇌3H2(g)+CO2(g);△H=49kJ•mol-1
③CO2(g)+H2(g)⇌CO(g)+H2O(g);△H=41.3kJ•mol-1
其中反应③是主要的副反应,产生的CO对燃料电池Pt电极有不利影响.
请回答下列问题:
(1)二甲醚可以通过天然气和CO2合成制得,该反应的化学方程式为
(2)CH3OCH3(g)与水蒸气制氢气的热化学方程式为
(3)下列采取的措施和解释正确的是
A.反应过程在低温进行,可减少CO的产生
B.增加进水量,有利于二甲醚的转化,并减少CO的产生
C.选择在高温具有较高活性的催化剂,有助于提高反应②CH3OH的转化率
D.体系压强升高,虽然对制取氢气不利,但能减少CO的产生
(4)煤炭气在一定条件下可合成燃料电池的另一种重要原料甲醇,反应的化学方程式为CO(g)+2H2(g)⇌CH3OH(g);△H<0.现将10mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度、压强的关系如图所示.
①自反应开始到达平衡状态所需的时间tA
②A、C两点的平衡常数KA

您最近一年使用:0次
名校
解题方法
2 . 研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为___________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同温度条件下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
测得CH3OH的物质的量随时间变化如图所示,回答问题:
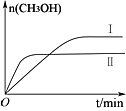
①该反应的平衡常数表达式K=_______________ ;
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为:KⅠ_________ KⅡ(填“>”、“=”或“<”)。
③下列措施中能增大CO2转化率的是____________ 。(填序号)
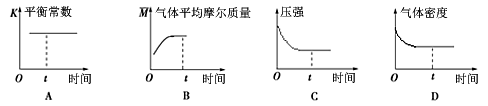
④下列图象正确且能表明在t时刻反应一定处于平衡状态的是__________ 。(填序号)
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同温度条件下反应:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1测得CH3OH的物质的量随时间变化如图所示,回答问题:

①该反应的平衡常数表达式K=
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为:KⅠ
③下列措施中能增大CO2转化率的是
| A.升高温度 | B.充入He(g)使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入一定量CO2 |
④下列图象正确且能表明在t时刻反应一定处于平衡状态的是

您最近一年使用:0次
2016-12-09更新
|
211次组卷
|
2卷引用:山西省忻州市第一中学2019-2020学年高二下学期期中考试化学试题



