1 . 根据所学知识,问答下列问题:
(1)在25℃、101kPa下,已知完全燃烧4.4g丙烷气体,生成 和液态水时,释放222.0kJ热量,
和液态水时,释放222.0kJ热量, 的燃烧热
的燃烧热
___________  。
。
(2)已知: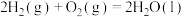
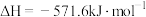 。现有
。现有 和
和 的混合气体共5mol,完全燃烧时释放3847kJ热量,则在混合气体中
的混合气体共5mol,完全燃烧时释放3847kJ热量,则在混合气体中 和
和 的体积比是
的体积比是___________ 。
(3)一个化学过程的示意图如图。已知甲池的总反应为 。
。

①图中甲池是___________ 装置;A(石墨)电极的名称是___________ 。
②写出通入 的电极的电极反应式:
的电极的电极反应式:___________ 。
③乙池中发生反应的化学方程式为___________ 。当乙池中B(Ag)电极的质量增加5.40g时,甲池中理论上消耗___________ mL(标准状况下) 。
。
(1)在25℃、101kPa下,已知完全燃烧4.4g丙烷气体,生成
 和液态水时,释放222.0kJ热量,
和液态水时,释放222.0kJ热量, 的燃烧热
的燃烧热
 。
。(2)已知:
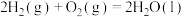
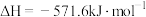 。现有
。现有 和
和 的混合气体共5mol,完全燃烧时释放3847kJ热量,则在混合气体中
的混合气体共5mol,完全燃烧时释放3847kJ热量,则在混合气体中 和
和 的体积比是
的体积比是(3)一个化学过程的示意图如图。已知甲池的总反应为
 。
。
①图中甲池是
②写出通入
 的电极的电极反应式:
的电极的电极反应式:③乙池中发生反应的化学方程式为
 。
。
您最近一年使用:0次
2024-03-06更新
|
53次组卷
|
2卷引用:山西省朔州市怀仁市第九中学高中部2023-2024学年高二上学期11月期中化学试题
2 . 2023年7月28日,第31届世界大学生运动会在四川省成都市盛大开幕。已知:
回答下列问题:
(1)火炬“蓉火"采用了生物质丙烷为燃料。
①写出表示丙烷气体燃烧热的热化学方程式:_______ 。
②生物质丙烷由秸秆、稻壳、玉米芯等废弃物合成而来,与传统来自天然气加工和石油提炼的丙烷相比,其优点是_______ 。
(2)火炬“蓉火”通过优化燃料喷注和空气掺混等方式,减少了燃料的使用量,其原因是_______ 。
(3)我国科学家将甲烷无氧偶联制备乙烷和氢气,根据以上数据,计算该反应2CH4(g)=C2H6(g)+H2(g)的△H=_______ 。
| 物质 | 甲烷CH4 | 乙烷C2H6 | 丙烷C3H8 | H2 |
| 燃烧热△H/(kJ/mol) | -890.3 | -1559.8 | -2219.9 | -285.8 |
(1)火炬“蓉火"采用了生物质丙烷为燃料。
①写出表示丙烷气体燃烧热的热化学方程式:
②生物质丙烷由秸秆、稻壳、玉米芯等废弃物合成而来,与传统来自天然气加工和石油提炼的丙烷相比,其优点是
(2)火炬“蓉火”通过优化燃料喷注和空气掺混等方式,减少了燃料的使用量,其原因是
(3)我国科学家将甲烷无氧偶联制备乙烷和氢气,根据以上数据,计算该反应2CH4(g)=C2H6(g)+H2(g)的△H=
您最近一年使用:0次
解题方法
3 . 随着化石能源的减少,新能源的开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
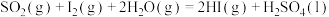
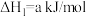
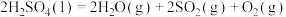
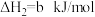
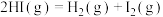
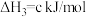
则: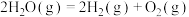

___________ kJ/mol。
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为
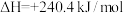 ,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程
,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程___________ (填“吸收”或“放出”)的热量是___________ kJ。
(3)甲醇是一种新型的汽车动力燃料。
①以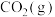 和
和 为原料合成甲醇,反应的能量变化如下图所示,则图中A处应填写的内容为
为原料合成甲醇,反应的能量变化如下图所示,则图中A处应填写的内容为___________ 。

②工业上利用CO和 来制备甲醇气体。已知某些化学键的键能数据如下表:
来制备甲醇气体。已知某些化学键的键能数据如下表:
设CO以 键构成,则工业制备甲醇的热化学方程式为
键构成,则工业制备甲醇的热化学方程式为___________ 。
(4)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示:
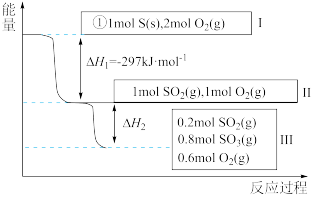
已知: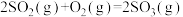

①表示硫的燃烧热的热化学方程式为___________ 。
②图中
___________ kJ/mol。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
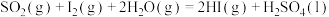
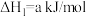
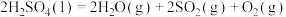
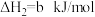
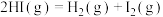
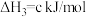
则:
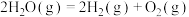

(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为

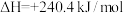 ,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程
,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程(3)甲醇是一种新型的汽车动力燃料。
①以
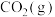 和
和 为原料合成甲醇,反应的能量变化如下图所示,则图中A处应填写的内容为
为原料合成甲醇,反应的能量变化如下图所示,则图中A处应填写的内容为
②工业上利用CO和
 来制备甲醇气体。已知某些化学键的键能数据如下表:
来制备甲醇气体。已知某些化学键的键能数据如下表:| 化学键 |  |  |  |  |  |  |
键能/ | 348 | 413 | 436 | 358 | 1072 | 463 |
 键构成,则工业制备甲醇的热化学方程式为
键构成,则工业制备甲醇的热化学方程式为(4)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示:

已知:
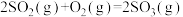

①表示硫的燃烧热的热化学方程式为
②图中

您最近一年使用:0次
2023-11-17更新
|
216次组卷
|
2卷引用:山西省临汾市2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
4 . 在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如图:
。两步反应的能量变化示意图如图:
变化示意图如图:
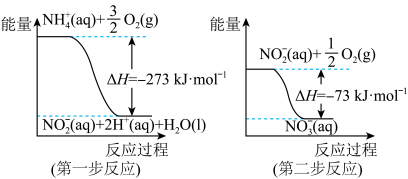
(1)第一步反应是_______ (填“放热”或“吸热”)反应,判断依据是_______ 。
(2)1molNH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是_______ 。
(3)HCl与氧气在催化剂加热条件下可生成氯气和气态水:4HCl+O2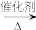 2Cl2+2H2O,已知某些化学键的键能数据如表:
2Cl2+2H2O,已知某些化学键的键能数据如表:
该反应的热化学方程式是_______ 。
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如图:
。两步反应的能量变化示意图如图:变化示意图如图:

(1)第一步反应是
(2)1molNH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是(3)HCl与氧气在催化剂加热条件下可生成氯气和气态水:4HCl+O2
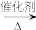 2Cl2+2H2O,已知某些化学键的键能数据如表:
2Cl2+2H2O,已知某些化学键的键能数据如表:| 化学键 | H-Cl | O=O | Cl-Cl | H-O |
| 键能/kJmol | 431 | 498 | 243 | 463 |
该反应的热化学方程式是
您最近一年使用:0次
5 . 尿素 是目前使用量较大的一种化学氮肥。
是目前使用量较大的一种化学氮肥。
I.以 、
、 为原料生产尿素
为原料生产尿素 的反应历程与能量变化示意图如下:
的反应历程与能量变化示意图如下:
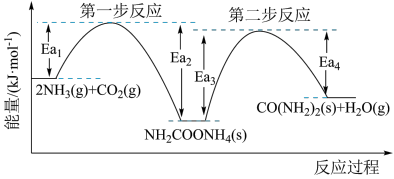
(1)图中的两步反应属于放热反应的
_______  。(用
。(用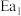 、
、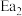 、
、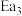 、
、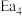 表示,下同)
表示,下同)
(2)根据图像写出以 、
、 为原料生产尿素
为原料生产尿素 的热化学方程式:
的热化学方程式:_______ 。
(3)根据上述反应历程与能量变化示意图,过程_______ (填“第一步反应”或“第二步反应”)为决速步。
II.氨基甲酸铵为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进行探究。
已知:①
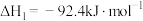
②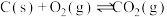
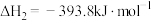
③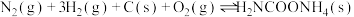
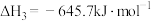
(4)请写出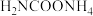 分解生成
分解生成 与
与 气体的热化学方程式:
气体的热化学方程式:_______ 。
 是目前使用量较大的一种化学氮肥。
是目前使用量较大的一种化学氮肥。I.以
 、
、 为原料生产尿素
为原料生产尿素 的反应历程与能量变化示意图如下:
的反应历程与能量变化示意图如下:
(1)图中的两步反应属于放热反应的

 。(用
。(用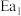 、
、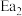 、
、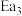 、
、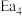 表示,下同)
表示,下同)(2)根据图像写出以
 、
、 为原料生产尿素
为原料生产尿素 的热化学方程式:
的热化学方程式:(3)根据上述反应历程与能量变化示意图,过程
II.氨基甲酸铵为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进行探究。
已知:①

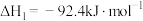
②
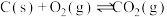
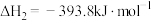
③
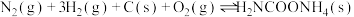
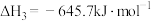
(4)请写出
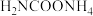 分解生成
分解生成 与
与 气体的热化学方程式:
气体的热化学方程式:
您最近一年使用:0次
6 . 工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。
已知:反应1: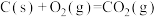

反应2: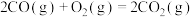
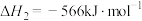
反应3: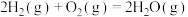
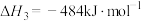
(1)①相同质量的C、CO和 完全燃烧时放出的热量由大到小的顺序为
完全燃烧时放出的热量由大到小的顺序为_______ (用化学式表示)。
②25℃,101kPa时,若断裂1mol O=O,1mol C=O需要吸收的能量分别为495kJ、799kJ,则断裂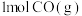 分子中的碳氧键需要吸收的热量为
分子中的碳氧键需要吸收的热量为_______ kJ。
(2)水煤气反应: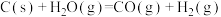
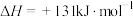 。
。
①工业生产水煤气时,通常交替通入 适量的空气和水蒸气与煤炭反应,其理由是_______ 。
②将煤先转化为水煤气再完全燃烧整个过程的热效应与煤直接完全燃烧的热效应_______ (填“相等”或“不相等”)。
(3)一氧化碳变换反应: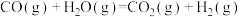
 。以固体催化剂M催化变换反应,反应历程分两步完成,能量-反应过程如图所示。
。以固体催化剂M催化变换反应,反应历程分两步完成,能量-反应过程如图所示。
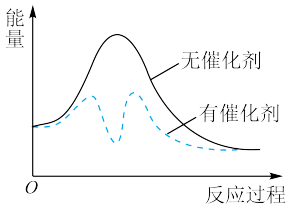
①
_______  。
。
②用两个化学方程式表示该反应历程:
步骤I: 步骤II:
步骤II:_______ 。
③从图中可以看出加入催化剂能够加快反应速率的原因是_______ 。
已知:反应1:
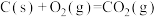

反应2:
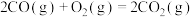
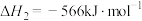
反应3:
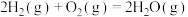
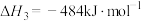
(1)①相同质量的C、CO和
 完全燃烧时放出的热量由大到小的顺序为
完全燃烧时放出的热量由大到小的顺序为②25℃,101kPa时,若断裂1mol O=O,1mol C=O需要吸收的能量分别为495kJ、799kJ,则断裂
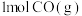 分子中的碳氧键需要吸收的热量为
分子中的碳氧键需要吸收的热量为(2)水煤气反应:
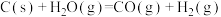
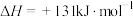 。
。①工业生产水煤气时,通常
②将煤先转化为水煤气再完全燃烧整个过程的热效应与煤直接完全燃烧的热效应
(3)一氧化碳变换反应:
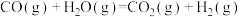
 。以固体催化剂M催化变换反应,反应历程分两步完成,能量-反应过程如图所示。
。以固体催化剂M催化变换反应,反应历程分两步完成,能量-反应过程如图所示。
①

 。
。②用两个化学方程式表示该反应历程:
步骤I:
 步骤II:
步骤II:③从图中可以看出加入催化剂能够加快反应速率的原因是
您最近一年使用:0次
2022-11-16更新
|
126次组卷
|
2卷引用:山西高中教育发展联盟2022-2023学年高二上学期11月份期中检测化学试题
7 . 生物天然气是一种生物质能,它是由秸秆、杂草等废弃物经微生物发酵后产生的,主要成分为 。回答下列问题:
。回答下列问题:
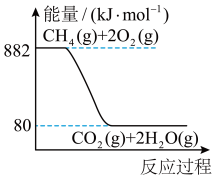
(1)甲烷燃烧时的能量变化如图所示。下列说法正确的是_______ (填字母)。
A.甲烷是一种清洁能源
B.甲烷完全燃烧时,化学能全部转化为热能
C.该反应的热化学方程式为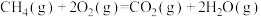
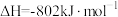
(2)若1mol水蒸气转化为液态水放热44kJ,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ 。
(3)利用 催化还原
催化还原 ,可消除氮氧化物的污染。
,可消除氮氧化物的污染。
已知:①
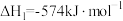
②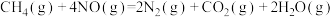

若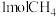 将
将 还原为
还原为 ,整个过程中放出的热量为867kJ,则
,整个过程中放出的热量为867kJ,则
_______ 。
(4)甲烷可用于生产合成气,其反应为
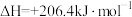 ,已知断裂1mol相关化学键所需的能量如下表:
,已知断裂1mol相关化学键所需的能量如下表:
则a=_______ 。
 。回答下列问题:
。回答下列问题:
(1)甲烷燃烧时的能量变化如图所示。下列说法正确的是
A.甲烷是一种清洁能源
B.甲烷完全燃烧时,化学能全部转化为热能
C.该反应的热化学方程式为
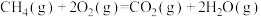
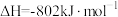
(2)若1mol水蒸气转化为液态水放热44kJ,则表示
 燃烧热的热化学方程式为
燃烧热的热化学方程式为(3)利用
 催化还原
催化还原 ,可消除氮氧化物的污染。
,可消除氮氧化物的污染。已知:①

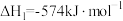
②
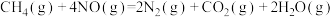

若
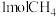 将
将 还原为
还原为 ,整个过程中放出的热量为867kJ,则
,整个过程中放出的热量为867kJ,则
(4)甲烷可用于生产合成气,其反应为

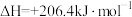 ,已知断裂1mol相关化学键所需的能量如下表:
,已知断裂1mol相关化学键所需的能量如下表:| 化学键 |  |  |  |  |
键能/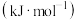 | 436 | 465 | a | 1076 |
您最近一年使用:0次
名校
8 . 参考下列图表和有关要求回答问题:
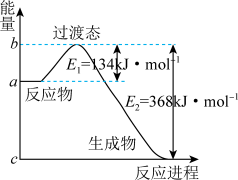
图Ⅰ
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是_______ ,ΔH的变化是_______ (填“增大”、“减小”、“不变”)。请写出NO2和CO反应的热化学方程式:_______ 。
(2)在一定体积的密闭容器中,进行如下化学反应: ,其化学平衡常数K和温度t的关系如表所示:
,其化学平衡常数K和温度t的关系如表所示:
①该反应的化学平衡常数表达式为K=_______ 。
②该反应为反应_______ (填“吸热”或“放热)。
③某温度下,平衡浓度符合下式: ,试判断此时的温度为
,试判断此时的温度为_______ ℃。
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为 ,
, ,
, ,
, ,则下一时刻,反应向
,则下一时刻,反应向_______ (填“正向”、“逆向”或“平衡”)进行。
(3)已知常温时红磷比白磷稳定,比较下列反应中 的大小:
的大小:
_______  (填“>”或“<”)。
(填“>”或“<”)。
①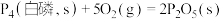

②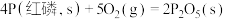


图Ⅰ
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是
(2)在一定体积的密闭容器中,进行如下化学反应:
 ,其化学平衡常数K和温度t的关系如表所示:
,其化学平衡常数K和温度t的关系如表所示:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
②该反应为反应
③某温度下,平衡浓度符合下式:
 ,试判断此时的温度为
,试判断此时的温度为④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为
 ,
, ,
, ,
, ,则下一时刻,反应向
,则下一时刻,反应向(3)已知常温时红磷比白磷稳定,比较下列反应中
 的大小:
的大小:
 (填“>”或“<”)。
(填“>”或“<”)。①
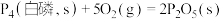

②
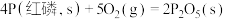

您最近一年使用:0次
2022-11-09更新
|
147次组卷
|
3卷引用:山西省阳泉市第一中学校2023-2024学年高二上学期11月期中考试化学试题
9 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。
(1)CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a)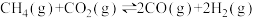

b)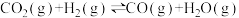

c)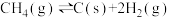

d)

e)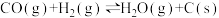
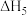
①根据盖斯定律,反应a的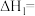
___________ (写出一个代数式即可)。
②一定条件下,CH4分解形成碳的反应历程如图所示。该历程分___________ 步进行,其中,第___________ 步的反应最慢。
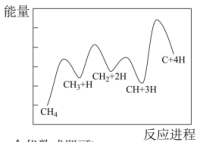
(2)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。反应可表示为: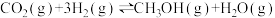 。在起始物
。在起始物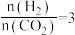 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为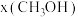 ,在
,在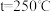 下的
下的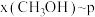 、在
、在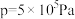 下的
下的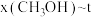 如图所示。
如图所示。
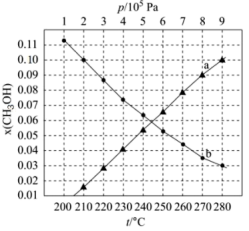
①用各物质的平衡分压[如 的分压可表示为
的分压可表示为 ]表示该反应平衡常数,表达式
]表示该反应平衡常数,表达式
___________ ;
②图中对应等温过程的曲线是___________ ,判断的理由是___________ ;
③当 时,
时, 的平衡转化率
的平衡转化率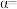
___________ ,反应条件可能为___________ 或___________ 。
(1)CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a)
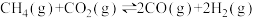

b)
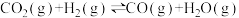

c)
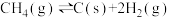

d)


e)
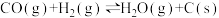
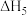
①根据盖斯定律,反应a的
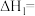
②一定条件下,CH4分解形成碳的反应历程如图所示。该历程分

(2)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。反应可表示为:
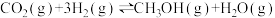 。在起始物
。在起始物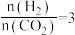 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为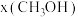 ,在
,在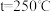 下的
下的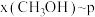 、在
、在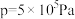 下的
下的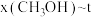 如图所示。
如图所示。
①用各物质的平衡分压[如
 的分压可表示为
的分压可表示为 ]表示该反应平衡常数,表达式
]表示该反应平衡常数,表达式
②图中对应等温过程的曲线是
③当
 时,
时, 的平衡转化率
的平衡转化率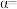
您最近一年使用:0次
10 . 已知:25℃、101kPa时,
Mn(s)+O2(g)=MnO2(s) ∆H=-520kJ/mol
S(s)+O2(g)=SO2(g) ∆H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) ∆H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是___________ 。
Mn(s)+O2(g)=MnO2(s) ∆H=-520kJ/mol
S(s)+O2(g)=SO2(g) ∆H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) ∆H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是
您最近一年使用:0次



