名校
解题方法
1 . 已知氮元素及其化合物的转化关系如下图所示,回答下列问题。_______ 。
(2)反应④的离子方程式为_______ 。理论上如图N2合成1mol硝酸,至少需要氧气共_______ mol。
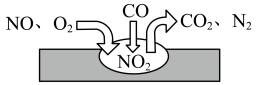
(3)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示,该过程的总反应化学方程式为_______ 。
①根据上图得知_______ (填字母)。
A.NaOH溶液浓度越大,氮氧化物的吸收率越大
B.NO2含量越大,氮氧化物的吸收率越大
②当α小于50%时,加入H2O2能提升氮氧化物的吸收率,原因是_______ 。

(2)反应④的离子方程式为
(3)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示,该过程的总反应化学方程式为

①根据上图得知
A.NaOH溶液浓度越大,氮氧化物的吸收率越大
B.NO2含量越大,氮氧化物的吸收率越大
②当α小于50%时,加入H2O2能提升氮氧化物的吸收率,原因是
您最近一年使用:0次
名校
2 . 工业及汽车尾气已成为城市空气的主要污染源,研究其反应机理对于环境治理有重要意义。
(1)硝酸厂尾气可以回收制备硝酸。已知:
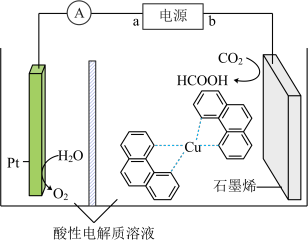
①2NO(g)+O2(g)=2NO2(g) △H1=-113.0 kJ/mol
②3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ/mol
4NO2(g)+O2(g)+2H2O(g)=4HNO3(g) △H=___________ kJ/mol。
(2)液氨催化还原NO是重要的烟气脱硝技术。使用Fe2O3为催化剂,可能的反应过程如图所示。___________ 。
②反应过程图中,虚线方框里的过程可描述为___________ 。
③氨氮比会直接影响该方法的脱硝率。350℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系如图所示。当 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是___________ 。
NO2被Na2CO3溶液吸收生成的三种盐分别是NaNO2、NaNO3和___________ 。(填化学式)
(4)NSR (NOX储存还原)可有效减少氮氧化物排放。工作原理:通过BaO和Ba(NO3)2的相互转化实现NOX的储存和还原,如图所示。___________ 。
(1)硝酸厂尾气可以回收制备硝酸。已知:
①2NO(g)+O2(g)=2NO2(g) △H1=-113.0 kJ/mol
②3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ/mol
4NO2(g)+O2(g)+2H2O(g)=4HNO3(g) △H=
(2)液氨催化还原NO是重要的烟气脱硝技术。使用Fe2O3为催化剂,可能的反应过程如图所示。
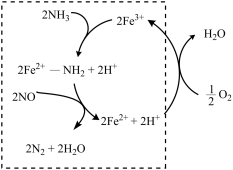
②反应过程图中,虚线方框里的过程可描述为
③氨氮比会直接影响该方法的脱硝率。350℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系如图所示。当
 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是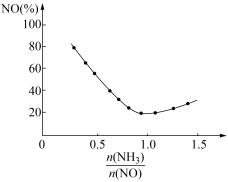
NO2被Na2CO3溶液吸收生成的三种盐分别是NaNO2、NaNO3和
(4)NSR (NOX储存还原)可有效减少氮氧化物排放。工作原理:通过BaO和Ba(NO3)2的相互转化实现NOX的储存和还原,如图所示。
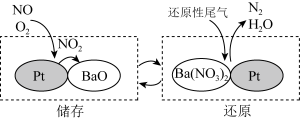
您最近一年使用:0次
3 . 我国要在2030年前实现碳达峰、2060年前实现碳中和的目标,CO2的捕集与转化是研究的重要课题。
(1)CO2和CH4重整可制合成气CO和H2,其热化学反应方程式为CO2(g)+CH4(g)=2CO(g)+2H2(g) ΔH=+247 kJ·mol-1。
已知下列热化学反应方程式:
反应1:C(s)+2H2(g)=CH4(g) ΔH1
反应2:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-40.0 kJ·mol-1
反应3:C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+132.0 kJ·mol-1
则ΔH1=___________ kJ·mol-1。
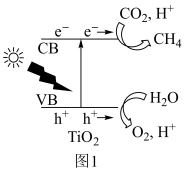
(2)光催化还原法实现CO2甲烷化可能的反应机理如图1所示。该过程可描述为:光照条件下,催化剂TiO2的价带(VB)中的电子激发至导带(CB)中,价带中形成电子空穴(h+),___________ 。
(3)一种电化学法将CO2转化为乙烯的原理如图2所示。
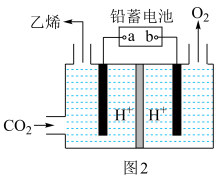
①阴极上的电极反应式为___________ 。
②以铅蓄电池为电源,每生成0.5 mol乙烯,理论上产生O2的物质的量为___________ 。
(1)CO2和CH4重整可制合成气CO和H2,其热化学反应方程式为CO2(g)+CH4(g)=2CO(g)+2H2(g) ΔH=+247 kJ·mol-1。
已知下列热化学反应方程式:
反应1:C(s)+2H2(g)=CH4(g) ΔH1
反应2:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-40.0 kJ·mol-1
反应3:C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+132.0 kJ·mol-1
则ΔH1=
(2)光催化还原法实现CO2甲烷化可能的反应机理如图1所示。该过程可描述为:光照条件下,催化剂TiO2的价带(VB)中的电子激发至导带(CB)中,价带中形成电子空穴(h+),

(3)一种电化学法将CO2转化为乙烯的原理如图2所示。

①阴极上的电极反应式为
②以铅蓄电池为电源,每生成0.5 mol乙烯,理论上产生O2的物质的量为
您最近一年使用:0次
4 . NOx、CO是重要污染物,处理NOx、CO等污染物对建设美丽中国具有重要意义。回答下列问题。
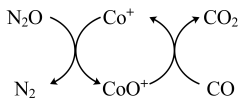
(1)已知CO(g)还原 的反应机理如图所示
的反应机理如图所示
已知:


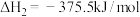
CO(g)与 反应的热化学方程式为
反应的热化学方程式为___________ 。
(2)温度T℃,在恒容密闭容器中充入1:1的NO(g)和CO(g),测得此时压强为 ,发生反应
,发生反应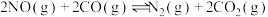 ,达到平衡时NO(g)和
,达到平衡时NO(g)和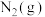 的物质的量之比为1:1,则平衡时CO的转化率为
的物质的量之比为1:1,则平衡时CO的转化率为___________ (结果保留一位小数),该反应的化学平衡常数Kp=___________ 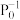 (
( 表示以分压表示的平衡常数,
表示以分压表示的平衡常数,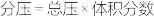 )。若T℃时,向某容器中同时充入NO、CO、
)。若T℃时,向某容器中同时充入NO、CO、 、
、 各1mol,则
各1mol,则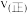
___________ 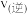 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(3)对于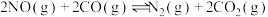 ,反应的活化能Ea,速率常数k满足Arrhenius公式
,反应的活化能Ea,速率常数k满足Arrhenius公式 ,其中R、C为常数,且
,其中R、C为常数,且 ,T为温度。上述反应的实验数据如图所示
,T为温度。上述反应的实验数据如图所示
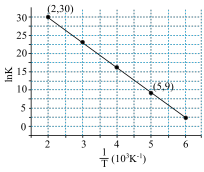
则该反应的活化能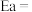
___________  。
。
(4)电解法转化 是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
①a为电源的___________ (填“正极”或“负极”),该装置的阴极的电极反应式为___________ 。
②若电解开始前两极室溶液质量相等,当电解过程转移了2mol电子,则阴阳极室溶液质量差为___________ g。

(1)已知CO(g)还原
 的反应机理如图所示
的反应机理如图所示已知:



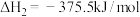
CO(g)与
 反应的热化学方程式为
反应的热化学方程式为(2)温度T℃,在恒容密闭容器中充入1:1的NO(g)和CO(g),测得此时压强为
 ,发生反应
,发生反应 ,达到平衡时NO(g)和
,达到平衡时NO(g)和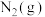 的物质的量之比为1:1,则平衡时CO的转化率为
的物质的量之比为1:1,则平衡时CO的转化率为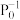 (
( 表示以分压表示的平衡常数,
表示以分压表示的平衡常数,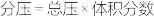 )。若T℃时,向某容器中同时充入NO、CO、
)。若T℃时,向某容器中同时充入NO、CO、 、
、 各1mol,则
各1mol,则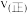
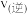 (填“>”“<”或“=”)
(填“>”“<”或“=”)(3)对于
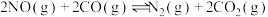 ,反应的活化能Ea,速率常数k满足Arrhenius公式
,反应的活化能Ea,速率常数k满足Arrhenius公式 ,其中R、C为常数,且
,其中R、C为常数,且 ,T为温度。上述反应的实验数据如图所示
,T为温度。上述反应的实验数据如图所示
则该反应的活化能
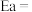
 。
。(4)电解法转化
 是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
①a为电源的
②若电解开始前两极室溶液质量相等,当电解过程转移了2mol电子,则阴阳极室溶液质量差为
您最近一年使用:0次
2023-08-15更新
|
500次组卷
|
2卷引用:江苏省淮安市高中校协作体2023-2024学年高三上学期期中联考化学试题
名校
5 . 填空
(1)已知下列热化学方程式:
①H2O(1)=H2(g)+ O2(g) △H1=285.8 kJ∙mol−1
O2(g) △H1=285.8 kJ∙mol−1
②C(s)+ O2(g)=CO(g) △H2=−110.5 kJ∙mol−1
O2(g)=CO(g) △H2=−110.5 kJ∙mol−1
③H2O(g)=H2(g)+ O2(g) △H3=241.8 kJ∙mol−1
O2(g) △H3=241.8 kJ∙mol−1
上述反应中属于放热反应的是_____ 。
(2)①的反应过程是太阳光催化分解水制氢气,该反应中主要能量转化形式为_____ 。
a.太阳能转化为化学能 b.化学能转化为电能
(3)若反应③使用催化剂,那么△H3将_____ (填“增大”“减小”或“不变”)
(4)反应C(s)+H2O(g)=CO(g)+H2(g)的△H=_____ kJ∙mol−1。
(5)0.1mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼(B2O3)和气态水,释放203.3kJ的热。
①写出反应的热化学方程式_____ 。
②H2O(1)=H2O(g) △H=_____ kJ∙mol−1。
③11.2L(标准状况)气态乙硼烷(B2H6)完全燃烧生成液态水生成的热_____ kJ。
(1)已知下列热化学方程式:
①H2O(1)=H2(g)+
 O2(g) △H1=285.8 kJ∙mol−1
O2(g) △H1=285.8 kJ∙mol−1②C(s)+
 O2(g)=CO(g) △H2=−110.5 kJ∙mol−1
O2(g)=CO(g) △H2=−110.5 kJ∙mol−1③H2O(g)=H2(g)+
 O2(g) △H3=241.8 kJ∙mol−1
O2(g) △H3=241.8 kJ∙mol−1上述反应中属于放热反应的是
(2)①的反应过程是太阳光催化分解水制氢气,该反应中主要能量转化形式为
a.太阳能转化为化学能 b.化学能转化为电能
(3)若反应③使用催化剂,那么△H3将
(4)反应C(s)+H2O(g)=CO(g)+H2(g)的△H=
(5)0.1mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼(B2O3)和气态水,释放203.3kJ的热。
①写出反应的热化学方程式
②H2O(1)=H2O(g) △H=
③11.2L(标准状况)气态乙硼烷(B2H6)完全燃烧生成液态水生成的热
您最近一年使用:0次
2023-07-28更新
|
453次组卷
|
2卷引用:江苏省淮安市淮安区2022-2023学年高二上学期期中调研测试化学试题
6 . 烟气中的主要污染物为SO2、NOx,随意排放会导致酸雨等,汽车尾气的氮氧化物是大气污染物的主要来源,研究汽车尾气处理是环境保护的重要课题。试回答下列问题:
(1)有关汽车尾气的生成
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180.50kJ•mol-1
②2NO(g)+O2(g)=2NO2(g) ΔH2=-144.14kJ•mol-1
③2N2O(g)⇌2N2(g)+O2(g) ΔH3=-244.10kJ•mol-1
则N2(g)+2NO(g)=2N2O(g) ΔH=___________ 。
(2)NOx的排放主要来自于汽车尾气,可采用NSR(NOx储存还原)进行处理,NOx的储存和还原在不同时段交替进行,如图所示。
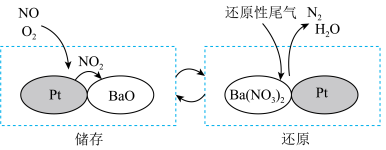
NOx储存转化为Ba(NO3)2过程中,参加反应的NO和O2的物质的量之比为___________ 。
(3)NaOH溶液可用于吸收工业尾气(含NO、NO2),获得副产品NaNO2.等物质的量的NO与NO2被NaOH溶液吸收,反应的离子方程式为___________ 。
(4)用NH3消除汽车尾气
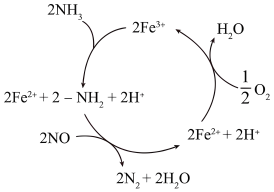
I.研究发现NH3脱硝的过程如图所示。写出脱硝过程的总反应化学方程式___________ 。
II.新型催化剂b在含有少量O2条件下,能催化NH3和NOx,反应生成N2,且高温下活性很强。在盛有催化剂b的管式反应容器[图甲]中按一定比例匀速通入NH3、NOx、O2发生反应。NOx的除去率随反应温度变化曲线如图乙所示。
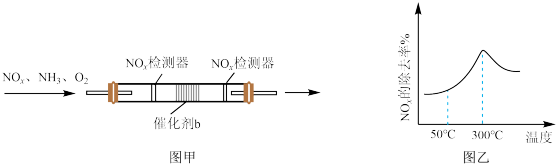
①在50℃之前,NOx的除去率随温度升高而缓慢上升的原因是___________ 。
②当温度高于300℃时,NOx除去率迅速下降的原因是___________ 。
(5)烟气中的NO、SO2可通过电解法除去并获得氨水和硫酸,其原理如图所示。
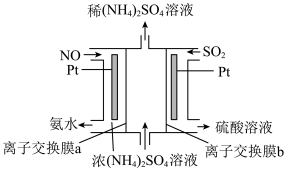
该电解池阴极的电极反应式为_______ ,离子交换膜a是_______ (填“阴”或“阳”)离子交换膜。
(1)有关汽车尾气的生成
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180.50kJ•mol-1
②2NO(g)+O2(g)=2NO2(g) ΔH2=-144.14kJ•mol-1
③2N2O(g)⇌2N2(g)+O2(g) ΔH3=-244.10kJ•mol-1
则N2(g)+2NO(g)=2N2O(g) ΔH=
(2)NOx的排放主要来自于汽车尾气,可采用NSR(NOx储存还原)进行处理,NOx的储存和还原在不同时段交替进行,如图所示。

NOx储存转化为Ba(NO3)2过程中,参加反应的NO和O2的物质的量之比为
(3)NaOH溶液可用于吸收工业尾气(含NO、NO2),获得副产品NaNO2.等物质的量的NO与NO2被NaOH溶液吸收,反应的离子方程式为
(4)用NH3消除汽车尾气
I.研究发现NH3脱硝的过程如图所示。写出脱硝过程的总反应化学方程式

II.新型催化剂b在含有少量O2条件下,能催化NH3和NOx,反应生成N2,且高温下活性很强。在盛有催化剂b的管式反应容器[图甲]中按一定比例匀速通入NH3、NOx、O2发生反应。NOx的除去率随反应温度变化曲线如图乙所示。

①在50℃之前,NOx的除去率随温度升高而缓慢上升的原因是
②当温度高于300℃时,NOx除去率迅速下降的原因是
(5)烟气中的NO、SO2可通过电解法除去并获得氨水和硫酸,其原理如图所示。

该电解池阴极的电极反应式为
您最近一年使用:0次
2023-04-27更新
|
172次组卷
|
2卷引用:江苏省扬州市高邮市2022-2023学年高一下学期4月期中考试化学试题
7 . 纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图1、图2。
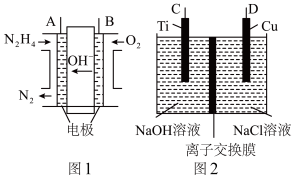
(1)①肼燃料电池中A极发生的电极反应为___________ 。
②上述装置中D电极应连接肼燃料电池的___________ 极(填“A”或“B”),该电解池的阳极反应式为___________ 。
③当反应生成14.4gCu2O时,停止电解,至少需要肼___________ mol,通过离子交换膜的阴离子的物质的量为___________ mol。(离子交换膜只允许OH-通过)
(2)在加热条件下用液态肼(N2H4)还原新制Cu(OH)2也可制备纳米级Cu2O,同时放出N2,该反应的化学方程式为___________ 。
(3)发射火箭时以液态肼(N2H4)为燃料,双氧水作氧化剂,两者反应生成氮气和气态水。已知:①2H2O2(1)=2H2O(l)+O2(g) △H=-196kJmol-1;②H2O(l)=H2O(g) △H=43.98kJmol-1;③肼的燃烧热为-622.08kJmol-1。写出上述反应的热化学方程式___________ 。

(1)①肼燃料电池中A极发生的电极反应为
②上述装置中D电极应连接肼燃料电池的
③当反应生成14.4gCu2O时,停止电解,至少需要肼
(2)在加热条件下用液态肼(N2H4)还原新制Cu(OH)2也可制备纳米级Cu2O,同时放出N2,该反应的化学方程式为
(3)发射火箭时以液态肼(N2H4)为燃料,双氧水作氧化剂,两者反应生成氮气和气态水。已知:①2H2O2(1)=2H2O(l)+O2(g) △H=-196kJmol-1;②H2O(l)=H2O(g) △H=43.98kJmol-1;③肼的燃烧热为-622.08kJmol-1。写出上述反应的热化学方程式
您最近一年使用:0次
2023-04-27更新
|
123次组卷
|
2卷引用:江苏省扬州市高邮市2022-2023学年高一下学期4月期中考试化学试题
解题方法
8 . 空气中有丰富的氮气,科学家展开了向空气要氨气的系列研究。
(1)已知: 2H2(g)+O2(g)=2H2O(l) ΔH=a kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
工业上合成氨反应N2(g)+3H2(g)⇌2NH3(g) ΔH=_______ kJ·mol-1
(2)脱除烟气中的氮氧化物(主要是指NO和NO2)可净化空气、改善环境,是环境保护的主要课题。
①NO2的消除。
可以用碳酸钠溶液来进行吸收,在产生CO2的同时,会生成NaNO2,NaNO2是工业盐的主要成分,在漂白、电镀等方面应用广泛。
a.写出碳酸钠溶液消除NO2的化学方程式:_______ 。
b.经过一系列后续操作可以得到产品NaNO2,但一般会混有一定量_______ 的杂质。
②NO的消除。
HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。 次氯酸盐脱除NO的主要过程如下:a.NO+HClO=NO2+HCl b.NO+NO2+H2O=2HNO2 c.HClO+HNO2=HNO3+HCl
下列分析不正确的是_______ 。
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
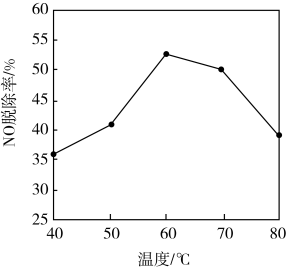
(3)研究不同温度下Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。脱除过程中往往有Cl2产生,原因是_______ (用离子方程式表示);60~80℃NO脱除率下降的原因是_______ 。
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为_______ 。

(1)已知: 2H2(g)+O2(g)=2H2O(l) ΔH=a kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
工业上合成氨反应N2(g)+3H2(g)⇌2NH3(g) ΔH=
(2)脱除烟气中的氮氧化物(主要是指NO和NO2)可净化空气、改善环境,是环境保护的主要课题。
①NO2的消除。
可以用碳酸钠溶液来进行吸收,在产生CO2的同时,会生成NaNO2,NaNO2是工业盐的主要成分,在漂白、电镀等方面应用广泛。
a.写出碳酸钠溶液消除NO2的化学方程式:
b.经过一系列后续操作可以得到产品NaNO2,但一般会混有一定量
②NO的消除。
HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。 次氯酸盐脱除NO的主要过程如下:a.NO+HClO=NO2+HCl b.NO+NO2+H2O=2HNO2 c.HClO+HNO2=HNO3+HCl
下列分析不正确的是
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
(3)研究不同温度下Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。脱除过程中往往有Cl2产生,原因是

(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为

您最近一年使用:0次
2023-03-30更新
|
609次组卷
|
3卷引用:江苏省南京市田家炳高级中学2022-2023学年高一下学期期中考试化学试题
解题方法
9 . 回答下列小题
(1)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意如图:
。两步反应的能量变化示意如图:
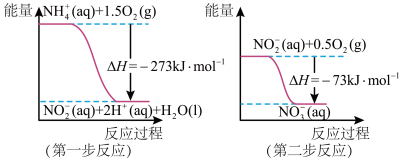
①第一步反应是___________ (填“放热”或“吸热”)反应,判断依据是___________ 。
②1molNH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是___________ 。
(2)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ·mol-1,O=O键能为498kJ·mol-1,计算H—H键能为___________ kJ·mol-1.
(3)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) ΔH2=-64.4kJ·mol-1;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3。
则ΔH3=___________ kJ·mol-1.
(1)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意如图:
。两步反应的能量变化示意如图:
①第一步反应是
②1molNH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是(2)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ·mol-1,O=O键能为498kJ·mol-1,计算H—H键能为
(3)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) ΔH2=-64.4kJ·mol-1;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3。
则ΔH3=
您最近一年使用:0次
名校
10 . 完成下列问题
(1)工厂烟气(主要污染物 、
、 )直接排放会造成空气污染,需处理后才能排放。用
)直接排放会造成空气污染,需处理后才能排放。用 氧化。
氧化。 氧化过程中部分反应的能量变化如图所示。
氧化过程中部分反应的能量变化如图所示。

①已知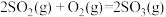
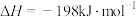 。则
。则 转化为
转化为 的热化学方程式为
的热化学方程式为_______ 。
②其他条件不变时,增加 ,
, 氧化
氧化 的反应几乎不受影响,其可能原因是
的反应几乎不受影响,其可能原因是_______ 。
(2)利用如图1装置可将 转化为
转化为 ,变废为宝,分别在两极通入
,变废为宝,分别在两极通入 和
和 ,溶液中
,溶液中 向
向_______ 极(填“A”或“B”)移动,则该电池总反应方程式为_______ 。

(3)利用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图2所示(均为石墨电极),电解过程中NO转化为硝酸,请写出阳极的电极反应式为_______ ;电解总反应方程式为_______ 。

(1)工厂烟气(主要污染物
 、
、 )直接排放会造成空气污染,需处理后才能排放。用
)直接排放会造成空气污染,需处理后才能排放。用 氧化。
氧化。 氧化过程中部分反应的能量变化如图所示。
氧化过程中部分反应的能量变化如图所示。
①已知
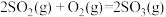
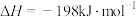 。则
。则 转化为
转化为 的热化学方程式为
的热化学方程式为②其他条件不变时,增加
 ,
, 氧化
氧化 的反应几乎不受影响,其可能原因是
的反应几乎不受影响,其可能原因是(2)利用如图1装置可将
 转化为
转化为 ,变废为宝,分别在两极通入
,变废为宝,分别在两极通入 和
和 ,溶液中
,溶液中 向
向
(3)利用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图2所示(均为石墨电极),电解过程中NO转化为硝酸,请写出阳极的电极反应式为

您最近一年使用:0次



