名校
1 . 完成下列问题
(1)已知:①

②

则

___________ 。
(2)已知:①

②

则表示氨气燃烧热的热化学方程式为___________ ,该反应可设计为碱性条件下的燃料电池,负极电极反应式为___________ 。
(3)已知几种化学键的键能和热化学方程式如下:

 ,则a=
,则a=___________ 。
(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(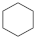 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是___________ ;反应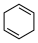 (l)=
(l)=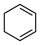 (l)的
(l)的
___________ 。

(1)已知:①


②


则


(2)已知:①


②


则表示氨气燃烧热的热化学方程式为
(3)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能/( ) ) | 391 | 193 | 243 | a | 432 |

 ,则a=
,则a=(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是 (l)=
(l)= (l)的
(l)的

您最近一年使用:0次
解题方法
2 . 肼(N2H4)是一种无色油状液体,沸点113.5℃,具有强还原性。能与NaClO剧烈反应生成N2。
(1)N2H4分子中N的化合价为___________
(2)N2H4与O2的相对分子质量相近,但N2H4的熔点(2℃)、沸点(114℃)分别远高于O2的熔点(-218℃)、沸点(-183℃),原因是___________ 。
(3)由碱性NaClO溶液和尿素 反应可获得
反应可获得 ,反应原理为:
,反应原理为: 。实验中反应物的加料方式为
。实验中反应物的加料方式为___________ (填序号)。
A.将尿素滴加到碱性NaClO溶液中 B.将碱性NaClO溶液滴加到尿素中
(4)发射火箭时,肼为燃料,双氧水为氧化剂,两者反应生成氮气与水蒸气。已知32g液态肼在上述反应中放出64.22kJ的热量,该反应的热化学方程式为___________ 。
(5)肼-空气燃料电池是一种新型环保电池,(用KOH溶液作电解液),该电池负极的电极反应式为___________ 。
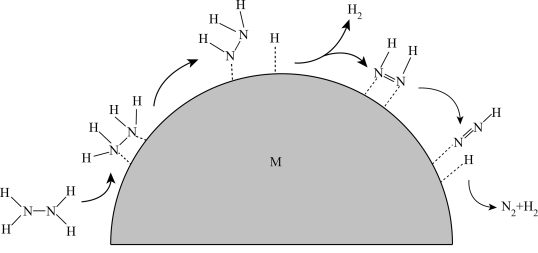
(6)H2是一种理想的绿色清洁能源,N2H4催化分解制氢是能源利用领域的研究热点。在温和条件下,负载型双金属合金M催化N2H4迅速分解,并且制氢选择性可达100%,可能机理如图所示(图中“虚线”表示吸附在催化剂上)。请将N2H4催化分解制氢的机理补充完整:N2H4吸附在(催化剂)M表面,连续断裂___________ 键,形成N2H3、___________ 和N2H等中间产物,直至H原子全部脱去,最终生成___________ 。
(1)N2H4分子中N的化合价为
(2)N2H4与O2的相对分子质量相近,但N2H4的熔点(2℃)、沸点(114℃)分别远高于O2的熔点(-218℃)、沸点(-183℃),原因是
(3)由碱性NaClO溶液和尿素
 反应可获得
反应可获得 ,反应原理为:
,反应原理为: 。实验中反应物的加料方式为
。实验中反应物的加料方式为A.将尿素滴加到碱性NaClO溶液中 B.将碱性NaClO溶液滴加到尿素中
(4)发射火箭时,肼为燃料,双氧水为氧化剂,两者反应生成氮气与水蒸气。已知32g液态肼在上述反应中放出64.22kJ的热量,该反应的热化学方程式为
(5)肼-空气燃料电池是一种新型环保电池,(用KOH溶液作电解液),该电池负极的电极反应式为
(6)H2是一种理想的绿色清洁能源,N2H4催化分解制氢是能源利用领域的研究热点。在温和条件下,负载型双金属合金M催化N2H4迅速分解,并且制氢选择性可达100%,可能机理如图所示(图中“虚线”表示吸附在催化剂上)。请将N2H4催化分解制氢的机理补充完整:N2H4吸附在(催化剂)M表面,连续断裂

您最近一年使用:0次
3 . 有效利用二氧化碳对实现“碳中和”意义重大。
(1)现代工业技术可从空气或工业尾气中捕获 ,可作为
,可作为 捕获剂的有
捕获剂的有_______ 。
a. 溶液 b.氨水 c.
溶液 b.氨水 c. 溶液
溶液
(2)科研人员利用 催化剂,将
催化剂,将 与
与 合成
合成 ,主要反应的热化学方程式如下。
,主要反应的热化学方程式如下。
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
_______ 。
(3)使用惰性电极电解 制取甲醇的反应装置如图所示:电极a接电源
制取甲醇的反应装置如图所示:电极a接电源_______ 极(填“正”或“负”):生成甲醇的电极反应式为_______ 。

(4) 可催化加氢生成
可催化加氢生成 ,其过程为:向
,其过程为:向 溶液中通入
溶液中通入 转化为
转化为 ,一定条件下再通入
,一定条件下再通入 可反应生成
可反应生成 ,进一步生产
,进一步生产 。
。 产率
产率 曲线见图。当温度高于
曲线见图。当温度高于 时,
时, 的产率下降,可能的原因是
的产率下降,可能的原因是_______ 。

(5)中国科学院于2021年首次实现 到淀粉的合成。部分反应历程见图所示,该历程可描述为
到淀粉的合成。部分反应历程见图所示,该历程可描述为_______ 。

(1)现代工业技术可从空气或工业尾气中捕获
 ,可作为
,可作为 捕获剂的有
捕获剂的有a.
 溶液 b.氨水 c.
溶液 b.氨水 c. 溶液
溶液(2)科研人员利用
 催化剂,将
催化剂,将 与
与 合成
合成 ,主要反应的热化学方程式如下。
,主要反应的热化学方程式如下。反应Ⅰ:

反应Ⅱ:

反应Ⅲ:
(3)使用惰性电极电解
 制取甲醇的反应装置如图所示:电极a接电源
制取甲醇的反应装置如图所示:电极a接电源
(4)
 可催化加氢生成
可催化加氢生成 ,其过程为:向
,其过程为:向 溶液中通入
溶液中通入 转化为
转化为 ,一定条件下再通入
,一定条件下再通入 可反应生成
可反应生成 ,进一步生产
,进一步生产 。
。 产率
产率 曲线见图。当温度高于
曲线见图。当温度高于 时,
时, 的产率下降,可能的原因是
的产率下降,可能的原因是
(5)中国科学院于2021年首次实现
 到淀粉的合成。部分反应历程见图所示,该历程可描述为
到淀粉的合成。部分反应历程见图所示,该历程可描述为
您最近一年使用:0次
名校
4 . 2022年6月5日10时44分,搭载神舟十四号载人飞船的长征二号F遥十四运载火箭在酒泉卫星发射中心点火发射,成功将飞船运送到预定轨道。肼(N2H4)是一种良好的火箭推进剂,其与适当的氧化剂(如过氧化氢、氧气等)配合,可组成比冲最高的可贮存液体推进剂。


(1)液态肼和液态过氧化氢混合反应时,即产生大量氮气和水蒸气,并放出大量热。若每生成1molN2,放出642kJ的热量,则该反应的热化学方程式为_______ ;消耗16g液态肼放出的热量为_______ 。
(2)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-544kJ/mol,用如下图示表示该反应时:
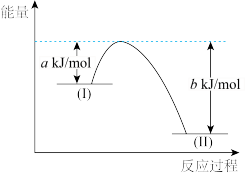
N2H4(g)+O2(g)表示图中_______ (填“I”或“II”)处物质,(b-a)kJ/mol表示该反应的_______ 。使用合适的催化剂,_______ (填“能"或“不能")改变该反应的焓变。
(3)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,则肼(g)和二氧化氮(g)反应生成氮气和水蒸气的热化学方程式为_______ 。
(4)火箭如果用压缩NO2作氧化剂,发射时尾部有大量的红棕色气体产生,此颜色比压缩NO2颜色更深,原因是_______ (用化学方程式表示)。


(1)液态肼和液态过氧化氢混合反应时,即产生大量氮气和水蒸气,并放出大量热。若每生成1molN2,放出642kJ的热量,则该反应的热化学方程式为
(2)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-544kJ/mol,用如下图示表示该反应时:

N2H4(g)+O2(g)表示图中
(3)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,则肼(g)和二氧化氮(g)反应生成氮气和水蒸气的热化学方程式为
(4)火箭如果用压缩NO2作氧化剂,发射时尾部有大量的红棕色气体产生,此颜色比压缩NO2颜色更深,原因是
您最近一年使用:0次
名校
5 . 有机物催化脱氢制备氢气和化工原料是当前石化工业研究的重要课题之一、
(1)以甲烷、水蒸气为原料进行催化重整是制氢的常见方法之一,过程可能涉及反应:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2 kJ∙mol−1
CO(g)+H2O(g)=CO2(g)+H2(g) △H2=−41.1 kJ∙mol−1
CH4(g)=C(g)+2H2(g) △H3=+74.8 kJ∙mol−1
①反应C(g)+2H2O(g)=CO2(g)+2H2(g) △H4=___________ kJ·mol-1
②向原料中添加正硅酸锂Li4SiO4作为CO2的吸附剂,除产生氢气外还生成两种盐,写出该反应的方程式___________ 。
(2)甲基环己烷催化脱氢(

 +3H2)是石油工业制氢常见方法,以Ni−Cu为催化剂,固定反应温度为650K,以氮气为载气,在不同载气流速情况下,甲基环己烷脱氢转化率如图1所示,b点转化率能与a点保持相当的原因是
+3H2)是石油工业制氢常见方法,以Ni−Cu为催化剂,固定反应温度为650K,以氮气为载气,在不同载气流速情况下,甲基环己烷脱氢转化率如图1所示,b点转化率能与a点保持相当的原因是___________ 。

(3)以H2O、CaBr2、Fe3O4为原料进行气固相反应可以实现水的分解制得氢气,其反应原理如图2所示。反应“①”中生成3molHBr,生成氢气的物质的量为_______ ,从原料到O2的生成过程可描述为_______ 。
(1)以甲烷、水蒸气为原料进行催化重整是制氢的常见方法之一,过程可能涉及反应:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2 kJ∙mol−1
CO(g)+H2O(g)=CO2(g)+H2(g) △H2=−41.1 kJ∙mol−1
CH4(g)=C(g)+2H2(g) △H3=+74.8 kJ∙mol−1
①反应C(g)+2H2O(g)=CO2(g)+2H2(g) △H4=
②向原料中添加正硅酸锂Li4SiO4作为CO2的吸附剂,除产生氢气外还生成两种盐,写出该反应的方程式
(2)甲基环己烷催化脱氢(


 +3H2)是石油工业制氢常见方法,以Ni−Cu为催化剂,固定反应温度为650K,以氮气为载气,在不同载气流速情况下,甲基环己烷脱氢转化率如图1所示,b点转化率能与a点保持相当的原因是
+3H2)是石油工业制氢常见方法,以Ni−Cu为催化剂,固定反应温度为650K,以氮气为载气,在不同载气流速情况下,甲基环己烷脱氢转化率如图1所示,b点转化率能与a点保持相当的原因是
(3)以H2O、CaBr2、Fe3O4为原料进行气固相反应可以实现水的分解制得氢气,其反应原理如图2所示。反应“①”中生成3molHBr,生成氢气的物质的量为
您最近一年使用:0次
2021-12-14更新
|
967次组卷
|
4卷引用:江苏省南京市第九中学2023-2024学年高二上学期期末化学试卷
江苏省南京市第九中学2023-2024学年高二上学期期末化学试卷江苏省南通市海门区2021-2022学年高三第二次诊断测试化学试题(已下线)黄金卷6-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)秘籍15 反应热、盖斯定律应用及图象分析-备战2022年高考化学抢分秘籍(全国通用)
名校
6 . 完成下列问题
(1)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意如图:
。两步反应的能量变化示意如图:
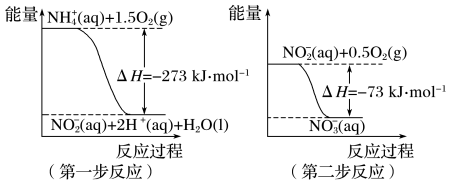
①第一步反应是___________ (填“放热”或“吸热”)反应,判断依据是___________ 。
②1 mol NH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是___________ 。
(2)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) ΔH=-226 kJ·mol-1②
O2(g) ΔH=-226 kJ·mol-1②
则CO(g)与Na2O2(s)反应放出509 kJ热量时,生成的O2为___________ L(标况)。
(3)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1 mol氢气完全燃烧生成1 mol气态水放出241 kJ的热量,已知H—O键能为463 kJ·mol-1,O=O键能为498 kJ·mol-1,计算H—H键能为___________ kJ·mol-1。
(4)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) ΔH1=-74.5 kJ·mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) ΔH2=-64.4 kJ·mol-1;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3。
则ΔH3=___________ kJ·mol-1。
(1)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意如图:
。两步反应的能量变化示意如图:
①第一步反应是
②1 mol NH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是(2)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+
 O2(g) ΔH=-226 kJ·mol-1②
O2(g) ΔH=-226 kJ·mol-1②则CO(g)与Na2O2(s)反应放出509 kJ热量时,生成的O2为
(3)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1 mol氢气完全燃烧生成1 mol气态水放出241 kJ的热量,已知H—O键能为463 kJ·mol-1,O=O键能为498 kJ·mol-1,计算H—H键能为
(4)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) ΔH1=-74.5 kJ·mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) ΔH2=-64.4 kJ·mol-1;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3。
则ΔH3=
您最近一年使用:0次
2021-10-08更新
|
270次组卷
|
2卷引用:江苏省常州市新桥高级中学2021-2022学年高二上学期期末质量检测化学试题
7 . 煤电工业产生的烟气或汽车尾气中常含有NOx、CO等污染大气的气体,其中的NOx来源于如下反应:
反应Ⅰ:
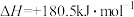
反应Ⅱ:
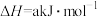
(1)反应Ⅱ在常温下就能自发进行,则a_______ 0。(填“>”或“<”)
(2)煤电工业烟气中的NO可利用“氨法脱硝”处理,其反应为
①反应中,生成 时,被
时,被 氧化的
氧化的 的质量为
的质量为_______ 。
②工业上可利用尿素[ ]水解制得
]水解制得 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(3)为避免汽车尾气中的NOx和CO直接排放到大气中,可利用“三元催化转换器”将其转化为 和
和 。
。
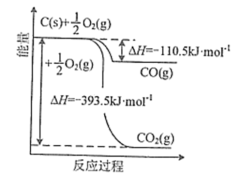
①已知含碳物质参与反应的能量变化如所示,则NO(g)和CO(g)转化为 和
和 的热化学方程式为
的热化学方程式为_______ 。
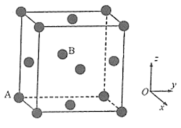
②“三元催化转换器”中用到了金属铂,如图为金属铂的晶胞结构示意图。金属铂晶体中,铂原子周围与之紧邻的其他铂原子数目为_______ 。若A原子的分数坐标为(0,0,0),则B原子的分数坐标为_______ 。
反应Ⅰ:

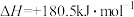
反应Ⅱ:

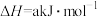
(1)反应Ⅱ在常温下就能自发进行,则a
(2)煤电工业烟气中的NO可利用“氨法脱硝”处理,其反应为

①反应中,生成
 时,被
时,被 氧化的
氧化的 的质量为
的质量为②工业上可利用尿素[
 ]水解制得
]水解制得 ,该反应的化学方程式为
,该反应的化学方程式为(3)为避免汽车尾气中的NOx和CO直接排放到大气中,可利用“三元催化转换器”将其转化为
 和
和 。
。①已知含碳物质参与反应的能量变化如所示,则NO(g)和CO(g)转化为
 和
和 的热化学方程式为
的热化学方程式为
②“三元催化转换器”中用到了金属铂,如图为金属铂的晶胞结构示意图。金属铂晶体中,铂原子周围与之紧邻的其他铂原子数目为

您最近一年使用:0次
名校
8 . (1)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为___________________________ 。
(2)氢气不仅是新能源,也是重要的化工原料。氢气可由甲烷制备:CH4(g)+H2O(l)=CO(g)+3H2(g) ΔH=+250.1 kJ·mol-1,已知298 K时,CH4(g)、CO(g)的燃烧热分别为890 kJ·mol-1、283 kJ·mol-1。写出氢气燃烧热的热化学方程式_______________________________ 。
(3)如下图所示表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:____________________________________ 。

①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
(2)氢气不仅是新能源,也是重要的化工原料。氢气可由甲烷制备:CH4(g)+H2O(l)=CO(g)+3H2(g) ΔH=+250.1 kJ·mol-1,已知298 K时,CH4(g)、CO(g)的燃烧热分别为890 kJ·mol-1、283 kJ·mol-1。写出氢气燃烧热的热化学方程式
(3)如下图所示表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:

您最近一年使用:0次
2020-05-01更新
|
182次组卷
|
2卷引用:江苏省徐州市2018~2019学年高一下学期期末抽测化学试题
名校
解题方法
9 . 联氨(N2H4)是一种绿色环保的还原剂,其氧化产物为氮气。
(1) 合成联氨的有关反应如下:
NH3(g)+NaClO(aq)=NH2Cl(l)+NaOH(aq) ΔH1=-67.45 kJ·mol-1
NH2Cl(l)+NaOH(aq)+NH3(g)=N2H4(l)+NaCl(aq)+H2O(l) ΔH2=-195.32 kJ·mol-1
反应2NH3(g)+NaClO(aq)=N2H4(l)+NaCl(aq)+H2O(l) ΔH=________ kJ·mol-1。
(2) 联氨为二元弱碱,在水中的电离方式与氨相似,写出联氨与过量盐酸反应的离子方程式:________ 。
(3) 联氨—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,负极的电极反应式是__________ 。
(4) 若用此碱性燃料电池作电源,电解AgNO3溶液,电解方程式为_________ ;若阴极析出5.40g金属银,则联氨—空气燃料电池中至少通入标准状况下空气体积________ mL(假设空气中氧气体积分数为20%)
(1) 合成联氨的有关反应如下:
NH3(g)+NaClO(aq)=NH2Cl(l)+NaOH(aq) ΔH1=-67.45 kJ·mol-1
NH2Cl(l)+NaOH(aq)+NH3(g)=N2H4(l)+NaCl(aq)+H2O(l) ΔH2=-195.32 kJ·mol-1
反应2NH3(g)+NaClO(aq)=N2H4(l)+NaCl(aq)+H2O(l) ΔH=
(2) 联氨为二元弱碱,在水中的电离方式与氨相似,写出联氨与过量盐酸反应的离子方程式:
(3) 联氨—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,负极的电极反应式是
(4) 若用此碱性燃料电池作电源,电解AgNO3溶液,电解方程式为
您最近一年使用:0次
10 . 汽车、工厂等污染源排入大气的碳氢化合物和氮氧化物等一次污染物,在紫外光作用下发生光化学反应生成了二次污染物。光化学烟雾是一次污染物和二次污染物的混合物。
(1)汽车尾气中含有CO、NO及碳氢化合物等。
①CO的来源是_______ (用文字说明)。
②NO的来源是______ (用方程式说明)。
③C8H18在汽缸中可裂解生成丙烯和戊烷等,戊烷的同分异构体有______ 种。
(2)文献报道了一种研究模拟光化学烟雾产生的实验,将添加丙烯和NO的空气在烟雾箱中用紫外线照射,各物质浓度的消长关系如图所示:
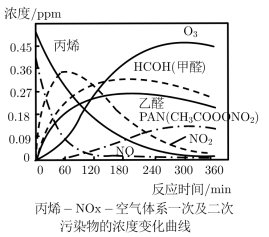
①下列说法正确的是_____ (填标号)。
A.O3具有强氧化性 B.在光反应过程中NO最终全部转变为NO2
C.二次污染物只有乙醛 D.0~120min生成PAN的反应速率最快
②写出CH3CH=CH2被O3氧化为甲醛和乙醛的化学方程式______ (注:每消耗1molO3,同时生成1molO2)。
(1)汽车尾气中含有CO、NO及碳氢化合物等。
①CO的来源是
②NO的来源是
③C8H18在汽缸中可裂解生成丙烯和戊烷等,戊烷的同分异构体有
(2)文献报道了一种研究模拟光化学烟雾产生的实验,将添加丙烯和NO的空气在烟雾箱中用紫外线照射,各物质浓度的消长关系如图所示:

①下列说法正确的是
A.O3具有强氧化性 B.在光反应过程中NO最终全部转变为NO2
C.二次污染物只有乙醛 D.0~120min生成PAN的反应速率最快
②写出CH3CH=CH2被O3氧化为甲醛和乙醛的化学方程式
您最近一年使用:0次



