名校
1 . 已知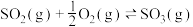 反应过程的能量变化如图所示:
反应过程的能量变化如图所示:

(1)图中C点表示___________ 。E所代表的能量是___________ ;E的大小对该反应的反应热___________ (填“有”或“无”)影响。
(2)请求出反应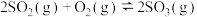

___________ 。
(3)又知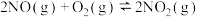
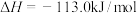 ,请根据题给条件求出反应
,请根据题给条件求出反应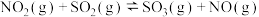 的焓变
的焓变
___________ 。
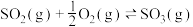 反应过程的能量变化如图所示:
反应过程的能量变化如图所示:
(1)图中C点表示
(2)请求出反应
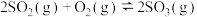

(3)又知
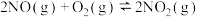
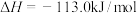 ,请根据题给条件求出反应
,请根据题给条件求出反应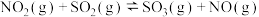 的焓变
的焓变
您最近一年使用:0次
名校
解题方法
2 . 碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
(1)有机物M经过太阳光光照可转化成N,转化过程如下。
 (M)
(M)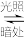
 (N)
(N) 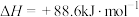
则M的化学式为,M、N相比,较稳定的是___________ (填“M”或“N”)。
(2)已知 (1)的燃烧热为
(1)的燃烧热为 ,
,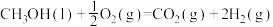

 ,则a
,则a___________ 238.6(填“>”“<”或“=”)。
(3)使 和
和 (g)通过灼热的炭层,生成HCl和
(g)通过灼热的炭层,生成HCl和 ,当有1mol
,当有1mol  参与反应时释放出145kJ热量,写出该反应的热化学方程式:
参与反应时释放出145kJ热量,写出该反应的热化学方程式:___________ 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
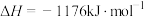 ,则反应过程中,每转移1mol电子时放出的热量为
,则反应过程中,每转移1mol电子时放出的热量为___________ 。
(5)已知:
①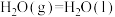
 ;
;
②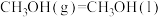
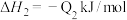 ;
;
③
 (
(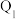 、
、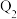 、
、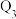 均大于0)。
均大于0)。
若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为___________ kJ。
(1)有机物M经过太阳光光照可转化成N,转化过程如下。
 (M)
(M)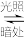
 (N)
(N) 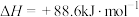
则M的化学式为,M、N相比,较稳定的是
(2)已知
 (1)的燃烧热为
(1)的燃烧热为 ,
,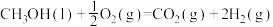

 ,则a
,则a(3)使
 和
和 (g)通过灼热的炭层,生成HCl和
(g)通过灼热的炭层,生成HCl和 ,当有1mol
,当有1mol  参与反应时释放出145kJ热量,写出该反应的热化学方程式:
参与反应时释放出145kJ热量,写出该反应的热化学方程式:(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,

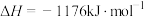 ,则反应过程中,每转移1mol电子时放出的热量为
,则反应过程中,每转移1mol电子时放出的热量为(5)已知:
①
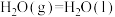
 ;
;②
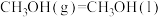
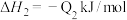 ;
;③

 (
(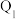 、
、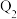 、
、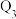 均大于0)。
均大于0)。若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为
您最近一年使用:0次
2022-03-22更新
|
421次组卷
|
4卷引用:内蒙古乌兰察布市2021-2022学年高二上学期期末考试化学试题
内蒙古乌兰察布市2021-2022学年高二上学期期末考试化学试题(已下线)1.2 反应热的计算-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)湖北省襄阳市第三中学2022-2023学年高二上学期12月月考化学试题河北省石家庄市第四十二中学2023-2024学年高二上学期第一次月考化学试题
解题方法
3 . 我国首创以铝组成的金属—海水—空气电池作为新型海水标志灯的能源,它以海水为电解质溶液,靠空气中的氧气使铝组成的金属不断氧化而产生电流。
(1)只要把灯放入海水中数分钟,就会发出耀眼的白光,则该电池的负极反应式为__________ ;
(2)电解法可制取碳的一种气态氢化物C2H4(如图所示)电极a接电源的__________ 极,该电极反应式为__________ ;
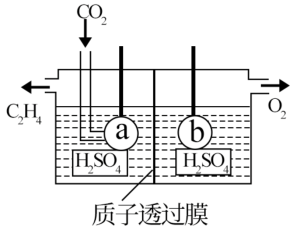
(3)将SO2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体NO,有关反应的离子方程式为__________ ;
(4)处理NOx的一种方法是利用甲烷催化还原NOx,
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ•mol-1;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为__________ ;
(5)H2O2在工业、农业、医药上都有广泛的用途。用碱性氢氧燃料电池可合成H2O2,具有效率高、无污染等特点。电池总反应式为H2+O2+OH-=H2O+ ,写出正极反应式
,写出正极反应式__________ 。
(1)只要把灯放入海水中数分钟,就会发出耀眼的白光,则该电池的负极反应式为
(2)电解法可制取碳的一种气态氢化物C2H4(如图所示)电极a接电源的

(3)将SO2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体NO,有关反应的离子方程式为
(4)处理NOx的一种方法是利用甲烷催化还原NOx,
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ•mol-1;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
(5)H2O2在工业、农业、医药上都有广泛的用途。用碱性氢氧燃料电池可合成H2O2,具有效率高、无污染等特点。电池总反应式为H2+O2+OH-=H2O+
 ,写出正极反应式
,写出正极反应式
您最近一年使用:0次
名校
4 . 环戊二烯(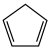 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知: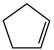 (g) =
(g) =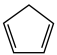 (g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应:
(g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应: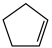 (g)+ I2(g) =
(g)+ I2(g) = (g)+2HI(g) ③ ΔH3=
(g)+2HI(g) ③ ΔH3=___________ kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯(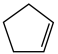 )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________ ,该反应的平衡常数Kp=_________ Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________ (填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________ (填标号)。
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L−1
 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:(1)已知:
 (g) =
(g) = (g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应:
(g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应: (g)+ I2(g) =
(g)+ I2(g) = (g)+2HI(g) ③ ΔH3=
(g)+2HI(g) ③ ΔH3=(2)某温度下,等物质的量的碘和环戊烯(
 )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L−1
您最近一年使用:0次
2019-06-26更新
|
2654次组卷
|
20卷引用:内蒙古赤峰市2021-2022学年高二下学期期末考试化学试题
内蒙古赤峰市2021-2022学年高二下学期期末考试化学试题江西省高安中学2019-2020学年高二上学期期末考试化学(B卷)试题四川省遂宁市2020-2021学年高二下学期期末考试化学试题河南省洛阳市第一中学2022-2023学年高二上学期期末检测化学试题湖南省邵阳市新邵县2023-2024学年高二上学期期末考试化学试题(已下线)专题09 反应速率、化学平衡——2019年高考真题和模拟题化学分项汇编(已下线)专题7.2 化学平衡状态 化学平衡移动(练)-《2020年高考一轮复习讲练测》(已下线)专题7.2 化学平衡状态 化学平衡移动(讲)-《2020年高考一轮复习讲练测》鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2章 综合检测高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二章素养检测(已下线)2.3.3+化学平衡常数-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 过高考 3年真题强化闯关(已下线)第23讲 化学平衡状态 化学平衡的移动 (精讲)——2021年高考化学一轮复习讲练测鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过高考选择性必修1(SJ)专题2专题培优专练(已下线)第19讲 化学平衡(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)山东省临沂市平邑县第一中学实验部2021-2022学年高二上学期第二次月考化学试题江西省崇义中学2020-2021学年高一上学期期中考试(A卷)化学试题(已下线)第19讲 化学平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)福建省泉州市南安市侨光中学2022-2023学年高二上学期10月月考化学试题
名校
5 . (1)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:___ .
(2)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)ΔH=+489.0 kJ·mol-1①
CO(g)+O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1②
C(石墨)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1③
则4Fe(s)+3O2(g)=2Fe2O3(s)的ΔH为___
(2)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)ΔH=+489.0 kJ·mol-1①
CO(g)+O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1②
C(石墨)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1③
则4Fe(s)+3O2(g)=2Fe2O3(s)的ΔH为
您最近一年使用:0次
名校
解题方法
6 . (1)已知某反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答问题。
C(g)+D(g)过程中的能量变化如图所示,回答问题。

该反应是____ (填“吸热”或“放热”)反应,该反应的ΔH=_____ kJ· mol-1(用含E1、E2的代数式表示)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)==2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②H2O(l) =H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式___________________________ 。
(3)已知:H2(g)+Cl2(g)==2HCl(g) ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为______ kJ。
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g) 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________ 。
 C(g)+D(g)过程中的能量变化如图所示,回答问题。
C(g)+D(g)过程中的能量变化如图所示,回答问题。
该反应是
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)==2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②H2O(l) =H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式
(3)已知:H2(g)+Cl2(g)==2HCl(g) ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)
 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是
您最近一年使用:0次
名校
7 . (前两空每空2分,后三空每空3分,共13分)氮气与氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
(1)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___ (填“大于”“等于”或“小于”)92 kJ,原因 是______________ ;若加入催化剂,ΔH___ (填“变大”“变小”或“不变”)。
(2)已知:破坏1 mol N≡N键、1 mol H—H键需要吸收的能量分别为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为_____ kJ。
(3)N2H4可视为NH3分子中的一个H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂,生成N2和H2O(g)。
已知:N2(g)+2O2(g) 2NO2(g) ΔH1=+67.7 kJ·mol-1
2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g)ΔH2=-534 kJ·mol-1。
N2(g)+2H2O(g)ΔH2=-534 kJ·mol-1。
则:1 mol N2H4与NO2完全反应的热化学方程式为______________________ 。
 2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:(1)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量
(2)已知:破坏1 mol N≡N键、1 mol H—H键需要吸收的能量分别为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为
(3)N2H4可视为NH3分子中的一个H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂,生成N2和H2O(g)。
已知:N2(g)+2O2(g)
 2NO2(g) ΔH1=+67.7 kJ·mol-1
2NO2(g) ΔH1=+67.7 kJ·mol-1N2H4(g)+O2(g)
 N2(g)+2H2O(g)ΔH2=-534 kJ·mol-1。
N2(g)+2H2O(g)ΔH2=-534 kJ·mol-1。则:1 mol N2H4与NO2完全反应的热化学方程式为
您最近一年使用:0次



