1 . 回答下列问题:
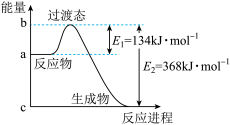
(1)反应A(g)+B(g) C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。______ 热反应(填“吸”、“放”)。
②在反应体系中加入催化剂,反应速率增大,E3_______ ,E2_______ (填“增大”、“减小”或“不变”)。
③当反应达到平衡时,升高温度,A的转化率_______ ( 填 “增大”、“减小”或“不变” )。
(2)一定条件下,一氧化碳与氢气反应可以合成甲醇。已知:
CH3OH(g)+1.5O2(g)=CO2(g)+2H2O(l) △H1=a kJ•mol﹣1
CO(g)+0.5O2(g)=CO2(g) △H2=b kJ•mol﹣1
H2(g)+0.5O2(g)=H2O(l) △H3=c kJ•mol﹣1
则CO(g)+2H2(g) CH3OH(g) △H=
CH3OH(g) △H=____________ kJ•mol﹣1 (用a、b、c表示)。
(3)一定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2,在催化剂作用下发生反应:CO(g)+2H2(g) CH3OH(g) △H,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) △H,平衡转化率与温度、压强的关系如图所示。______ 0 (填“>”、“<”或“=”) ②p2_____ p1(填“>”、“<”或“=”);
(1)反应A(g)+B(g)
 C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。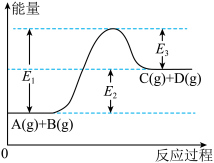
②在反应体系中加入催化剂,反应速率增大,E3
③当反应达到平衡时,升高温度,A的转化率
(2)一定条件下,一氧化碳与氢气反应可以合成甲醇。已知:
CH3OH(g)+1.5O2(g)=CO2(g)+2H2O(l) △H1=a kJ•mol﹣1
CO(g)+0.5O2(g)=CO2(g) △H2=b kJ•mol﹣1
H2(g)+0.5O2(g)=H2O(l) △H3=c kJ•mol﹣1
则CO(g)+2H2(g)
 CH3OH(g) △H=
CH3OH(g) △H=(3)一定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2,在催化剂作用下发生反应:CO(g)+2H2(g)
 CH3OH(g) △H,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) △H,平衡转化率与温度、压强的关系如图所示。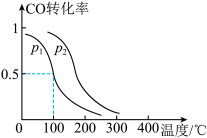
您最近半年使用:0次
2 . 中国首次实现了利用二氧化碳人工合成淀粉,为全球的“碳达峰”、“碳中和”起到重大的支撑作用。其中最关键的一步是以 为原料制
为原料制 。在某
。在某 催化加氢制
催化加氢制 的反应体系中,发生的主要反应有:
的反应体系中,发生的主要反应有:
Ⅰ.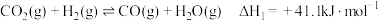
Ⅱ.
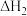
Ⅲ.
(1)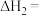
___________  。
。
(2) 时,往某密闭容器中按投料比
时,往某密闭容器中按投料比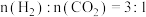 充入
充入 和
和 。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如下图所示。
。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如下图所示。
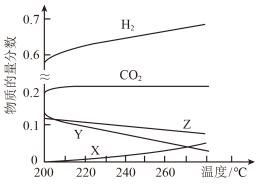
图中Y代表___________ (填化学式)。
(3)我国科研人员研究出在 催化剂上
催化剂上 氢化合成甲醇的反应历程如下图所示。反应②的化学方程式为
氢化合成甲醇的反应历程如下图所示。反应②的化学方程式为___________ 。分析在反应气中加入少量的水能够提升甲醇产率的可能原因是___________ 。

(4)恒压下, 和
和 以物质的量之比
以物质的量之比 投料合成甲醇(不考虑副反应),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出
投料合成甲醇(不考虑副反应),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出 。请在下图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线。
。请在下图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线。___________

 为原料制
为原料制 。在某
。在某 催化加氢制
催化加氢制 的反应体系中,发生的主要反应有:
的反应体系中,发生的主要反应有:Ⅰ.
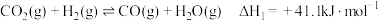
Ⅱ.

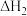
Ⅲ.

(1)
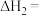
 。
。(2)
 时,往某密闭容器中按投料比
时,往某密闭容器中按投料比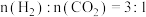 充入
充入 和
和 。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如下图所示。
。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如下图所示。
图中Y代表
(3)我国科研人员研究出在
 催化剂上
催化剂上 氢化合成甲醇的反应历程如下图所示。反应②的化学方程式为
氢化合成甲醇的反应历程如下图所示。反应②的化学方程式为
(4)恒压下,
 和
和 以物质的量之比
以物质的量之比 投料合成甲醇(不考虑副反应),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出
投料合成甲醇(不考虑副反应),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出 。请在下图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线。
。请在下图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线。
您最近半年使用:0次
3 . 回答下列问题。
(1)如图是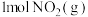 和
和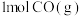 反应生成
反应生成 和
和 过程中的能量变化示意图。请写出
过程中的能量变化示意图。请写出 和
和 反应的热化学方程式
反应的热化学方程式__________ 。
(2)用如图所示装置进行中和热的测定实验。
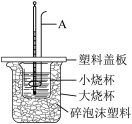
①仪器A的名称是__________ ,碎泡沫塑料的作用是__________ 。
②若实验过程中,未加塑料盖板,则实验测出的
__________ (填“偏大”或“偏小”或“无影响”)。
③理论上强酸强碱的中和热为 ,写出表示稀硫酸和稀
,写出表示稀硫酸和稀 溶液反应的中和热的热化学方程式
溶液反应的中和热的热化学方程式__________ 。
(3)甲醇是人们开发和利用的一种新能源。已知:


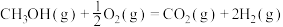
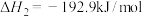
①甲醇蒸气完全燃烧生成二氧化碳气体和液态水的热化学方程式为__________ ;
② 的燃烧热为
的燃烧热为__________ 。
(1)如图是
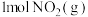 和
和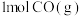 反应生成
反应生成 和
和 过程中的能量变化示意图。请写出
过程中的能量变化示意图。请写出 和
和 反应的热化学方程式
反应的热化学方程式
(2)用如图所示装置进行中和热的测定实验。

①仪器A的名称是
②若实验过程中,未加塑料盖板,则实验测出的

③理论上强酸强碱的中和热为
 ,写出表示稀硫酸和稀
,写出表示稀硫酸和稀 溶液反应的中和热的热化学方程式
溶液反应的中和热的热化学方程式(3)甲醇是人们开发和利用的一种新能源。已知:


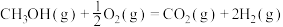
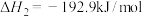
①甲醇蒸气完全燃烧生成二氧化碳气体和液态水的热化学方程式为
②
 的燃烧热为
的燃烧热为
您最近半年使用:0次
名校
解题方法
4 . 回答下列问题
(1)已知:
则2H2(g)+O2(g) =2H2O(g) ΔH=___________ kJ·mol-1。
(2)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:

①N2(g)+O2(g) =2NO(g) ΔH1=___________
②2CO(g)+O2(g) = 2CO2(g) ΔH2=-565 kJ·mol-1
在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式:___________ 。
(3)CO和H2是工业上最常用的合成气,该合成气的制备方法很多,它们也能合成许多重要的有机物。制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。
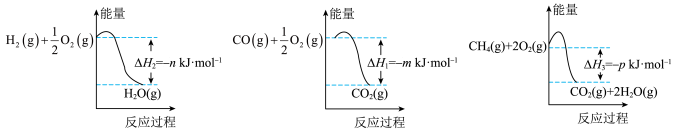
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________ 。
(4)下图是锌锰干电池基本构造图,
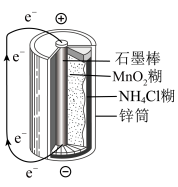
该电池的负极材料是___________ ,工作时NH 在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是
在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是___________ ;电路中每通过0.2 mol e-,负极质量减少___________ 。
(1)已知:
| 化学键 | H-H | O=O | O-H |
| 键能(kJ·mol-1) | 436 | 496 | 463 |
(2)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:

①N2(g)+O2(g) =2NO(g) ΔH1=
②2CO(g)+O2(g) = 2CO2(g) ΔH2=-565 kJ·mol-1
在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式:
(3)CO和H2是工业上最常用的合成气,该合成气的制备方法很多,它们也能合成许多重要的有机物。制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。

CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为
(4)下图是锌锰干电池基本构造图,

该电池的负极材料是
 在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是
在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是
您最近半年使用:0次
解题方法
5 . 途径I: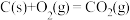
 。
。
途径Ⅱ:先制水煤气
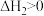 ,
,
再燃烧水煤气: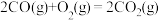
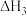 ,
,
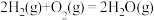
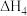 。
。
请回答下列问题:
(1)判断:途径I放出的热量______ (填“>”、“=”或“<”)途径Ⅱ放出的热量。
(2)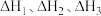 和
和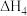 的数学关系式是
的数学关系式是______ 。
(3)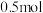 气态高能燃料乙硼烷(
气态高能燃料乙硼烷( )在氧气中燃烧生成固态三氧化二硼(
)在氧气中燃烧生成固态三氧化二硼( )和液态水,放出
)和液态水,放出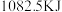 热量,其热化学方程式
热量,其热化学方程式______ 。
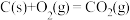
 。
。途径Ⅱ:先制水煤气

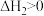 ,
,再燃烧水煤气:
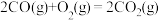
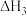 ,
,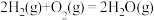
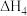 。
。请回答下列问题:
(1)判断:途径I放出的热量
(2)
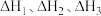 和
和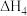 的数学关系式是
的数学关系式是(3)
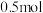 气态高能燃料乙硼烷(
气态高能燃料乙硼烷( )在氧气中燃烧生成固态三氧化二硼(
)在氧气中燃烧生成固态三氧化二硼( )和液态水,放出
)和液态水,放出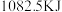 热量,其热化学方程式
热量,其热化学方程式
您最近半年使用:0次
名校
解题方法
6 . 汽车尾气中主要污染物是 和CO,它们是现代化城市中的重要大气污染物。
和CO,它们是现代化城市中的重要大气污染物。
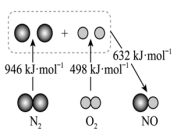
(1)汽车发动机工作时会引发 和
和 反应生成NO,其能量变化如图所示,则图中三种分子最稳定的是
反应生成NO,其能量变化如图所示,则图中三种分子最稳定的是___________ ,图中对应反应的热化学方程式为___________ 。
(2) 和CO均是有害气体,可在
和CO均是有害气体,可在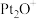 表面转化为无害气体,其反应原理如下:
表面转化为无害气体,其反应原理如下: 。有关化学反应的能量变化过程如图所示。
。有关化学反应的能量变化过程如图所示。
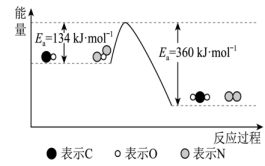
图中反应是___________ (填“放热”或“吸热”)反应,该反应的活化能为___________ ,该反应的 =
=___________ 。
(3)利用 还原法可将
还原法可将 ,还原为
,还原为 进行脱除。已知:
进行脱除。已知: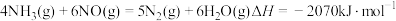 ,若有0.5molNO被还原,放出的热量为
,若有0.5molNO被还原,放出的热量为___________ 。
 和CO,它们是现代化城市中的重要大气污染物。
和CO,它们是现代化城市中的重要大气污染物。(1)汽车发动机工作时会引发
 和
和 反应生成NO,其能量变化如图所示,则图中三种分子最稳定的是
反应生成NO,其能量变化如图所示,则图中三种分子最稳定的是
(2)
 和CO均是有害气体,可在
和CO均是有害气体,可在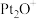 表面转化为无害气体,其反应原理如下:
表面转化为无害气体,其反应原理如下: 。有关化学反应的能量变化过程如图所示。
。有关化学反应的能量变化过程如图所示。
图中反应是
 =
=(3)利用
 还原法可将
还原法可将 ,还原为
,还原为 进行脱除。已知:
进行脱除。已知: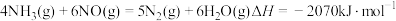 ,若有0.5molNO被还原,放出的热量为
,若有0.5molNO被还原,放出的热量为
您最近半年使用:0次
名校
7 . 完成下列问题
(1)已知:①

②

则

___________ 。
(2)已知:①

②

则表示氨气燃烧热的热化学方程式为___________ ,该反应可设计为碱性条件下的燃料电池,负极电极反应式为___________ 。
(3)已知几种化学键的键能和热化学方程式如下:

 ,则a=
,则a=___________ 。
(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(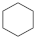 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是___________ ;反应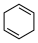 (l)=
(l)=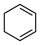 (l)的
(l)的
___________ 。

(1)已知:①


②


则


(2)已知:①


②


则表示氨气燃烧热的热化学方程式为
(3)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能/( ) ) | 391 | 193 | 243 | a | 432 |

 ,则a=
,则a=(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是 (l)=
(l)= (l)的
(l)的

您最近半年使用:0次
名校
解题方法
8 . 回答下列问题。
(1)利用 超干重整
超干重整 技术,可以得到富含CO和
技术,可以得到富含CO和 的化工原料气,反应如下:①
的化工原料气,反应如下:①
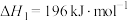
已知部分化学键的键能如下:
(CO中可近似认为是碳氧三键):
由此计算H—H键的键能约为___________  (保留整数)。
(保留整数)。
(2)已知:②

③
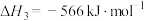
结合反应①,计算 的
的
___________ 。
(1)利用
 超干重整
超干重整 技术,可以得到富含CO和
技术,可以得到富含CO和 的化工原料气,反应如下:①
的化工原料气,反应如下:①
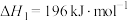
已知部分化学键的键能如下:
| 共价键 | C—H | H—O | C≡O |
键能( ) ) | 414 | 464 | 1072 |
由此计算H—H键的键能约为
 (保留整数)。
(保留整数)。(2)已知:②


③

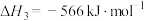
结合反应①,计算
 的
的
您最近半年使用:0次
名校
9 . I.肼可作氢气“储蓄罐”。Ni-Pt/La2O3是一种高选择性的肼分解制氢催化剂,催化反应机理如图所示,反应如下:

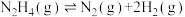
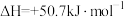
(1)根据上述信息,推测Ni-Pt/La2O3___________。
Ⅱ.肼类燃烧剂曾是火箭的“粮食”,但会造成污染,正逐渐被淘汰。新一代运载火箭采用全新配方——低温液氢液氧推进剂,让火箭飞得更稳健。已知一定条件下:
①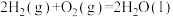
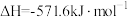 '
'
②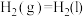

③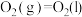
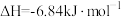
④

(2)请写出相同条件下液氢和液氧生成气态水的热化学方程式:___________ 。
(3)根据上述信息,以下说法正确的是___________。

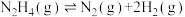
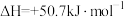
(1)根据上述信息,推测Ni-Pt/La2O3___________。
| A.能够有效降低制氢反应的反应热 |
| B.同时提高制氢正反应和逆反应的速率 |
| C.改变了制氢反应的反应历程 |
| D.不参与化学反应,使用一段时间后无需补加 |
Ⅱ.肼类燃烧剂曾是火箭的“粮食”,但会造成污染,正逐渐被淘汰。新一代运载火箭采用全新配方——低温液氢液氧推进剂,让火箭飞得更稳健。已知一定条件下:
①
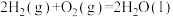
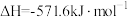 '
'②
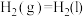

③
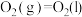
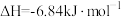
④


(2)请写出相同条件下液氢和液氧生成气态水的热化学方程式:
(3)根据上述信息,以下说法正确的是___________。
| A.变化④为低温自发的过程 |
| B.液氢液氧不点燃观察不到水生成,故该反应无法自发进行 |
| C.0.5mol液态氢气的能量高于0.5mol气态氢气的能量 |
| D.液氢和液氧作为火箭推进剂符合绿色化学理念 |
您最近半年使用:0次
解题方法
10 . 天然气高温条件下可以转化为氢气,发生反应的热化学方程式为: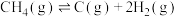
 。
。
回答下列问题:
(1)反应的平衡常数表达式为
___________ ;已知几种物质的燃烧热如下表所示,则反应的
___________ kJ·mol-1。
(2)一定温度下,在容积不变的密闭容器中充入适量 发生上述反应,下列情况能说明反应达到平衡状态的是
发生上述反应,下列情况能说明反应达到平衡状态的是___________ (填序号)。
a.反应总压强不随时间变化 b.气体密度不随时间变化
c.CH₄体积分数不随时间变化 d. 的消耗速率与
的消耗速率与 的生成速率之比为1∶2
的生成速率之比为1∶2
(3)在体积为2L的密闭容器中充入1mol 发生上述反应,不同温度下测得
发生上述反应,不同温度下测得 的转化率随时间的变化关系如下表所示:
的转化率随时间的变化关系如下表所示:
①
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
② 条件下,前2min内,用
条件下,前2min内,用 表示的化学反应速率
表示的化学反应速率
___________ mol⋅L-1⋅min-1;达平衡时 的体积分数为
的体积分数为___________ %(结果保留1位小数)。
(4)一定温度,100kPa条件下,向密闭容器中充入 、Ar气混合气体,
、Ar气混合气体, 的转化率与
的转化率与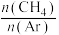 的关系如图所示。
的关系如图所示。
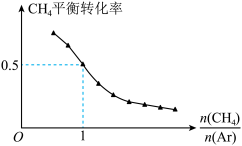
①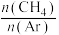 增大,
增大, 平衡转化率减小的原因是
平衡转化率减小的原因是___________ 。
②此温度下,该反应的分压平衡常数
___________ 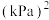 。
。
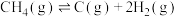
 。
。回答下列问题:
(1)反应的平衡常数表达式为


| 可燃物 |  | 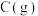 |  |
燃烧热/kJ·mol | -890.3 | -393.5 | -285.8 |
(2)一定温度下,在容积不变的密闭容器中充入适量
 发生上述反应,下列情况能说明反应达到平衡状态的是
发生上述反应,下列情况能说明反应达到平衡状态的是a.反应总压强不随时间变化 b.气体密度不随时间变化
c.CH₄体积分数不随时间变化 d.
 的消耗速率与
的消耗速率与 的生成速率之比为1∶2
的生成速率之比为1∶2(3)在体积为2L的密闭容器中充入1mol
 发生上述反应,不同温度下测得
发生上述反应,不同温度下测得 的转化率随时间的变化关系如下表所示:
的转化率随时间的变化关系如下表所示:时间/min 转化率 转化率温度/℃ | 2 | 4 | 6 | 8 | 10 |
 | 40% | 60% | 80% | 80% | 80% |
 | 20% | 30% | 40% | 60% | 60% |

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②
 条件下,前2min内,用
条件下,前2min内,用 表示的化学反应速率
表示的化学反应速率
 的体积分数为
的体积分数为(4)一定温度,100kPa条件下,向密闭容器中充入
 、Ar气混合气体,
、Ar气混合气体, 的转化率与
的转化率与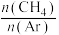 的关系如图所示。
的关系如图所示。
①
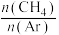 增大,
增大, 平衡转化率减小的原因是
平衡转化率减小的原因是②此温度下,该反应的分压平衡常数

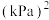 。
。
您最近半年使用:0次



