解题方法
1 . 能源是现代社会发展的支柱之一。
(1)下列反应中,属于放热反应的是______ (填序号)。
a.Ba(OH)2•8H2O与NH4Cl混合搅拌 b.高温煅烧石灰石 c.铝与盐酸反应
(2)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式______ 。
(3)1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,此反应的热化学方程式为_____ 。
(4)已知白磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式分别为:P4(s)+5O2(g)=P4O10(s) △H=-2985.92kJ•mol-1;P(s)+ O2(g)=
O2(g)= P4O10(s) △H=-739.04kJ•mol-1。1mol白磷转化为红磷时
P4O10(s) △H=-739.04kJ•mol-1。1mol白磷转化为红磷时______ (填“释放”或“吸收”)_____ kJ的热量。
(1)下列反应中,属于放热反应的是
a.Ba(OH)2•8H2O与NH4Cl混合搅拌 b.高温煅烧石灰石 c.铝与盐酸反应
(2)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式
(3)1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,此反应的热化学方程式为
(4)已知白磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式分别为:P4(s)+5O2(g)=P4O10(s) △H=-2985.92kJ•mol-1;P(s)+
 O2(g)=
O2(g)= P4O10(s) △H=-739.04kJ•mol-1。1mol白磷转化为红磷时
P4O10(s) △H=-739.04kJ•mol-1。1mol白磷转化为红磷时
您最近一年使用:0次
2 . 甲烷在日常生活及有机合成中用途广泛,某研究小组研究甲烷在高温下气相裂解反应的原理及其应用。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ•mol-1
C2H2(g)+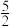 O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-1
2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ•mol-1
则甲烷气相裂解反应:2CH4(g) C2H2(g)+3H2(g)的ΔH=
C2H2(g)+3H2(g)的ΔH=_____ 。
(2)该研究小组在研究过程中得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

①T1℃时,向2L恒容密闭容器中充入0.3molCH4,只发生反应2CH4(g) C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为____ 。
②对上述平衡状态,若改变温度至T2℃,经10s后再次达到平衡,c(CH4)=2c(C2H4),则10s内C2H4的平均反应速率v(C2H4)=___ ,上述变化过程中T1____ (填“>”或“<”)T2,判断理由是____ 。
③在①建立的平衡状态基础上,其他条件不变,再通入0.5molCH4,平衡将____ (填“不移动”、“正向移动”或“逆向移动”),与原平衡相比,CH4的平衡转化率____ (填“不变”、“变大”或“变小”)。
(3)若容器中发生反应2CH4(g) C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=
C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=____ Pa2(用平衡分压代替平衡浓度)。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ•mol-1
C2H2(g)+
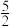 O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-12H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ•mol-1
则甲烷气相裂解反应:2CH4(g)
 C2H2(g)+3H2(g)的ΔH=
C2H2(g)+3H2(g)的ΔH=(2)该研究小组在研究过程中得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

①T1℃时,向2L恒容密闭容器中充入0.3molCH4,只发生反应2CH4(g)
 C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为②对上述平衡状态,若改变温度至T2℃,经10s后再次达到平衡,c(CH4)=2c(C2H4),则10s内C2H4的平均反应速率v(C2H4)=
③在①建立的平衡状态基础上,其他条件不变,再通入0.5molCH4,平衡将
(3)若容器中发生反应2CH4(g)
 C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=
C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=
您最近一年使用:0次
2022-10-19更新
|
600次组卷
|
3卷引用:山东省2022-2023学年高二上学期学业水平测试化学试题
3 . 肼(N2H4)是一种应用广泛的化工原料,可作为火箭发动机的燃料。
已知:①N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7kJ/mol。
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ/mol。
请回答:
(1)反应①属于_______ (填“吸热”或“放热”)反应。
(2)反应①消耗28gN2(g)时,∆H=____ kJ/mol。
(3)反应②生成1molN2(g)时,∆H=____ kJ/mol。
(4)反应2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g),∆H=____ kJ/mol。
已知:①N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7kJ/mol。
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ/mol。
请回答:
(1)反应①属于
(2)反应①消耗28gN2(g)时,∆H=
(3)反应②生成1molN2(g)时,∆H=
(4)反应2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g),∆H=
您最近一年使用:0次
解题方法
4 . 载人航天器中,利用萨巴蒂尔反应将航天员呼出的 转化为
转化为 ,再通过电解
,再通过电解 获得
获得 ,实现
,实现 的再生。已知:
的再生。已知:
①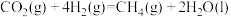 △H= -252.9kJ/mol
△H= -252.9kJ/mol
②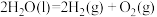 △H= 571.6.kJ/mol
△H= 571.6.kJ/mol
请回答下列问题:
(1)反应①属于______ (填“吸热”或“放热”)反应。
(2)反应①消耗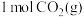 时,热量变化为
时,热量变化为______  。
。
(3)反应②的热量变化为吸热571.6.kJ时,生成 的质量是
的质量是_______ g。
(4)反应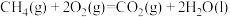 ,△H=
,△H=______  。
。
 转化为
转化为 ,再通过电解
,再通过电解 获得
获得 ,实现
,实现 的再生。已知:
的再生。已知:①
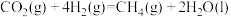 △H= -252.9kJ/mol
△H= -252.9kJ/mol②
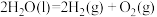 △H= 571.6.kJ/mol
△H= 571.6.kJ/mol请回答下列问题:
(1)反应①属于
(2)反应①消耗
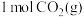 时,热量变化为
时,热量变化为 。
。(3)反应②的热量变化为吸热571.6.kJ时,生成
 的质量是
的质量是(4)反应
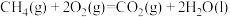 ,△H=
,△H= 。
。
您最近一年使用:0次
2020-09-16更新
|
204次组卷
|
3卷引用:北京市2018年春季普通高中会考化学试题
5 . 已知:①C(s)+O2(g)===CO2(g) ΔH=a kJ·mol-1
②CO2(g)+C(s)===2CO(g) ΔH=b kJ·mol-1
③Si(s)+O2(g)===SiO2(s) ΔH=c kJ·mol-1
工业上生产粗硅的热化学方程式为__________________________ 。
②CO2(g)+C(s)===2CO(g) ΔH=b kJ·mol-1
③Si(s)+O2(g)===SiO2(s) ΔH=c kJ·mol-1
工业上生产粗硅的热化学方程式为
您最近一年使用:0次
6 . 已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:_____________ 。
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:
您最近一年使用:0次
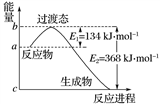
7 . (1)如图所示表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:_______________________________________ 。
(2)已知:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-25 kJ· mol-1
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH=-47 kJ· mol-1
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=+19 kJ· mol-1
请写出CO还原FeO的热化学方程式:__________________________________ 。

(2)已知:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-25 kJ· mol-1
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH=-47 kJ· mol-1
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=+19 kJ· mol-1
请写出CO还原FeO的热化学方程式:
您最近一年使用:0次
名校
8 . (Ⅰ)已知工业上生产H2的过程中有如下反应: CO (g) + H2O (g) CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
(1)若增大H2O (g)的浓度,则CO的转化率_________ (填“增大”或“减小”)。
(2)若升高温度能使化学平衡向正反应方向移动,则正反应是____________ (填“放热”或“吸热”)反应。
(Ⅱ)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的化学方程式为:
a.C(s)+O2(g) ═ CO2(g);△H═ E1 ①
b.C(s)+H2O(g) ═ CO(g)+H2(g);△H═ E2 ②
H2(g)+1/2 O2(g) ═H2O(g);△H═ E3 ③
CO(g)+1/2 O2(g) ═CO2(g);△H═ E4 ④
请回答:
⑴与途径a相比,途径b有较多的优点,即____________ 。
⑵上述四个热化学方程式中哪个反应的△H>0 ?_____________ 。
⑶等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是( )
A.a比b多 B.a比b少 C.a与b在理论上相同
⑷根据能量守恒定律,E1 、E2、 E3、E4之间的关系为________________________ 。
 CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:(1)若增大H2O (g)的浓度,则CO的转化率
(2)若升高温度能使化学平衡向正反应方向移动,则正反应是
(Ⅱ)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的化学方程式为:
a.C(s)+O2(g) ═ CO2(g);△H═ E1 ①
b.C(s)+H2O(g) ═ CO(g)+H2(g);△H═ E2 ②
H2(g)+1/2 O2(g) ═H2O(g);△H═ E3 ③
CO(g)+1/2 O2(g) ═CO2(g);△H═ E4 ④
请回答:
⑴与途径a相比,途径b有较多的优点,即
⑵上述四个热化学方程式中哪个反应的△H>0 ?
⑶等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是
A.a比b多 B.a比b少 C.a与b在理论上相同
⑷根据能量守恒定律,E1 、E2、 E3、E4之间的关系为
您最近一年使用:0次
名校
9 . (1)CH3COOH是最常见的有机弱酸。
①CH3COOH的电离方程式为_____________ 。
②CH3COONa溶液呈碱性,原因是__________ (填“CH3COO-”或“Na+”)水解引起的。
③在CH3COONa溶液中,c(Na+)_______ c(CH3COO-)(填“>”“=”或“<”)。
(2)已知:反应C(s)+H2O(g) CO(g)+H2(g)的△H=131.3kJ/mol。
CO(g)+H2(g)的△H=131.3kJ/mol。
①该反应是反应__________ (填“吸热”或“放热”)。
②若反应消耗24g C(s),则反应的热效应为__________ 。
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol通入容积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
① 2min内,v(CO)=__________ 。
②该温度下,此反应的平衡常数表达式K=_________ 。
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),达到平衡时CO的体积分数_____ (填“增大”、“减小”或“不变”)。
(4)下图为直流电源电解CuSO4溶液的装置,C1和C2都为石墨电极,请回答下列问题:
① C1作_________ (填“阳极”或”阴极”)。
② C2极电极反应式为____________ 。
①CH3COOH的电离方程式为
②CH3COONa溶液呈碱性,原因是
③在CH3COONa溶液中,c(Na+)
(2)已知:反应C(s)+H2O(g)
 CO(g)+H2(g)的△H=131.3kJ/mol。
CO(g)+H2(g)的△H=131.3kJ/mol。①该反应是反应
②若反应消耗24g C(s),则反应的热效应为
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol通入容积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:t/min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
① 2min内,v(CO)=
②该温度下,此反应的平衡常数表达式K=
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),达到平衡时CO的体积分数
(4)下图为直流电源电解CuSO4溶液的装置,C1和C2都为石墨电极,请回答下列问题:
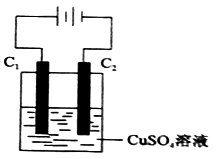
① C1作
② C2极电极反应式为
您最近一年使用:0次
2017-04-27更新
|
238次组卷
|
2卷引用:湖南省2016-2017学年高二学业水平模拟(一)化学试题
解题方法
10 . 将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学方程式:______ 。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出下列循环图:
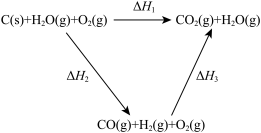
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。请分析:甲、乙两同学观点正确的是______ (填“甲”或“乙”);判断的理由是______ 。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点______ 。
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇;②甲醛;③甲酸;④乙酸。试分析当CO和H2按1:1的体积比混合反应,合成上述______ (填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+
 O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1CO(g)+
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学方程式:
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出下列循环图:

并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。请分析:甲、乙两同学观点正确的是
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇;②甲醛;③甲酸;④乙酸。试分析当CO和H2按1:1的体积比混合反应,合成上述
您最近一年使用:0次



