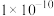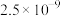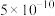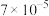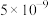(1)CH3COOH是最常见的有机弱酸。
①CH3COOH的电离方程式为_____________ 。
②CH3COONa溶液呈碱性,原因是__________ (填“CH3COO-”或“Na+”)水解引起的。
③在CH3COONa溶液中,c(Na+)_______ c(CH3COO-)(填“>”“=”或“<”)。
(2)已知:反应C(s)+H2O(g) CO(g)+H2(g)的△H=131.3kJ/mol。
CO(g)+H2(g)的△H=131.3kJ/mol。
①该反应是反应__________ (填“吸热”或“放热”)。
②若反应消耗24g C(s),则反应的热效应为__________ 。
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol通入容积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
① 2min内,v(CO)=__________ 。
②该温度下,此反应的平衡常数表达式K=_________ 。
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),达到平衡时CO的体积分数_____ (填“增大”、“减小”或“不变”)。
(4)下图为直流电源电解CuSO4溶液的装置,C1和C2都为石墨电极,请回答下列问题:
① C1作_________ (填“阳极”或”阴极”)。
② C2极电极反应式为____________ 。
①CH3COOH的电离方程式为
②CH3COONa溶液呈碱性,原因是
③在CH3COONa溶液中,c(Na+)
(2)已知:反应C(s)+H2O(g)
 CO(g)+H2(g)的△H=131.3kJ/mol。
CO(g)+H2(g)的△H=131.3kJ/mol。①该反应是反应
②若反应消耗24g C(s),则反应的热效应为
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol通入容积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:t/min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
① 2min内,v(CO)=
②该温度下,此反应的平衡常数表达式K=
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),达到平衡时CO的体积分数
(4)下图为直流电源电解CuSO4溶液的装置,C1和C2都为石墨电极,请回答下列问题:
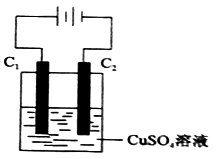
① C1作
② C2极电极反应式为
更新时间:2017-04-27 18:32:31
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】随着环保意识增强,清洁能源越来越受到人们关注。
(1)甲烷是一种理想的洁净燃料。已知:CH4(g)+2O2(g)= CO2(g)+ 2H2O(g);△H= -802.3kJ·mol-1 H2O(1)=H2O(g),△H =+44.0kJ·mol-l
写出常温常压下甲烷完全燃烧的热化学方程式____ ,计算4.8g甲烷气体完全燃烧生成液态水,放出热量为____ kJ。
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。该反应为CH4(g)+H2O(g) CO(g)+3H2(g)△H=+206.lkJ·mol-l。
CO(g)+3H2(g)△H=+206.lkJ·mol-l。
①800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表。
则此时正、逆反应速率的关系是正反应速率____ 逆反应速率。(填“>”、“<”、“=”)
②为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
表中t=___ ,P=____ ;设计实验2、3的目的是____ ;实验l、2、3中反应的化学平衡常数的大小关系是____ (用K1、K2、K3表示)。
(1)甲烷是一种理想的洁净燃料。已知:CH4(g)+2O2(g)= CO2(g)+ 2H2O(g);△H= -802.3kJ·mol-1 H2O(1)=H2O(g),△H =+44.0kJ·mol-l
写出常温常压下甲烷完全燃烧的热化学方程式
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。该反应为CH4(g)+H2O(g)
 CO(g)+3H2(g)△H=+206.lkJ·mol-l。
CO(g)+3H2(g)△H=+206.lkJ·mol-l。①800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表。
| CH4 | H2O | CO | H2 |
| 3.0 mol•L‾1 | 8.5 mol•L‾1 | 2.0 mol•L‾1 | 2.0 mol•L‾1 |
则此时正、逆反应速率的关系是正反应速率
②为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ mol•L‾1 | H2O初始浓度/ mol•L‾1 |
| 1 | 360 | p | 2.00 | 6.80 |
| 2 | t | 101 | 2.00 | 6.80 |
| 3 | 360 | 101 | 2.00 | 6.80 |
表中t=
您最近一年使用:0次
【推荐2】回答下列问题:
Ⅰ.一定条件下, 可以转化为
可以转化为 ,再通过电解
,再通过电解 获得
获得 ,实现
,实现 的再生。
的再生。
已知:①

②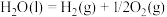

请回答:
(1)反应②属于___________ (填“吸热”或“放热”)反应。
(2)反应①消耗
 时,反应
时,反应___________ (填“吸收”或“放出”)热量,其数值为___________ kJ。
(3)反应②热量变化为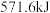 时,生成
时,生成 的质量为
的质量为___________ g。
(4)反应

___________  。
。
Ⅱ.已知强酸稀溶液与强碱稀溶液发生反应的热化学方程式为

(5)下列各组试剂混合发生反应的离子方程式为 的是___________(填序号)。
的是___________(填序号)。
(6)如图所示,某反应在不同条件下的反应历程分别为a、b。
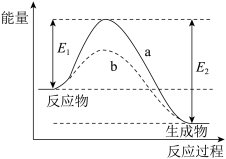
据图可判断出反应物的总键能___________ (填“>”“<”或“=”,下同)生成物的总键能,则该反应的反应热
___________ 0。
Ⅰ.一定条件下,
 可以转化为
可以转化为 ,再通过电解
,再通过电解 获得
获得 ,实现
,实现 的再生。
的再生。已知:①


②
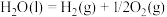

请回答:
(1)反应②属于
(2)反应①消耗

 时,反应
时,反应(3)反应②热量变化为
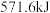 时,生成
时,生成 的质量为
的质量为(4)反应


 。
。Ⅱ.已知强酸稀溶液与强碱稀溶液发生反应的热化学方程式为


(5)下列各组试剂混合发生反应的离子方程式为
 的是___________(填序号)。
的是___________(填序号)。| A.盐酸与氢氧化钠溶液 | B.稀硫酸与氢氧化钡溶液 |
| C.醋酸与氢氧化钠固体 | D.氢氧化镁溶于稀盐酸 |

据图可判断出反应物的总键能

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】生产生活中的化学反应都伴随能量的变化,请回答下列问题。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途,制作冷敷袋可以利用___________ (填“放热”或“吸热”)的化学变化或物理变化。
(2)天然气中含有的微量 会腐蚀管道和设备,在
会腐蚀管道和设备,在 下进行脱硫处理,
下进行脱硫处理, 会被氧气氧化为
会被氧气氧化为 ,并产生水蒸气。
,并产生水蒸气。
写出该反应的热化学方程式:___________
(3)汽车尾气中排放的 和
和 会污染环境,在汽车尾气系统中装置催化转化器,可有效降低
会污染环境,在汽车尾气系统中装置催化转化器,可有效降低 和
和 的排放。已知:
的排放。已知:
Ⅰ.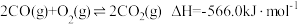
Ⅱ.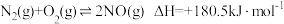
Ⅲ.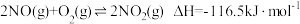
① 的燃烧热为
的燃烧热为___________  。
。
② 将
将 还原为单质的热化学方程式为
还原为单质的热化学方程式为___________ 。
③下图是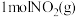 和
和 反应生成
反应生成 和
和 过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是___________ (填“增大”、“减小”或“不变”,下同), 的变化是
的变化是___________ 。


(4)实验室利用如上图装置进行中和热的测定。
①图中还缺少一个玻璃仪器,名称为___________ 。
②在操作正确的前提下,提高中和热测定准确性的关键是___________ 。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途,制作冷敷袋可以利用
(2)天然气中含有的微量
 会腐蚀管道和设备,在
会腐蚀管道和设备,在 下进行脱硫处理,
下进行脱硫处理, 会被氧气氧化为
会被氧气氧化为 ,并产生水蒸气。
,并产生水蒸气。| 化学键 | 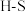 |  |  |  中共价键 中共价键 |
键能/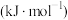 | 339 | 498 | 464 | 1083 |
写出该反应的热化学方程式:
(3)汽车尾气中排放的
 和
和 会污染环境,在汽车尾气系统中装置催化转化器,可有效降低
会污染环境,在汽车尾气系统中装置催化转化器,可有效降低 和
和 的排放。已知:
的排放。已知:Ⅰ.
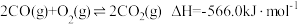
Ⅱ.
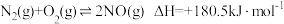
Ⅲ.
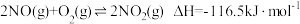
①
 的燃烧热为
的燃烧热为 。
。②
 将
将 还原为单质的热化学方程式为
还原为单质的热化学方程式为③下图是
 和
和 反应生成
反应生成 和
和 过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是 的变化是
的变化是

(4)实验室利用如上图装置进行中和热的测定。
①图中还缺少一个玻璃仪器,名称为
②在操作正确的前提下,提高中和热测定准确性的关键是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
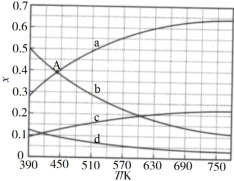
图中,表示C2H4、CO2变化的曲线分别是___ 、___ 。CO2催化加氢合成C2H4反应的ΔH___ 0(填“大于”或“小于”)。
(2)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=___ (MPa)−3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(1)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。

图中,表示C2H4、CO2变化的曲线分别是
(2)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】尿素(H2NCONH2)是一种非常重要的高氮化肥,氨基甲酸铵(NH2COONH4)是尿素合成过程的中间体,某研究小组在实验室进行氨基甲酸铵分解反应平衡常数和分解反应速率的测定。
(1)工业上合成尿素的反应:2NH3(g)+CO2(g) H2O(1)+H2NCONH4(1) ΔH=-103.7kJ·mol-1
H2O(1)+H2NCONH4(1) ΔH=-103.7kJ·mol-1
①上述可逆反应的逆反应为_______ (填“放热”或“吸热”)反应
②下列措施中有利于提高尿素产率的是_______ (填字母)。
A.采用高压 B.采用高温 C.寻找更高效的催化剂
(2)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g) ΔH。
2NH3(g)+CO2(g) ΔH。
实验测得不同温度下的平衡数据列于下表:
①ΔH_______ (填“>”或“<”)
②根据表中数据,计算25.0℃时氨基甲酸铵分解反应的平衡常数K=_______ (mol·L-1)3。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下分解应达到平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量_______ (填“增加“减少”或“不变”)。
(1)工业上合成尿素的反应:2NH3(g)+CO2(g)
 H2O(1)+H2NCONH4(1) ΔH=-103.7kJ·mol-1
H2O(1)+H2NCONH4(1) ΔH=-103.7kJ·mol-1①上述可逆反应的逆反应为
②下列措施中有利于提高尿素产率的是
A.采用高压 B.采用高温 C.寻找更高效的催化剂
(2)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
 2NH3(g)+CO2(g) ΔH。
2NH3(g)+CO2(g) ΔH。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/(mol/L) | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
②根据表中数据,计算25.0℃时氨基甲酸铵分解反应的平衡常数K=
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下分解应达到平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】医用口罩是预防新冠病毒感染的“明星”,其主要原材料是聚丙烯。工业上制备丙烯的化学原理是
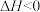 ,在密闭容器中发生上述反应,
,在密闭容器中发生上述反应, ,
,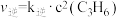 ,其中,
,其中,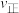 、
、 分别为正、逆反应速率,
分别为正、逆反应速率, 、
、 分别为正、逆反应速率常数,c为浓度。
分别为正、逆反应速率常数,c为浓度。
(1)已知:瑞典化学家阿伦尼乌斯的化学反应速率常数与温度之间关系的经验公式为 (其中,k为速率常数,A、R为常数,
(其中,k为速率常数,A、R为常数, 为活化能,T为绝对温度,e为自然对数的底)。下列有关速率常数k的说法正确的是___________(填字母)。
为活化能,T为绝对温度,e为自然对数的底)。下列有关速率常数k的说法正确的是___________(填字母)。
(2)一定条件下,向某密闭容器中投入一定量 和
和 发生上述反应,平衡常数
发生上述反应,平衡常数
___________ (用 、
、 表示);升高温度,
表示);升高温度,
___________ (填“增大”“减小”“不变”或“不确定”)。
(3)向三个体积相同的恒容密闭容器中充入 和
和 发生上述反应,测得有关数据如下:
发生上述反应,测得有关数据如下:

___________  (填“>”“<”或“=”,下同);a
(填“>”“<”或“=”,下同);a___________ 1.0。

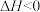 ,在密闭容器中发生上述反应,
,在密闭容器中发生上述反应, ,
,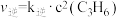 ,其中,
,其中,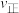 、
、 分别为正、逆反应速率,
分别为正、逆反应速率, 、
、 分别为正、逆反应速率常数,c为浓度。
分别为正、逆反应速率常数,c为浓度。(1)已知:瑞典化学家阿伦尼乌斯的化学反应速率常数与温度之间关系的经验公式为
 (其中,k为速率常数,A、R为常数,
(其中,k为速率常数,A、R为常数, 为活化能,T为绝对温度,e为自然对数的底)。下列有关速率常数k的说法正确的是___________(填字母)。
为活化能,T为绝对温度,e为自然对数的底)。下列有关速率常数k的说法正确的是___________(填字母)。A.其它条件不变,升高温度, 增大, 增大, 减小 减小 |
B.其它条件不变,加入催化剂, 、 、 同倍数增大 同倍数增大 |
C.其它条件不变,增大反应物浓度, 增大, 增大, 不变 不变 |
D.其它条件不变,增大压强, 、 、 都增大 都增大 |
 和
和 发生上述反应,平衡常数
发生上述反应,平衡常数
 、
、 表示);升高温度,
表示);升高温度,
(3)向三个体积相同的恒容密闭容器中充入
 和
和 发生上述反应,测得有关数据如下:
发生上述反应,测得有关数据如下:| 容器 | 温度/K | 起始时物质的物质的量/mol | 平衡时物质的物质的量/ mol | |
 |  | 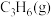 | ||
| Ⅰ |  | 1 | 2 | 0.50 |
| Ⅱ |  | 1 | 2 | 0.80 |
| Ⅲ |  | 2 | 4 | a |

 (填“>”“<”或“=”,下同);a
(填“>”“<”或“=”,下同);a
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】描述弱电解质电离情况可以用电离度和电离平衡常数表示,常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),几种难(微)溶物的溶度积常数(Ksp)。
请回答下列问题
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,电离常数不变__________(填字母序号)。
(2)CH3COONH4的水溶液呈__________ (填“酸性”、“中性”或“碱性”),该溶液中存在的各离子 浓度大小关系排序是__________ 。
(3)物质的量之比为 的
的 和
和 的混合溶液,该溶液中各
的混合溶液,该溶液中各离子 浓度从大到小的列排列为__________ 。
(4)工业中常将 转化为
转化为 ,具体做法是用饱和的纯碱溶液浸泡
,具体做法是用饱和的纯碱溶液浸泡 粉末,并不断补充纯碱,最后
粉末,并不断补充纯碱,最后 转化为
转化为 。
。
①写出该过程的离子方程式:__________ ;
②该反应的平衡常数为
__________ 。
酸或碱 | 电离平衡常数(Ka或Kb) | 难(微)溶物 | 溶度积常数(Ksp) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,电离常数不变__________(填字母序号)。
| A.升高温度 | B.加水稀释 |
| C.加少量的CH3COONa固体 | D.加少量冰醋酸 |
(3)物质的量之比为
 的
的 和
和 的混合溶液,该溶液中各
的混合溶液,该溶液中各(4)工业中常将
 转化为
转化为 ,具体做法是用饱和的纯碱溶液浸泡
,具体做法是用饱和的纯碱溶液浸泡 粉末,并不断补充纯碱,最后
粉末,并不断补充纯碱,最后 转化为
转化为 。
。①写出该过程的离子方程式:
②该反应的平衡常数为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】25℃时,部分物质的电离平衡常数如下表所示:
(1) 的电离方程式是
的电离方程式是_______ ,25℃时,物质的量浓度为 的氨水中,
的氨水中,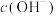 为
为_______ (列出算式即可)。
(2)常温下, 溶液呈
溶液呈_______ 性(填“酸”、“碱”“中”),请用化学用语解释_______ 。该溶液中离子浓度由大到小的顺序是_______ 。
(3)25℃时,物质的量浓度相等的 溶液和
溶液和 溶液
溶液 大小关系是:
大小关系是:
_______  (填“>”、“
(填“>”、“ ”、“<”或“=”)。
”、“<”或“=”)。
(4)向 溶液中通入少量二氧化碳气体,发生反应的离子方程式是
溶液中通入少量二氧化碳气体,发生反应的离子方程式是_______ 。
| 化学式 |  |  |  |  |
| 电离平衡常数 |  |  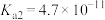 |  |  |
 的电离方程式是
的电离方程式是 的氨水中,
的氨水中,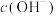 为
为(2)常温下,
 溶液呈
溶液呈(3)25℃时,物质的量浓度相等的
 溶液和
溶液和 溶液
溶液 大小关系是:
大小关系是:
 (填“>”、“
(填“>”、“ ”、“<”或“=”)。
”、“<”或“=”)。(4)向
 溶液中通入少量二氧化碳气体,发生反应的离子方程式是
溶液中通入少量二氧化碳气体,发生反应的离子方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】下表是几种常见弱酸的电离平衡常数:
(1)Na2C2O4水解的离子方程式为__________________ 。
(2)①常温下,用0.200 mol/L NaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,滴定曲线如图,c点所示溶液中:

该草酸溶液的物质的量浓度为____________ 。
②c点所示溶液中,c(Na+)、c(H+)、c(OH-)、c( )、c(
)、c( )各离子的浓度由大到小的顺序为
)各离子的浓度由大到小的顺序为_________ 。
(3)以下反应的离子方程式书写正确的是_____ 。
A 次氯酸钠溶液吸收少量二氧化硫:ClO-+SO2+H2O=HClO+
B 漂白液生效的原理:ClO-+CO2+H2O=HClO+
C Na2CO3溶液吸收少量SO2:2 +SO2+H2O=
+SO2+H2O= +2
+2
(4)已知100℃时,水离子积为1×10-12,将此温度下pH=1的H2SO4溶液b L与pH=11的NaOH溶液a L混合,若所得混合液pH=2,则a:b=____________ 。
(5)常温下,将SO2通入氨水中,当溶液中的 =50/33时,此时使溶液的PH为
=50/33时,此时使溶液的PH为____ 。
| 化学式 | CH3COOH | H2SO3 | HClO | H2CO3 | H2C2O4 |
| 电离平衡常数 | K =1.8×10-5 | K1=1.2×10-2 K2=6.6 ×10-8 | K =3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.4×10-5 |
(2)①常温下,用0.200 mol/L NaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,滴定曲线如图,c点所示溶液中:


该草酸溶液的物质的量浓度为
②c点所示溶液中,c(Na+)、c(H+)、c(OH-)、c(
 )、c(
)、c( )各离子的浓度由大到小的顺序为
)各离子的浓度由大到小的顺序为(3)以下反应的离子方程式书写正确的是
A 次氯酸钠溶液吸收少量二氧化硫:ClO-+SO2+H2O=HClO+

B 漂白液生效的原理:ClO-+CO2+H2O=HClO+

C Na2CO3溶液吸收少量SO2:2
 +SO2+H2O=
+SO2+H2O= +2
+2
(4)已知100℃时,水离子积为1×10-12,将此温度下pH=1的H2SO4溶液b L与pH=11的NaOH溶液a L混合,若所得混合液pH=2,则a:b=
(5)常温下,将SO2通入氨水中,当溶液中的
 =50/33时,此时使溶液的PH为
=50/33时,此时使溶液的PH为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】对某滴有酚酞的饱和NaCl溶液在如图装置中进行电解,回答下列问题:

(1)C极现象为___________ ,Fe极(含其周围的溶液)现象为:_____________________ 。
(2)若电解一段时间以后,将电源反接,C极电极反应式为:___________________ ,溶液中可以观察到的现象是:_____________________________________________ 。再向该溶液中通入O2,又会观察到的现象是:________________________________________________ 。

(1)C极现象为
(2)若电解一段时间以后,将电源反接,C极电极反应式为:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】我国科学家设计了流式电解槽,直接将 送至电极表面,电还原
送至电极表面,电还原 制备有机物甲烷、乙烯、甲酸、乙酸、乙醇等,装置如图所示。
制备有机物甲烷、乙烯、甲酸、乙酸、乙醇等,装置如图所示。

回答下列问题:
(1)X极是_______ 极(填“阳”或“阴”),发生_______ (填“氧化”或“还原”)反应。
(2)电解槽工作时,氢离子由_______ 极区向_______ 极区迁移(填“X”或“Y”)。
(3)若M为 ,则Y极的电极反应式为
,则Y极的电极反应式为_______ 。
(4)若M为 ,则Y极的电极反应式为
,则Y极的电极反应式为_______ 。
(5)若Y极上生成1 mol ,则理论上得到
,则理论上得到_______ mol电子。
 送至电极表面,电还原
送至电极表面,电还原 制备有机物甲烷、乙烯、甲酸、乙酸、乙醇等,装置如图所示。
制备有机物甲烷、乙烯、甲酸、乙酸、乙醇等,装置如图所示。
回答下列问题:
(1)X极是
(2)电解槽工作时,氢离子由
(3)若M为
 ,则Y极的电极反应式为
,则Y极的电极反应式为(4)若M为
 ,则Y极的电极反应式为
,则Y极的电极反应式为(5)若Y极上生成1 mol
 ,则理论上得到
,则理论上得到
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】某小组同学认为,可以模拟工业上离子交换膜法制烧碱的方法,利用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

(1)该电解池的阳极反应式为___________ ,此时通过阴离子交换膜的离子数___________ (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
(2)制得的KOH溶液从出口___________ (填“A”“B”“C”或“D”)导出。
(3)通电开始后,阴极附近溶液的pH会增大,请简述原因___________ 。
(4)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的反应式为___________ 。

(1)该电解池的阳极反应式为
(2)制得的KOH溶液从出口
(3)通电开始后,阴极附近溶液的pH会增大,请简述原因
(4)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的反应式为
您最近一年使用:0次