二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
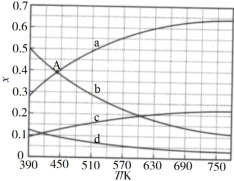
图中,表示C2H4、CO2变化的曲线分别是___ 、___ 。CO2催化加氢合成C2H4反应的ΔH___ 0(填“大于”或“小于”)。
(2)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=___ (MPa)−3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(1)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。

图中,表示C2H4、CO2变化的曲线分别是
(2)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=
2021高三·全国·专题练习 查看更多[1]
(已下线)难点3 化学反应速率与化学平衡图表分析-2021年高考化学专练【热点·重点·难点】
更新时间:2021-05-17 21:12:27
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为________________________________ 。
(2)COCl2的分解反应为COCl2(g) = Cl2(g) + CO(g) △H = + 108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):

①计算反应在第8 min 时的平衡常数K =_______ ;
②比较第2 min 反应温度T(2)与第8 min反应温度T(8)的高低:T(2)___ T(8)(填“<”、“>”或“=”);
③若12 min 时反应于温度T(8)下重新达到平衡,则此时c(COCl2) =_______ mol·l-1;
④比较反应物COCl2在5~6 min和15~16 min时平均反应速率的大小v(5~6)_______ v(12~13) (填“<”、“>”或“=”),原因是___________ 。
(1)实验室中常用来制备氯气的化学方程式为
(2)COCl2的分解反应为COCl2(g) = Cl2(g) + CO(g) △H = + 108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):

①计算反应在第8 min 时的平衡常数K =
②比较第2 min 反应温度T(2)与第8 min反应温度T(8)的高低:T(2)
③若12 min 时反应于温度T(8)下重新达到平衡,则此时c(COCl2) =
④比较反应物COCl2在5~6 min和15~16 min时平均反应速率的大小v(5~6)
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】羰基硫(COS)能引起催化剂中毒,使化学产品质量下降并引发大气污染,因此工业排放COS前必须对其进行脱硫处理,发生的反应如下:COS(g)+H2(g) H2S(g)+CO(g) 。.
H2S(g)+CO(g) 。.
(1)在480 K 时,将0.l0mol COS(g) 与0.40mol H2(g)充入2.5 L 的空钢瓶中,反应达到平衡后H2S 的物质的量分数为2%。
①COS的平衡转化率a1=_________ %。
②在500 K 时重复实验,测得平衡后H2S的物质的量分数为3%,则COS的转化率a2____________ (填“>”“<”或“=”,下同)a1,该反应的△H________ 0。
(2)若分别向钢瓶中再充入下列气体,能使COS转化率增大的是___________ (填字母)。
A.COS B.H2 C.H2S D.N2
 H2S(g)+CO(g) 。.
H2S(g)+CO(g) 。.(1)在480 K 时,将0.l0mol COS(g) 与0.40mol H2(g)充入2.5 L 的空钢瓶中,反应达到平衡后H2S 的物质的量分数为2%。
①COS的平衡转化率a1=
②在500 K 时重复实验,测得平衡后H2S的物质的量分数为3%,则COS的转化率a2
(2)若分别向钢瓶中再充入下列气体,能使COS转化率增大的是
A.COS B.H2 C.H2S D.N2
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知2A2(g)+B2(g) 2C3(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为ω mol·L-1,放出热量b kJ。
2C3(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为ω mol·L-1,放出热量b kJ。
(1)比较a___________ b(填“>”“=”或“<”)。
(2)若将反应温度升高到700 ℃,该反应A的转化率将___________ (填“增大”“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是___________
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的操作是___________
 2C3(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为ω mol·L-1,放出热量b kJ。
2C3(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为ω mol·L-1,放出热量b kJ。(1)比较a
(2)若将反应温度升高到700 ℃,该反应A的转化率将
(3)能说明该反应已经达到平衡状态的是___________
| A.v(C3)=2v(B2) | B.容器内压强保持不变 |
| C.v逆(A2)=2v正(B2) | D.容器内的密度保持不变 |
| A.及时分离出C3气体 | B.适当升高温度 |
| C.增大B2的浓度 | D.选择高效的催化剂 |
您最近一年使用:0次
【推荐1】Ⅰ.炽热的碳与水蒸气可发生反应:C(s)+H2O(g) H2(g)+CO(g),该反应对煤的综合利用具有积极的研究意义。
H2(g)+CO(g),该反应对煤的综合利用具有积极的研究意义。
(1)已知碳(石墨)、H2、CO的燃烧热分别为393.5 kJ·mol-1、285.8 kJ·mol-1、283 kJ·mol-1,又知H2O(l)=H2O(g) ΔH′=+44 kJ·mol-1,则C(s)+H2O(g) CO(g)+H2(g) ΔH=
CO(g)+H2(g) ΔH=__________ 。
Ⅱ.一定温度下,在体积为V L的密闭容器中加入足量活性炭,并充入x mol H2O(g)发生上述反应,反应时间与容器内气体总压强的数据如下表。
(2)平衡时,容器中气体总物质的量为________ mol,H2O(g)的转化率为________ 。
(3)该温度下反应的平衡常数K=________ 。
(4)保持恒温、恒压,向容器内充入少量N2,H2O的转化率将________ (填“增大”“减小”或“不变”)。
(5)保持恒温、恒容,在40 min时再充入H2,50 min时再次达到平衡,反应过程中各物质的浓度随时间变化如图所示。
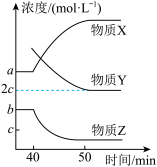
①物质X为________ 。
②50 min时,CO的浓度为________ mol·L-1。
 H2(g)+CO(g),该反应对煤的综合利用具有积极的研究意义。
H2(g)+CO(g),该反应对煤的综合利用具有积极的研究意义。(1)已知碳(石墨)、H2、CO的燃烧热分别为393.5 kJ·mol-1、285.8 kJ·mol-1、283 kJ·mol-1,又知H2O(l)=H2O(g) ΔH′=+44 kJ·mol-1,则C(s)+H2O(g)
 CO(g)+H2(g) ΔH=
CO(g)+H2(g) ΔH=Ⅱ.一定温度下,在体积为V L的密闭容器中加入足量活性炭,并充入x mol H2O(g)发生上述反应,反应时间与容器内气体总压强的数据如下表。
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/100 kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
(3)该温度下反应的平衡常数K=
(4)保持恒温、恒压,向容器内充入少量N2,H2O的转化率将
(5)保持恒温、恒容,在40 min时再充入H2,50 min时再次达到平衡,反应过程中各物质的浓度随时间变化如图所示。

①物质X为
②50 min时,CO的浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】在80℃时,将0.40 mol的四氧化二氮气体充入2 L的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)该反应的化学方程式为________________________ 。
(2)该反应在0~20 s内N2O4的平均反应速率为____________ 。
(3)在80℃时该反应的平衡常数K值为______________ 。
(4)在20s时,浓度熵Qc_________ (填“>”、“<”或“=”)平衡常数K。
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/mol·L-1 | 0.20 | a | 0.10 | c | d | e |
| c(NO2)/mol·L-1 | 0.00 | 0.12 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)该反应的化学方程式为
(2)该反应在0~20 s内N2O4的平均反应速率为
(3)在80℃时该反应的平衡常数K值为
(4)在20s时,浓度熵Qc
您最近一年使用:0次
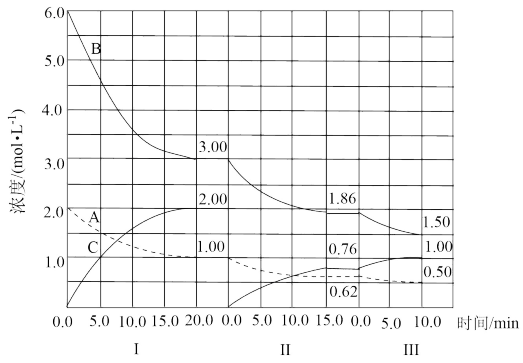
【推荐3】反应:aA(g)+bB(g) cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
回答问题:
(1)反应的化学方程式中,a∶b∶c为__________ ;
(2)第Ⅱ阶段初改变的条件是________________________ ;
(3)第III阶段改变的条件是________________________ ;
(4)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是_______ ,其值是_______ ;
(5)第Ⅲ阶段平衡常数K=_______ (保留2位小数)。
 cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
回答问题:
(1)反应的化学方程式中,a∶b∶c为
(2)第Ⅱ阶段初改变的条件是
(3)第III阶段改变的条件是
(4)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是
(5)第Ⅲ阶段平衡常数K=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】对 于2NO2(g) N2O4(g) 的反应体系,在压强一定时,平衡体系中N2O4的质量分数w(N2O4) 随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态)。
N2O4(g) 的反应体系,在压强一定时,平衡体系中N2O4的质量分数w(N2O4) 随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态)。
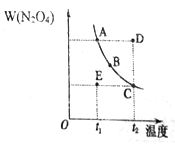
(1)该反应的正反应方向是一个______ 反应(填“吸热”或“放热”)。
(2)A、B、C、D、E 各状态中,v(正)逆)的是_________ 。
(3)维持t1不变,E→A所需时间为x, 维持t2不变,D→C所需时间为y.则x_____ y(填“<”、“>”或“=”)。
 N2O4(g) 的反应体系,在压强一定时,平衡体系中N2O4的质量分数w(N2O4) 随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态)。
N2O4(g) 的反应体系,在压强一定时,平衡体系中N2O4的质量分数w(N2O4) 随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态)。
(1)该反应的正反应方向是一个
(2)A、B、C、D、E 各状态中,v(正)逆)的是
(3)维持t1不变,E→A所需时间为x, 维持t2不变,D→C所需时间为y.则x
您最近一年使用:0次
填空题
|
适中
(0.65)
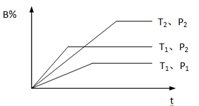
【推荐2】可逆反应mA(g)+nB(g)⇌pC(g)+qD(g)的相关物质体积分数的变化图像如下,请回答下列问题:

(1)温度T1_______ T2(填“>”、“<”或“=”,下同)。
(2)压强p1_______ p2。
(3)m+n_______ p+q。
(4)正反应为_______ (填“放热”或“吸热”)反应。

(1)温度T1
(2)压强p1
(3)m+n
(4)正反应为
您最近一年使用:0次