1 . 研究含氮化合物对消除环境污染,能源结构的改变,食品添加剂的研究等有重要意义。
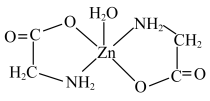
(1)甘氨酸锌常用于食品的添加剂,也可代替甘油作烟丝的加香、防冻。一水合甘氨酸锌结构简式如图所示。___________ 。
②N、O、C、Zn元素的第一电离能由大到小的顺序为___________ 。
(2)“中国制造2025”是中国政府实施制造强国战略第一个十年行动领。氮化铬在现代工业中发挥了重要作用。
①基态N原子的价层电子排布图为___________ 。
②基态Cr原子的价层电子排布式为___________ 。
(3)NO在空气中存在如下反应: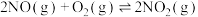 ,该反应分两步完成,其反应历程如图所示。决定总反应速率的这一步反应的热化学方程式为
,该反应分两步完成,其反应历程如图所示。决定总反应速率的这一步反应的热化学方程式为___________ 。 、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:
、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:
I.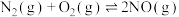

Ⅱ.

若CO的燃烧热为283.5kJ/mol,则反应I的
___________ kJ/mol。
(5)室温下,用氨水将 转化为
转化为 ,实验测得
,实验测得 溶液中
溶液中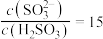 ,则溶液的pH为
,则溶液的pH为___________ 。(已知: 的
的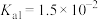 ,
,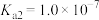 )
)
(6)若T℃时,pH=2的醋酸溶液中由水电离出的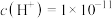 ,将此温度下
,将此温度下 的HCl溶液与
的HCl溶液与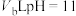 的NaOH溶液混合后pH=3,则
的NaOH溶液混合后pH=3,则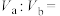
___________ 。
(1)甘氨酸锌常用于食品的添加剂,也可代替甘油作烟丝的加香、防冻。一水合甘氨酸锌结构简式如图所示。
②N、O、C、Zn元素的第一电离能由大到小的顺序为
(2)“中国制造2025”是中国政府实施制造强国战略第一个十年行动领。氮化铬在现代工业中发挥了重要作用。
①基态N原子的价层电子排布图为
②基态Cr原子的价层电子排布式为
(3)NO在空气中存在如下反应:
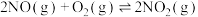 ,该反应分两步完成,其反应历程如图所示。决定总反应速率的这一步反应的热化学方程式为
,该反应分两步完成,其反应历程如图所示。决定总反应速率的这一步反应的热化学方程式为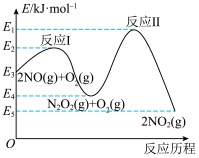
 、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:
、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:I.
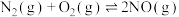

Ⅱ.


若CO的燃烧热为283.5kJ/mol,则反应I的

(5)室温下,用氨水将
 转化为
转化为 ,实验测得
,实验测得 溶液中
溶液中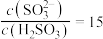 ,则溶液的pH为
,则溶液的pH为 的
的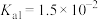 ,
,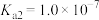 )
)(6)若T℃时,pH=2的醋酸溶液中由水电离出的
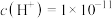 ,将此温度下
,将此温度下 的HCl溶液与
的HCl溶液与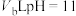 的NaOH溶液混合后pH=3,则
的NaOH溶液混合后pH=3,则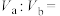
您最近半年使用:0次
解题方法
2 . 在催化剂的作用下,利用合成气(主要成分为CO、 和
和 )合成甲醇时涉及了如下反应:
)合成甲醇时涉及了如下反应:
反应Ⅰ.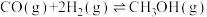
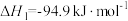
反应Ⅱ.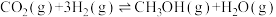
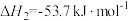
反应Ⅲ.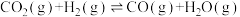
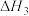
回答下列问题:
(1)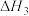 =
=______  。
。
某温度下,盛有1mol CO的密闭容器通入 发生反应Ⅰ,测得平衡时
发生反应Ⅰ,测得平衡时 (g)的体积分数变化如图所示。
(g)的体积分数变化如图所示。 转化率最大的是
转化率最大的是_______ (填字母)。
(3)图中,n=______ mol,此时CO的转化率为50%,反应体系总压为pPa,则该温度下反应Ⅰ的平衡常数Kp=____ Pa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
一定条件下,某密闭容器中投入1mol 和3mol
和3mol 发生反应Ⅱ和Ⅲ。
发生反应Ⅱ和Ⅲ。
(4)升高反应体系温度,合成甲醇的反应速率______ (填“增大”“减小”或“不变”)。
(5)加入少量CO,平衡时甲醇的量____ (填“增多”“减少”或“不变”)。
(6)达到平衡后,缩小容器体积,反应Ⅲ的平衡______ (填“正向”“逆向”或“不”)移动。
改变温度和投气比[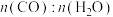 ]发生反应:
]发生反应: ,测得CO平衡转化率如表所示(其他反应条件相同)。
,测得CO平衡转化率如表所示(其他反应条件相同)。
(7)a、b、c三点对应的反应温度由高到低顺序是_____ 。
研究表明,反应 的速率方程为
的速率方程为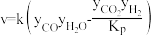 ,式中yCO、yH2O、yCO2、yH2分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。
,式中yCO、yH2O、yCO2、yH2分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。 时v逐渐减小的原因是
时v逐渐减小的原因是________ 。
 和
和 )合成甲醇时涉及了如下反应:
)合成甲醇时涉及了如下反应:反应Ⅰ.
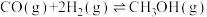
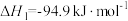
反应Ⅱ.
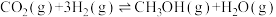
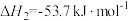
反应Ⅲ.
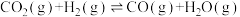
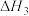
回答下列问题:
(1)
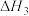 =
= 。
。某温度下,盛有1mol CO的密闭容器通入
 发生反应Ⅰ,测得平衡时
发生反应Ⅰ,测得平衡时 (g)的体积分数变化如图所示。
(g)的体积分数变化如图所示。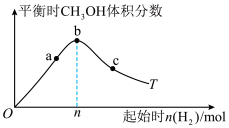
 转化率最大的是
转化率最大的是(3)图中,n=
一定条件下,某密闭容器中投入1mol
 和3mol
和3mol 发生反应Ⅱ和Ⅲ。
发生反应Ⅱ和Ⅲ。(4)升高反应体系温度,合成甲醇的反应速率
(5)加入少量CO,平衡时甲醇的量
(6)达到平衡后,缩小容器体积,反应Ⅲ的平衡
改变温度和投气比[
 ]发生反应:
]发生反应: ,测得CO平衡转化率如表所示(其他反应条件相同)。
,测得CO平衡转化率如表所示(其他反应条件相同)。| 平衡点 | a | b | c |
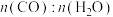 | 0.5 | 0.5 | 1 |
| CO平衡转化率 | 50 | 33.3 | 50 |
(7)a、b、c三点对应的反应温度由高到低顺序是
研究表明,反应
 的速率方程为
的速率方程为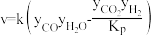 ,式中yCO、yH2O、yCO2、yH2分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。
,式中yCO、yH2O、yCO2、yH2分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。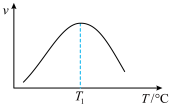
 时v逐渐减小的原因是
时v逐渐减小的原因是
您最近半年使用:0次
3 . 将 还原转化为有用的化学产品是目前研究的热点之一、回答下列问题:
还原转化为有用的化学产品是目前研究的热点之一、回答下列问题:
Ⅰ.用铜铝催化剂可将 加氢合成甲醇,已知过程中发生的反应如下:
加氢合成甲醇,已知过程中发生的反应如下:
ⅰ.


ⅱ.


ⅲ.


(1)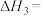
_____ (用含 、
、 的代数式表示),
的代数式表示),
_____ (用含 、
、 的代数式表示)。
的代数式表示)。
(2)查阅资料可知, ,则
,则_____ (填“低温"“商温”或“任意温度”)条件下有利于反应ⅲ自发进行。
Ⅱ. 和
和 以1:3的物质的量之比通入某密闭容器中,仅发生反应
以1:3的物质的量之比通入某密闭容器中,仅发生反应 ,
, 的平衡转化率与温度、气体的总压强的关系如图所示:
的平衡转化率与温度、气体的总压强的关系如图所示: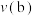
______ (填“>”“<”或“=”)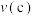 。
。
(4)平衡常数: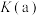
____ (填“>”“<”或“=”)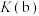 。
。
(5)压强:
______ (填“>”“<”或“=”) 。
。
(6)b点时,该反应的平衡常数
______ (分压=总压×物质的量分数,用含x、 的代数式表示)。
的代数式表示)。
Ⅲ.常温下,CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示: 和
和 的体积比为
的体积比为______ 。
 还原转化为有用的化学产品是目前研究的热点之一、回答下列问题:
还原转化为有用的化学产品是目前研究的热点之一、回答下列问题:Ⅰ.用铜铝催化剂可将
 加氢合成甲醇,已知过程中发生的反应如下:
加氢合成甲醇,已知过程中发生的反应如下:ⅰ.



ⅱ.



ⅲ.



(1)
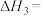
 、
、 的代数式表示),
的代数式表示),
 、
、 的代数式表示)。
的代数式表示)。(2)查阅资料可知,
 ,则
,则Ⅱ.
 和
和 以1:3的物质的量之比通入某密闭容器中,仅发生反应
以1:3的物质的量之比通入某密闭容器中,仅发生反应 ,
, 的平衡转化率与温度、气体的总压强的关系如图所示:
的平衡转化率与温度、气体的总压强的关系如图所示:
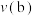
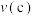 。
。(4)平衡常数:
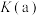
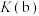 。
。(5)压强:

 。
。(6)b点时,该反应的平衡常数

 的代数式表示)。
的代数式表示)。Ⅲ.常温下,CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
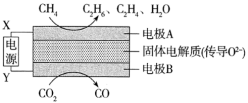
 和
和 的体积比为
的体积比为
您最近半年使用:0次
4 . 研发二氧化碳的利用技术,将二氧化碳转化为能源是减轻环境污染和解决能源问题的方案之一、回答下列问题:
(1)利用CO2合成二甲醚有两种工艺。
工艺1:
涉及以下主要反应:
反应Ⅰ.甲醇的合成:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
反应Ⅱ.逆水汽变换:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.0kJ/mol
CO(g)+H2O(g) △H2=+41.0kJ/mol
反应Ⅲ.甲醇脱水:2CH3OH(g) CH3OCH3(g)+H2O(g) △H3=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H3=-23.5kJ/mol
工艺2:反应Ⅳ.2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H
CH3OCH3(g)+3H2O(g) △H
①△H=___________ kJ/mol,反应Ⅳ在___________ (填“低温”“高温”或“任意温度”)下自发进行。
②反应Ⅳ的活化能Ea(正)___________ (填“>”“<"或“=”)Ea(逆)。
③在恒温恒容的密闭容器中,下列说法能判断反应Ⅳ达到平衡的是___________ (填标号)。
A.气体物质中碳元素与氧元素的质量比不变
B.容器内CH3OCH3浓度保持不变
C.容器内气体密度不变
D.容器内气体的平均摩尔质量不变
(2)在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇(反应Ⅰ),实验测得CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图甲、乙所示。___________ (填标号)。
A.图甲纵坐标表示CH3OH的平衡产率
B.p1<p2<p3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压条件
D.一定温度、压强下,提高CO2的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是___________ 。
(3)在T1温度下,将3molCO2和7molH2充人2L的恒容密闭容器中发生反应Ⅰ和Ⅳ,达到平衡状态时CH3OH(g)和CH3OCH3(g)的物质的量分别为1mol和0.5mol。
①反应经过10min达到平衡,0~10min内CO2的平均反应速率v(CO2)=___________ mol/(L·min)。
②T1温度时反应Ⅰ的平衡常数K=___________ 。
(1)利用CO2合成二甲醚有两种工艺。
工艺1:
涉及以下主要反应:
反应Ⅰ.甲醇的合成:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
CH3OH(g)+H2O(g) △H1=-49.0kJ/mol反应Ⅱ.逆水汽变换:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.0kJ/mol
CO(g)+H2O(g) △H2=+41.0kJ/mol反应Ⅲ.甲醇脱水:2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H3=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H3=-23.5kJ/mol工艺2:反应Ⅳ.2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H
CH3OCH3(g)+3H2O(g) △H①△H=
②反应Ⅳ的活化能Ea(正)
③在恒温恒容的密闭容器中,下列说法能判断反应Ⅳ达到平衡的是
A.气体物质中碳元素与氧元素的质量比不变
B.容器内CH3OCH3浓度保持不变
C.容器内气体密度不变
D.容器内气体的平均摩尔质量不变
(2)在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇(反应Ⅰ),实验测得CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图甲、乙所示。
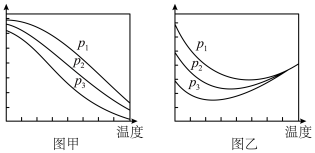
A.图甲纵坐标表示CH3OH的平衡产率
B.p1<p2<p3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压条件
D.一定温度、压强下,提高CO2的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是
(3)在T1温度下,将3molCO2和7molH2充人2L的恒容密闭容器中发生反应Ⅰ和Ⅳ,达到平衡状态时CH3OH(g)和CH3OCH3(g)的物质的量分别为1mol和0.5mol。
①反应经过10min达到平衡,0~10min内CO2的平均反应速率v(CO2)=
②T1温度时反应Ⅰ的平衡常数K=
您最近半年使用:0次
解题方法
5 . 回答下列问题。
(1)一定条件下,在 密闭容器中充入
密闭容器中充入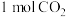 和
和 ,发生反应:
,发生反应: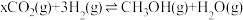 。测得
。测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。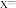
___________ ;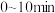 内
内 的平均反应速率
的平均反应速率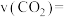
___________ 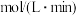 ,平衡时
,平衡时 的转化率为
的转化率为___________ 。
(2)下列措施能提高正反应速率的是___________(填正确答案的字母)。
(3)工业上常以水煤气( 和
和 )为原料合成甲醇。已知:
)为原料合成甲醇。已知: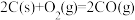
 ;
;
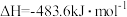 ,则
,则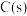 与
与 制备水煤气的热化学方程式为
制备水煤气的热化学方程式为___________ 。
(1)一定条件下,在
 密闭容器中充入
密闭容器中充入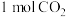 和
和 ,发生反应:
,发生反应: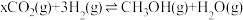 。测得
。测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。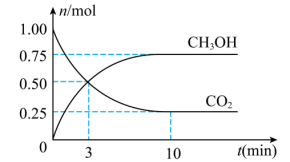
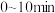 内
内 的平均反应速率
的平均反应速率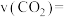
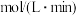 ,平衡时
,平衡时 的转化率为
的转化率为(2)下列措施能提高正反应速率的是___________(填正确答案的字母)。
| A.降低温度 | B.增加 的量 的量 | C.使用催化剂 | D.及时分离出甲醇 |
 和
和 )为原料合成甲醇。已知:
)为原料合成甲醇。已知: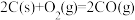
 ;
;
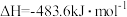 ,则
,则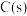 与
与 制备水煤气的热化学方程式为
制备水煤气的热化学方程式为
您最近半年使用:0次
6 . 已知胆矾晶体相关的焓变如图所示,则 为
为
 为
为
A.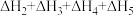 | B.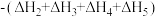 |
C.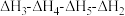 | D.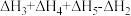 |
您最近半年使用:0次
7 . 已知① ②C2H5OH(g)=C2H5OH(l)
②C2H5OH(g)=C2H5OH(l) 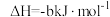 ,③
,③ (a、b、c均>0)。若使
(a、b、c均>0)。若使 酒精液体完全燃烧,最后恢复到室温,则放出的热量为(单位:
酒精液体完全燃烧,最后恢复到室温,则放出的热量为(单位: )
)
 ②C2H5OH(g)=C2H5OH(l)
②C2H5OH(g)=C2H5OH(l) 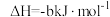 ,③
,③ (a、b、c均>0)。若使
(a、b、c均>0)。若使 酒精液体完全燃烧,最后恢复到室温,则放出的热量为(单位:
酒精液体完全燃烧,最后恢复到室温,则放出的热量为(单位: )
)A.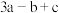 | B.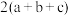 | C.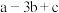 | D.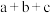 |
您最近半年使用:0次
8 . (1)已知:
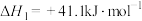


写出 催化氢化合成甲醇和水的热化学方程式:
催化氢化合成甲醇和水的热化学方程式:___________ ;
(2)恒温条件下,可逆反应: 在体积固定的密闭容器中进行,达到平衡状态的标志的是
在体积固定的密闭容器中进行,达到平衡状态的标志的是___________ ;
A.单位时间内生成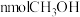 的同时生成
的同时生成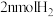
B.混合气体的密度不再改变的状态
C.混合气体的压强不再改变的状态
D.混合气体的平均摩尔质量不再改变的状态
E. 、
、 、
、 浓度之比为
浓度之比为 的状态。
的状态。
(3)工业上在恒容密闭容器中用下列反应合成甲醇:


①该反应的平衡常数表达式为___________ ;
②如表所列数据是反应在不同温度下的化学平衡常数( )
)
a.由表中数据判断该反应的
___________ 0(填“>”、“=”或“<”);
b.某温度下,将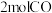 和
和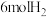 充入
充入 的密闭容器中,充分反应
的密闭容器中,充分反应 后达到平衡时测得
后达到平衡时测得 ,则
,则 的转化率为
的转化率为___________ ,此时的温度为___________ ;
③要提高 的转化率,可以采取的措施是
的转化率,可以采取的措施是___________ ;
a.升温 b.加入催化剂 c.增加 的浓度 d.恒容充入
的浓度 d.恒容充入 e.分离出甲醇
e.分离出甲醇

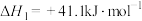


写出
 催化氢化合成甲醇和水的热化学方程式:
催化氢化合成甲醇和水的热化学方程式:(2)恒温条件下,可逆反应:
 在体积固定的密闭容器中进行,达到平衡状态的标志的是
在体积固定的密闭容器中进行,达到平衡状态的标志的是A.单位时间内生成
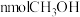 的同时生成
的同时生成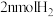
B.混合气体的密度不再改变的状态
C.混合气体的压强不再改变的状态
D.混合气体的平均摩尔质量不再改变的状态
E.
 、
、 、
、 浓度之比为
浓度之比为 的状态。
的状态。(3)工业上在恒容密闭容器中用下列反应合成甲醇:


①该反应的平衡常数表达式为
②如表所列数据是反应在不同温度下的化学平衡常数(
 )
)| 温度 | 250℃ | 300℃ | 350℃ |
 | 2.041 | 0.270 | 0.012 |

b.某温度下,将
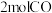 和
和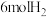 充入
充入 的密闭容器中,充分反应
的密闭容器中,充分反应 后达到平衡时测得
后达到平衡时测得 ,则
,则 的转化率为
的转化率为③要提高
 的转化率,可以采取的措施是
的转化率,可以采取的措施是a.升温 b.加入催化剂 c.增加
 的浓度 d.恒容充入
的浓度 d.恒容充入 e.分离出甲醇
e.分离出甲醇
您最近半年使用:0次
9 . 气态亚硝酸( 或HONO)是大气中的一种污染物。
或HONO)是大气中的一种污染物。
(1)亚硝酸的电离平衡常数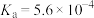 ,其电离方程式为
,其电离方程式为___________ 。
(2)亚硝酸进入人体可以与二甲胺[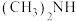 ]迅速反应生成亚硝酸胺[
]迅速反应生成亚硝酸胺[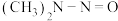 ],亚硝酸胺是一种化学致癌物。
],亚硝酸胺是一种化学致癌物。
①亚硝酸与二甲胺反应生成亚硝酸胺的一种反应机理如下:___________ 、消去反应。
②上述反应机理的反应过程与能量变化的关系如图所示。亚硝酸与二甲胺反应生成亚硝酸胺的△H___________ (填“>”或“<”)0。反应难度更大的是过程___________ (填“ⅰ”或“ⅱ”)。
①已知:
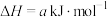 ;
;

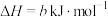 ;
;
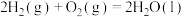
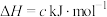 。
。
则反应 的∆H=
的∆H=___________  。
。
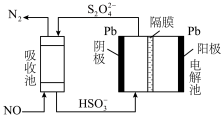
②用间接电化学法除去NO的过程如图所示。用离子方程式表示吸收池中除去NO的原理:___________ 。
 或HONO)是大气中的一种污染物。
或HONO)是大气中的一种污染物。(1)亚硝酸的电离平衡常数
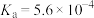 ,其电离方程式为
,其电离方程式为(2)亚硝酸进入人体可以与二甲胺[
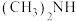 ]迅速反应生成亚硝酸胺[
]迅速反应生成亚硝酸胺[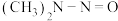 ],亚硝酸胺是一种化学致癌物。
],亚硝酸胺是一种化学致癌物。①亚硝酸与二甲胺反应生成亚硝酸胺的一种反应机理如下:
HONO+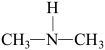

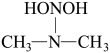


②上述反应机理的反应过程与能量变化的关系如图所示。亚硝酸与二甲胺反应生成亚硝酸胺的△H

①已知:

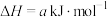 ;
;
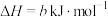 ;
;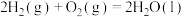
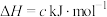 。
。则反应
 的∆H=
的∆H= 。
。②用间接电化学法除去NO的过程如图所示。用离子方程式表示吸收池中除去NO的原理:
您最近半年使用:0次
10 . 某团队报道了高温富水环境下,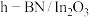 催化丙烷氧化脱氢原理,涉及反应如下:
催化丙烷氧化脱氢原理,涉及反应如下:
i.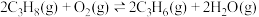
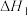
ii.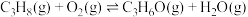
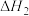
回答下列问题:
(1)上述反应过程中涉及的C、N、O元素可以组成多种配体,如CO、 、
、 等,CO、
等,CO、 的配位原子是C,而
的配位原子是C,而 的配位原子是N,简述其原因
的配位原子是N,简述其原因___________ 。
(2)已知:丙烷、丙烯的燃烧热分别为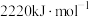 、
、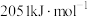 。18g液态水变为
。18g液态水变为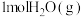 吸收热量44kJ。则
吸收热量44kJ。则
___________  。下列关于反应i自发性判断正确的是
。下列关于反应i自发性判断正确的是___________ (填标号)。
A.任何温度都能自发进行 B.任何温度都不能自发进行
C.在较高温度下能自发进行 D.在较低温度下能自发进行
(3)已知反应i速率方程为 (k为速率常数只与温度、催化剂有关;α、β、γ、δ为反应级数,可以为正数、负数或分数)。
(k为速率常数只与温度、催化剂有关;α、β、γ、δ为反应级数,可以为正数、负数或分数)。
①一定温度下,反应速率与浓度( )关系如下表所示:
)关系如下表所示:
根据数据计算,α+β+γ+δ=___________ 。
②速率常数与温度、活化能关系式为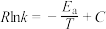 (R、C为常数,T为温度,
(R、C为常数,T为温度, 为活化能且不随温度变化而变化)。在不同催化剂Cat1、Cat2作用下,Ink与
为活化能且不随温度变化而变化)。在不同催化剂Cat1、Cat2作用下,Ink与 关系如图:
关系如图:___________ (填“Cat1”或“Cat2”)。
(4)在密闭容器中充入 和
和 ,仅发生上述反应i和ii,测得丙烷的平衡转化率与温度、压强关系如图所示:
,仅发生上述反应i和ii,测得丙烷的平衡转化率与温度、压强关系如图所示:___________ 。
② 下,A点丙烯的选择性为80%(选择性等于丙烯的物质的量与丙烷转化的总物质的量之比)。B点时,反应ii的压强平衡常数
下,A点丙烯的选择性为80%(选择性等于丙烯的物质的量与丙烷转化的总物质的量之比)。B点时,反应ii的压强平衡常数
___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)在熔融碳酸钠中,丙烷-空气燃料电池的放电效率高。该燃料电池放电时,负极的电极反应式为___________ 。
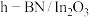 催化丙烷氧化脱氢原理,涉及反应如下:
催化丙烷氧化脱氢原理,涉及反应如下:i.
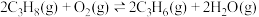
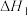
ii.
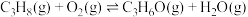
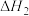
回答下列问题:
(1)上述反应过程中涉及的C、N、O元素可以组成多种配体,如CO、
 、
、 等,CO、
等,CO、 的配位原子是C,而
的配位原子是C,而 的配位原子是N,简述其原因
的配位原子是N,简述其原因(2)已知:丙烷、丙烯的燃烧热分别为
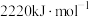 、
、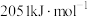 。18g液态水变为
。18g液态水变为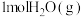 吸收热量44kJ。则
吸收热量44kJ。则
 。下列关于反应i自发性判断正确的是
。下列关于反应i自发性判断正确的是A.任何温度都能自发进行 B.任何温度都不能自发进行
C.在较高温度下能自发进行 D.在较低温度下能自发进行
(3)已知反应i速率方程为
 (k为速率常数只与温度、催化剂有关;α、β、γ、δ为反应级数,可以为正数、负数或分数)。
(k为速率常数只与温度、催化剂有关;α、β、γ、δ为反应级数,可以为正数、负数或分数)。①一定温度下,反应速率与浓度(
 )关系如下表所示:
)关系如下表所示:| 序号 |  | 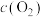 | 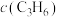 | 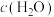 | v |
| Ⅰ | 0.1 | 0.1 | 0.1 | 0.1 | k |
| Ⅱ | 0.2 | 0.1 | 0.1 | 0.1 | 4k |
| Ⅲ | 0.2 | 0.4 | 0.1 | 0.1 | 8k |
| Ⅳ | 0.4 | 0.1 | 0.2 | 0.1 | 8k |
| Ⅴ | 0.4 | 0.4 | 0.1 | 0.2 | 16k |
②速率常数与温度、活化能关系式为
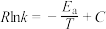 (R、C为常数,T为温度,
(R、C为常数,T为温度, 为活化能且不随温度变化而变化)。在不同催化剂Cat1、Cat2作用下,Ink与
为活化能且不随温度变化而变化)。在不同催化剂Cat1、Cat2作用下,Ink与 关系如图:
关系如图: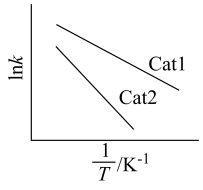
(4)在密闭容器中充入
 和
和 ,仅发生上述反应i和ii,测得丙烷的平衡转化率与温度、压强关系如图所示:
,仅发生上述反应i和ii,测得丙烷的平衡转化率与温度、压强关系如图所示: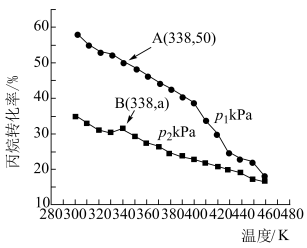
②
 下,A点丙烯的选择性为80%(选择性等于丙烯的物质的量与丙烷转化的总物质的量之比)。B点时,反应ii的压强平衡常数
下,A点丙烯的选择性为80%(选择性等于丙烯的物质的量与丙烷转化的总物质的量之比)。B点时,反应ii的压强平衡常数
(5)在熔融碳酸钠中,丙烷-空气燃料电池的放电效率高。该燃料电池放电时,负极的电极反应式为
您最近半年使用:0次



