1 . 回答下列问题:
(1)NH4Cl溶液显酸性的原因是___ (用离子方程式表示)。
(2)有pH均为3的CH3COOH、HNO3、H2SO4三种物质的溶液,物质的量浓度由大到小的顺序为___ 。
(3)二氧化碳加氢制甲醇的反应一般可通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ·mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ·mol-1
二氧化碳加氢制甲醇的热化学方程式___ 。
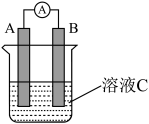
(4)如图所示装置中,A、B、C、D均为铂电极。断开K1,闭合K2、K3一段时间后,A、B中气体的量之间的关系如图所示:
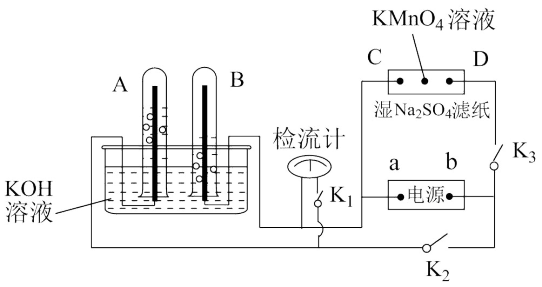
①写出A电极反应式___ 。
②在湿的Na2SO4溶液滤纸条中心的KMnO4液滴发生的现象为___ 。
③若电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,则电流表的指针发生移动,其理由是___ 。
(1)NH4Cl溶液显酸性的原因是
(2)有pH均为3的CH3COOH、HNO3、H2SO4三种物质的溶液,物质的量浓度由大到小的顺序为
(3)二氧化碳加氢制甲醇的反应一般可通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ·mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ·mol-1
二氧化碳加氢制甲醇的热化学方程式
(4)如图所示装置中,A、B、C、D均为铂电极。断开K1,闭合K2、K3一段时间后,A、B中气体的量之间的关系如图所示:

①写出A电极反应式
②在湿的Na2SO4溶液滤纸条中心的KMnO4液滴发生的现象为
③若电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,则电流表的指针发生移动,其理由是
您最近一年使用:0次
2 . 现代社会中,人类的一切活动都离不开能量。化学反应中,不仅有新物质的生成,而且伴随着能量的变化,同时,化学电池也成为人类生产和生活的重要能量来源之一。回答下列问题:
(1)已知:键能是在标准状况下,将 气态分子
气态分子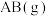 解离为气态原子
解离为气态原子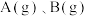 所需的能量。请从断键和成键的角度分析下列反应中能量的变化。部分化学键的键能如表所示:
所需的能量。请从断键和成键的角度分析下列反应中能量的变化。部分化学键的键能如表所示:
反应 ,生成
,生成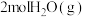 放出热量
放出热量_____  。
。
(2)若将反应 设计成如图所示的原电池装置,已知
设计成如图所示的原电池装置,已知 电极为负极,则
电极为负极,则 电极的电极反应式为
电极的电极反应式为_____ 。
(3)物质的类别和核心元素的化合价是研究物质性质的两个重要角度。硫及其部分化合物的“价类二维图”如图所示。
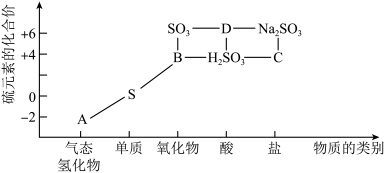
①将足量 通入品红溶液中,溶液褪色,体现了
通入品红溶液中,溶液褪色,体现了 的
的_____ 性;将足量 通入溴水中,溶液褪色,体现了
通入溴水中,溶液褪色,体现了 的
的_____ 性;气体 和
和 中,不能用
中,不能用 的浓溶液干燥的是
的浓溶液干燥的是_____ (填化学式)。
②欲制备 ,从氧化还原角度分析,下列选项中合理的是
,从氧化还原角度分析,下列选项中合理的是_____ (填标号)。
A. B.
B. C.
C. D.
D.
(4)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 气体,发生反应:
气体,发生反应: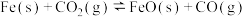 。反应过程中
。反应过程中 和
和 的浓度与时间的关系如图所示。
的浓度与时间的关系如图所示。
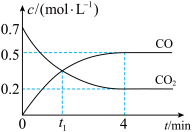
① 时,正、逆反应速率的大小关系为
时,正、逆反应速率的大小关系为
_____ (填“>”“<”或“=”) 。
。
② 内,
内, 的平均反应速率
的平均反应速率
_____ 。
③下列条件的改变能加快其反应速率的是_____ (填标号)。
A.升高温度
B.增加铁粉的质量
C.保持压强不变,充入He使容器的容积增大
D.保持容积不变,充入He使体系压强增大
④下列能说明上述反应已达平衡状态的是_____ (填标号)。
A.
B.单位时间内生成 的同时生成
的同时生成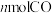
C.容器中气体的压强不随时间变化而变化
D.容器中气体的平均相对分子质量不随时间变化而变化
(1)已知:键能是在标准状况下,将
 气态分子
气态分子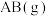 解离为气态原子
解离为气态原子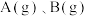 所需的能量。请从断键和成键的角度分析下列反应中能量的变化。部分化学键的键能如表所示:
所需的能量。请从断键和成键的角度分析下列反应中能量的变化。部分化学键的键能如表所示:| 化学键 |  |  |  |
键能 | 436 | 496 | 463 |
 ,生成
,生成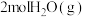 放出热量
放出热量 。
。(2)若将反应
 设计成如图所示的原电池装置,已知
设计成如图所示的原电池装置,已知 电极为负极,则
电极为负极,则 电极的电极反应式为
电极的电极反应式为
(3)物质的类别和核心元素的化合价是研究物质性质的两个重要角度。硫及其部分化合物的“价类二维图”如图所示。

①将足量
 通入品红溶液中,溶液褪色,体现了
通入品红溶液中,溶液褪色,体现了 的
的 通入溴水中,溶液褪色,体现了
通入溴水中,溶液褪色,体现了 的
的 和
和 中,不能用
中,不能用 的浓溶液干燥的是
的浓溶液干燥的是②欲制备
 ,从氧化还原角度分析,下列选项中合理的是
,从氧化还原角度分析,下列选项中合理的是A.
 B.
B. C.
C. D.
D.
(4)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的
 气体,发生反应:
气体,发生反应: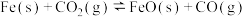 。反应过程中
。反应过程中 和
和 的浓度与时间的关系如图所示。
的浓度与时间的关系如图所示。
①
 时,正、逆反应速率的大小关系为
时,正、逆反应速率的大小关系为
 。
。②
 内,
内, 的平均反应速率
的平均反应速率
③下列条件的改变能加快其反应速率的是
A.升高温度
B.增加铁粉的质量
C.保持压强不变,充入He使容器的容积增大
D.保持容积不变,充入He使体系压强增大
④下列能说明上述反应已达平衡状态的是
A.

B.单位时间内生成
 的同时生成
的同时生成
C.容器中气体的压强不随时间变化而变化
D.容器中气体的平均相对分子质量不随时间变化而变化
您最近一年使用:0次
3 . Cu2O是一种重要的工业原料,广泛川作催化剂。
Ⅰ.制备Cu2O
(1)微乳液—还原法:在100℃的Cu(NO3)2溶液中加入一定体积的NaOH溶液,搅拌均匀,再逐滴加入肼(N2H4)产生红色沉淀,抽滤、洗涤、干燥,得到Cu2O。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-akJ·mol-1
Cu(OH)2(s)=CuO(s)+H2O(l)△H=+bkJ·mol-1
4CuO(s)=2Cu2O(s)+O2(g)△H=+ckJ·mol-1
则由N2H4(l)和Cu(OH)2(s)反应制备Cu2O(s)的热化学方程式为__ 。
(2)电解法:纳米级Cu2O由于具有优良的催化性能而受到关注。
采用阴离子交换膜制备纳米级Cu2O的装置如图所示:

阳极的电极反应式为___ 。
Ⅱ.纳米级Cu2O催化剂可用于工业上合成甲醇:CO(g)+2H2(g) CH3OH(g)△H=-90.8kJ·mol-1
CH3OH(g)△H=-90.8kJ·mol-1
(3)能说明反应CO(g)+2H2(g) CH3OH(g)已达平衡状态的是
CH3OH(g)已达平衡状态的是__ (填字母)。
A.CO的消耗速率等于CH3OH的生成速率
B.一定条件,CO的转化率不再变化
C.在绝热恒容的容器中,反应的平衡常数不再变化
(4)t℃时,在体积为2L固定体积的密闭容器中加入2.00molH2(g)和1.00mol的CO(g)的物质的量随时间的变化如表:
根据表中数据回答:
①氢气平衡转化率为___ 。
②2t℃时该反应的平衡常数为___ 。
③保持其它条件不变,向平衡体系中充入1molCO(g)、2molH2(g)、1molCH3OH(g);此时v正__ v逆(填“>”“<”或“=”)。
(5)工业实际合成CH3OH生产中,采用如图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:__ 。

Ⅰ.制备Cu2O
(1)微乳液—还原法:在100℃的Cu(NO3)2溶液中加入一定体积的NaOH溶液,搅拌均匀,再逐滴加入肼(N2H4)产生红色沉淀,抽滤、洗涤、干燥,得到Cu2O。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-akJ·mol-1
Cu(OH)2(s)=CuO(s)+H2O(l)△H=+bkJ·mol-1
4CuO(s)=2Cu2O(s)+O2(g)△H=+ckJ·mol-1
则由N2H4(l)和Cu(OH)2(s)反应制备Cu2O(s)的热化学方程式为
(2)电解法:纳米级Cu2O由于具有优良的催化性能而受到关注。
采用阴离子交换膜制备纳米级Cu2O的装置如图所示:

阳极的电极反应式为
Ⅱ.纳米级Cu2O催化剂可用于工业上合成甲醇:CO(g)+2H2(g)
 CH3OH(g)△H=-90.8kJ·mol-1
CH3OH(g)△H=-90.8kJ·mol-1(3)能说明反应CO(g)+2H2(g)
 CH3OH(g)已达平衡状态的是
CH3OH(g)已达平衡状态的是A.CO的消耗速率等于CH3OH的生成速率
B.一定条件,CO的转化率不再变化
C.在绝热恒容的容器中,反应的平衡常数不再变化
(4)t℃时,在体积为2L固定体积的密闭容器中加入2.00molH2(g)和1.00mol的CO(g)的物质的量随时间的变化如表:
| 时间(s) | 0 | 2 | 5 | 10 | 20 | 40 | 80 |
| 物质的量(mol) | 1.00 | 0.50 | 0.375 | 0.25 | 0.20 | 0.20 | 0.20 |
①氢气平衡转化率为
②2t℃时该反应的平衡常数为
③保持其它条件不变,向平衡体系中充入1molCO(g)、2molH2(g)、1molCH3OH(g);此时v正
(5)工业实际合成CH3OH生产中,采用如图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:

您最近一年使用:0次
2021-04-19更新
|
503次组卷
|
2卷引用:辽宁省葫芦岛市普通高中2021-2022学年高三上学期期末学业质量监测化学试题
4 . 天然气是一种清洁能源,用途广泛。
(1)工业上可用焦炉煤气(主要成分为CO、CO2和H2)制备天然气。已知:CO(g)+3H2(g)=CH4(g) +H2O(g) △H1=-206kJ/mol,CO(g)+H2O(g)=H2(g)+CO2(g) △H2= -41kJ/mol。
①CO2转化为CH4的热化学方程式是:_______ 。
②有利于提高混合气中CH4含量的措施是:_______ 。
a. 使用催化剂 b. 升高温度 c. 及时导出水蒸气
(2)甲烷可制成燃料电池,其装置如下图所示。
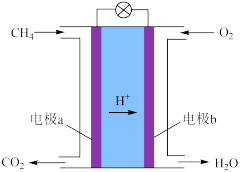
①电极b是_______ 极(填“正”或“负”)。
②a极的电极反应式是_______________ 。
(1)工业上可用焦炉煤气(主要成分为CO、CO2和H2)制备天然气。已知:CO(g)+3H2(g)=CH4(g) +H2O(g) △H1=-206kJ/mol,CO(g)+H2O(g)=H2(g)+CO2(g) △H2= -41kJ/mol。
①CO2转化为CH4的热化学方程式是:
②有利于提高混合气中CH4含量的措施是:
a. 使用催化剂 b. 升高温度 c. 及时导出水蒸气
(2)甲烷可制成燃料电池,其装置如下图所示。

①电极b是
②a极的电极反应式是
您最近一年使用:0次
5 . 我国芒硝(Na2SO4·10H2O)的储量丰富,它是重要的化工原料。
(1)制备碳酸钠。将饱和硫酸钠溶液和饱和碳酸氢铵溶液混合,结晶得NaHCO3晶体,再经加热分解制得碳酸钠。生成NaHCO3晶体的化学方程式是________ 。
已知:I.2NaOH(s) + CO2(g) == Na2CO3(s) + H2O(g) ΔH1=−127.4 kJ·mol−1
II.NaOH(s) + CO2(g) == NaHCO3(s) ΔH2=−131.5 kJ·mol−1
则:2NaHCO3(s) == Na2CO3(s) + CO2(g) + H2O(g) ΔH=________ kJ·mol−1。
(2)制备烧碱和硫酸。用如图所示装置,以惰性电极进行电解,a、b均为离子交换膜。
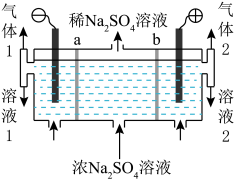
① Na+迁移方向是________ 。
② 气体1是________ ;溶液2是________ 。
(1)制备碳酸钠。将饱和硫酸钠溶液和饱和碳酸氢铵溶液混合,结晶得NaHCO3晶体,再经加热分解制得碳酸钠。生成NaHCO3晶体的化学方程式是
已知:I.2NaOH(s) + CO2(g) == Na2CO3(s) + H2O(g) ΔH1=−127.4 kJ·mol−1
II.NaOH(s) + CO2(g) == NaHCO3(s) ΔH2=−131.5 kJ·mol−1
则:2NaHCO3(s) == Na2CO3(s) + CO2(g) + H2O(g) ΔH=
(2)制备烧碱和硫酸。用如图所示装置,以惰性电极进行电解,a、b均为离子交换膜。

① Na+迁移方向是
② 气体1是
您最近一年使用:0次
解题方法
6 . 工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,冰铜与酸反应可以生成硫化氢(见图1)。完成下列填空:
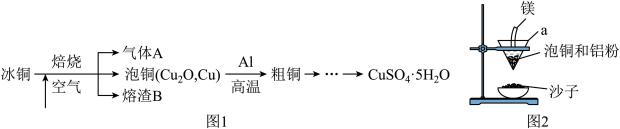
(1)气体A中的大气污染物可选用下列试剂中的________ (填序号)吸收。
a.浓H2SO4 b.浓HNO3 c.NaOH溶液 d.氨水
(2)实验室可用如图2的装置完成泡铜冶炼粗铜的反应.
①泡铜冶炼粗铜的化学方程式是_____ ;
②装置中镁带的作用是_____ ;
③泡铜和铝粉混合物表面覆盖少量白色固体a,a是__ ;
(3)将H2S和O2在密闭容器中点燃,充分反应后恢复到原来的温度和压强(120℃、101kPa),气体体积减少30%,求原混合其气体中H2S的体积分数.(不考虑H2S的自身分解)______ 已知:氧气不足时:2H2S+O2 2S+2H2O 氧气足量时:2H2S+3O2═2SO2+2H2O;
2S+2H2O 氧气足量时:2H2S+3O2═2SO2+2H2O;
(4)已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) △H1=47kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g) △H2=189kJ/mol
则由SiCl4制备硅的热化学方程式为______ 。

(1)气体A中的大气污染物可选用下列试剂中的
a.浓H2SO4 b.浓HNO3 c.NaOH溶液 d.氨水
(2)实验室可用如图2的装置完成泡铜冶炼粗铜的反应.
①泡铜冶炼粗铜的化学方程式是
②装置中镁带的作用是
③泡铜和铝粉混合物表面覆盖少量白色固体a,a是
(3)将H2S和O2在密闭容器中点燃,充分反应后恢复到原来的温度和压强(120℃、101kPa),气体体积减少30%,求原混合其气体中H2S的体积分数.(不考虑H2S的自身分解)
 2S+2H2O 氧气足量时:2H2S+3O2═2SO2+2H2O;
2S+2H2O 氧气足量时:2H2S+3O2═2SO2+2H2O;(4)已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) △H1=47kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g) △H2=189kJ/mol
则由SiCl4制备硅的热化学方程式为
您最近一年使用:0次
填空题
|
适中(0.65)
|
名校
7 . 氮是一种重要的元素,其对应化合物在生产生活中有重要的应用。
(1)氮化铝(AlN)可用于制备耐高温的结构陶瓷,遇强碱会腐蚀,写出AlN与氢氧化钠溶液反应的离子方程式_______________ 。
(2)氨是制备氮肥、硝酸等的重要原料②③
①已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
N2(g)+O2(g) 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
2H2(g)+O2(g) 2H2O(1) △H= -571.6 kJ/mol
2H2O(1) △H= -571.6 kJ/mol
试写出表示氨的标准燃烧热的热化学方程式________________ 。
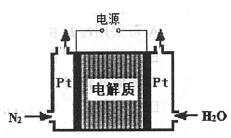
②某电解法制氨的装置如右图所示,电解质只允许质子通过,试写出阴极的电极反应式__________ 。
(3)反应:2NO(g)+O2(g) 2NO2(g)△H<0是制备硝酸过程中的一个反应。
2NO2(g)△H<0是制备硝酸过程中的一个反应。
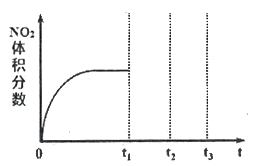
①将NO和O2按物质的量之比为2:1置于恒温恒容密闭容器中进行上述反应,得到NO2体积分数与时间的关系如下图所示。保持其它条件不变,t1时再向容器中充入适量物质的量之比为2:1的NO和O2的混合气体,t2时再次达到平衡,请画出tl-t3时间范围内NO2体积分数随时间的变化曲线:____________ 。
②在研究此反应速率与温度的关系时发现,NO转化成NO2的速率随温度升高反而减慢。进一步研究发现,上述反应实际是分两步进行的:
I 2NO(g) N2O2(g) △H<0
N2O2(g) △H<0
II N2O2(g)+O2(g) 2NO2(g) △H<0
2NO2(g) △H<0
已知反应I能快速进行,试结合影响化学反应速率的因素和平衡移动理论分析,随温度升高,NO转化成NO2的速率减慢的可能原因________ 。
(4)已知常温下,Ka(CH3COOH)=Kb(NH3·H2O)=l.8×l0-5。则常温下0.lmol/L的CH3COONH4溶液中,(CH3COO-):c(NH3·H2O)=________________ 。
(1)氮化铝(AlN)可用于制备耐高温的结构陶瓷,遇强碱会腐蚀,写出AlN与氢氧化钠溶液反应的离子方程式
(2)氨是制备氮肥、硝酸等的重要原料②③
①已知:N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/molN2(g)+O2(g)
 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol2H2(g)+O2(g)
 2H2O(1) △H= -571.6 kJ/mol
2H2O(1) △H= -571.6 kJ/mol试写出表示氨的标准燃烧热的热化学方程式
②某电解法制氨的装置如右图所示,电解质只允许质子通过,试写出阴极的电极反应式
(3)反应:2NO(g)+O2(g)
 2NO2(g)△H<0是制备硝酸过程中的一个反应。
2NO2(g)△H<0是制备硝酸过程中的一个反应。①将NO和O2按物质的量之比为2:1置于恒温恒容密闭容器中进行上述反应,得到NO2体积分数与时间的关系如下图所示。保持其它条件不变,t1时再向容器中充入适量物质的量之比为2:1的NO和O2的混合气体,t2时再次达到平衡,请画出tl-t3时间范围内NO2体积分数随时间的变化曲线:
②在研究此反应速率与温度的关系时发现,NO转化成NO2的速率随温度升高反而减慢。进一步研究发现,上述反应实际是分两步进行的:
I 2NO(g)
 N2O2(g) △H<0
N2O2(g) △H<0II N2O2(g)+O2(g)
 2NO2(g) △H<0
2NO2(g) △H<0已知反应I能快速进行,试结合影响化学反应速率的因素和平衡移动理论分析,随温度升高,NO转化成NO2的速率减慢的可能原因
(4)已知常温下,Ka(CH3COOH)=Kb(NH3·H2O)=l.8×l0-5。则常温下0.lmol/L的CH3COONH4溶液中,(CH3COO-):c(NH3·H2O)=
您最近一年使用:0次
2017-03-11更新
|
965次组卷
|
3卷引用:浙江省建德市新安江中学2019届高三上学期期末复习化学试题



