回答下列问题:
(1)NH4Cl溶液显酸性的原因是___ (用离子方程式表示)。
(2)有pH均为3的CH3COOH、HNO3、H2SO4三种物质的溶液,物质的量浓度由大到小的顺序为___ 。
(3)二氧化碳加氢制甲醇的反应一般可通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ·mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ·mol-1
二氧化碳加氢制甲醇的热化学方程式___ 。
(4)如图所示装置中,A、B、C、D均为铂电极。断开K1,闭合K2、K3一段时间后,A、B中气体的量之间的关系如图所示:
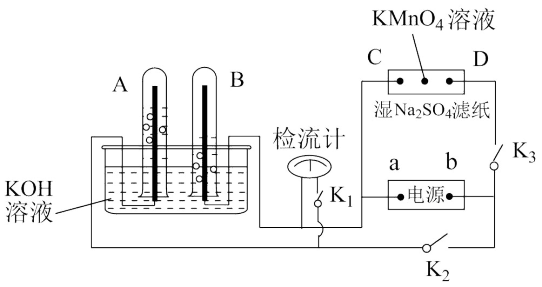
①写出A电极反应式___ 。
②在湿的Na2SO4溶液滤纸条中心的KMnO4液滴发生的现象为___ 。
③若电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,则电流表的指针发生移动,其理由是___ 。
(1)NH4Cl溶液显酸性的原因是
(2)有pH均为3的CH3COOH、HNO3、H2SO4三种物质的溶液,物质的量浓度由大到小的顺序为
(3)二氧化碳加氢制甲醇的反应一般可通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ·mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ·mol-1
二氧化碳加氢制甲醇的热化学方程式
(4)如图所示装置中,A、B、C、D均为铂电极。断开K1,闭合K2、K3一段时间后,A、B中气体的量之间的关系如图所示:

①写出A电极反应式
②在湿的Na2SO4溶液滤纸条中心的KMnO4液滴发生的现象为
③若电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,则电流表的指针发生移动,其理由是
更新时间:2022-01-20 11:01:38
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】在25℃时,三种酸的电离平衡常数如下表:
(1)写出H2CO3的电离平衡常数Ka1的表达式_______ 。
(2)常温下将1mL pH均为3的醋酸和亚硫酸都稀释100倍,pH较大的是_______ 。
(3)CH3COONa水溶液中含有的离子有_______ (写离子符号)。
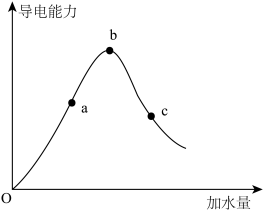
(4)常温下,无水醋酸加水稀释过程溶液的导电能力随加水的体积V的变化曲线如图所示,则a、b、c三点醋酸的电离度最大是的_______ 。
(5)如果用0.1mol•L-1的NaOH溶液滴定20mL 未知浓度的醋酸,选用酚酞作指示剂,达滴定终点的颜色变化是_______ 。下列相关操作会造成所测定醋酸的浓度偏高的有_______ 。
A.用未知液洗锥形瓶
B.量取未知液的酸式滴定管只用水洗
C.滴定结束时,读取碱液体积时俯视刻度
D.配制NaOH标准液时,所用NaOH固体中含有KOH
(6)根据表中电离子平衡常数的数值大小,写出H2SO3和CH3COONa反应离子方程式_______ 。
(7)已知:H+(aq) + OH―(aq)=H2O(l) △H=-57.3kJ•mol-1,CH3COOH(aq)+OH-(aq)=CH3COO-(aq)+H2O(l) △H=-56.7kJ•mol-1。则醋酸电离的热化方程式为_______ 。
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.4×10-7 Ka2=4.4×10-11 | Ka1=1.5×10-2 Ka2=1.02×10-7 |
(1)写出H2CO3的电离平衡常数Ka1的表达式
(2)常温下将1mL pH均为3的醋酸和亚硫酸都稀释100倍,pH较大的是
(3)CH3COONa水溶液中含有的离子有
(4)常温下,无水醋酸加水稀释过程溶液的导电能力随加水的体积V的变化曲线如图所示,则a、b、c三点醋酸的电离度最大是的

(5)如果用0.1mol•L-1的NaOH溶液滴定20mL 未知浓度的醋酸,选用酚酞作指示剂,达滴定终点的颜色变化是
A.用未知液洗锥形瓶
B.量取未知液的酸式滴定管只用水洗
C.滴定结束时,读取碱液体积时俯视刻度
D.配制NaOH标准液时,所用NaOH固体中含有KOH
(6)根据表中电离子平衡常数的数值大小,写出H2SO3和CH3COONa反应离子方程式
(7)已知:H+(aq) + OH―(aq)=H2O(l) △H=-57.3kJ•mol-1,CH3COOH(aq)+OH-(aq)=CH3COO-(aq)+H2O(l) △H=-56.7kJ•mol-1。则醋酸电离的热化方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】甲醇水蒸气重整制氢(SRM)系统简单,产物中H2 含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。反应如下:
反应Ⅰ(主) :CH3OH(g)+ H2O(g) CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
反应Ⅱ(副) :H2(g)+ CO2(g) CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol
温度高于300℃则会同时发生反应Ⅲ: CH3OH(g) CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)计算反应Ⅲ的ΔH3=_________ 。
(2)反应1能够自发进行的原因是_______________ ,升温有利于提高CH3OH转化率,但也存在一个明显的缺点是__________ 。
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是____________ (填标号)。
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是______ 。
③写出一条能提高CH3OH转化率而降低CO生成率的措施_________ 。
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率_________ ,反应Ⅱ的平衡常数_________ (结果保留两位有效数字)
反应Ⅰ(主) :CH3OH(g)+ H2O(g)
 CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol反应Ⅱ(副) :H2(g)+ CO2(g)
 CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol温度高于300℃则会同时发生反应Ⅲ: CH3OH(g)
 CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3(1)计算反应Ⅲ的ΔH3=
(2)反应1能够自发进行的原因是
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是
③写出一条能提高CH3OH转化率而降低CO生成率的措施
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】(1)已知:①Fe(s)+1/2O2(g)===FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+3/2O2(g)===Al2O3(s) ΔH2=-1 675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是__________________________ 。某同学认为,铝热反应可用于工业炼铁,你的判断是________ (填“能”或“不能”),你的理由是_________________ 。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
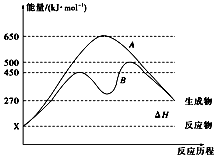
①据图判断该反应是________ (填“吸”或“放”)热反应
②其中B历程表明此反应采用的条件为_____ (填字母)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
②2Al(s)+3/2O2(g)===Al2O3(s) ΔH2=-1 675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。

①据图判断该反应是
②其中B历程表明此反应采用的条件为
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题
(1)下列事实中,与电化学腐蚀无关的是_______
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.金属钠置于空气中表面变暗
C.镀银的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
E.生铁比软铁芯(几乎是纯铁)容易生锈
F.铁制器件附有铜制配件,在接触处易生铁锈
(2)以石墨为电极,电解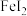 溶液,阳极电极反应式为
溶液,阳极电极反应式为_______ 。
(3)利用反应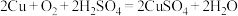 可制备
可制备 ,若将该反应设计为原电池,其正极电极反应式为
,若将该反应设计为原电池,其正极电极反应式为_______ 。
(4)利用人工光合作用可将 转化为甲酸,反应原理为
转化为甲酸,反应原理为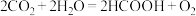 ,装置如图所示:
,装置如图所示:
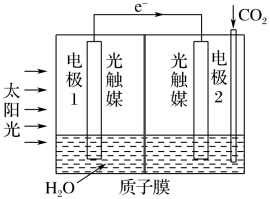
电极2的电极反应式是_______ ;
(5)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、 和
和 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的_______ 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_______ 。
(6)已知 是可逆反应,设计如图装置(
是可逆反应,设计如图装置( 、
、 均为石墨电极)开始时:
均为石墨电极)开始时: 棒电极反应式
棒电极反应式_______ ,当电流表_______ 时,反应达到化学平衡状态。
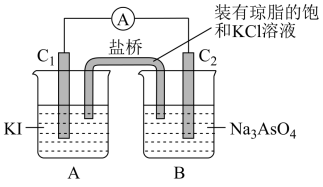
(1)下列事实中,与电化学腐蚀无关的是
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.金属钠置于空气中表面变暗
C.镀银的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
E.生铁比软铁芯(几乎是纯铁)容易生锈
F.铁制器件附有铜制配件,在接触处易生铁锈
(2)以石墨为电极,电解
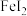 溶液,阳极电极反应式为
溶液,阳极电极反应式为(3)利用反应
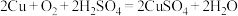 可制备
可制备 ,若将该反应设计为原电池,其正极电极反应式为
,若将该反应设计为原电池,其正极电极反应式为(4)利用人工光合作用可将
 转化为甲酸,反应原理为
转化为甲酸,反应原理为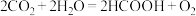 ,装置如图所示:
,装置如图所示:
电极2的电极反应式是
(5)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、
 和
和 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的(6)已知
 是可逆反应,设计如图装置(
是可逆反应,设计如图装置( 、
、 均为石墨电极)开始时:
均为石墨电极)开始时: 棒电极反应式
棒电极反应式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】某同学用下图装置电解硫酸钾溶液来获得氧气、氢气、硫酸和氢氧化钾。
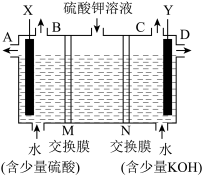
(1)X极与电源的________ (填“正”或“负”)极相连,氢气从________ (填“A”“B”“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为________ (填“阴离子”或“阳离子”,下同)交换膜,N为________ 交换膜,图中少量硫酸和少量氢氧化钾的作用是________________________________________ 。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为______________________________________________ 。
(4)若使用铅蓄电池作电源完成上述电解,当制得11.2 L标准状况下的氢气时,理论上铅蓄电池消耗硫酸________ mol,正极板质量增加______ g,负极板质量增加________ g。

(1)X极与电源的
(2)离子交换膜只允许一类离子通过,则M为
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为
(4)若使用铅蓄电池作电源完成上述电解,当制得11.2 L标准状况下的氢气时,理论上铅蓄电池消耗硫酸
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】钴是重要的战略资源,但资源匮乏,回收钴废料能有效缓解资源浪费、环境污染等问题。设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成 ,将废旧锂离子电池的正极材料
,将废旧锂离子电池的正极材料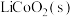 转化为
转化为 ,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。
,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。
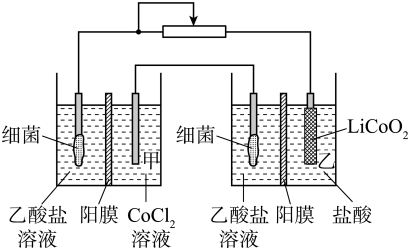
(1)装置工作时,甲室溶液_______ pH逐渐甲室中a电极为_______ 极,电极反应为_______ 。
(2)装置工作一段时间后,乙室应补充的物质为_______ ,乙室中b电极反应为_______ 。
 ,将废旧锂离子电池的正极材料
,将废旧锂离子电池的正极材料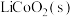 转化为
转化为 ,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。
,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。
(1)装置工作时,甲室溶液
(2)装置工作一段时间后,乙室应补充的物质为
您最近一年使用:0次



