1 . 利用 消除
消除 污染的反应为
污染的反应为
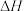 。已知在不同温度(
。已知在不同温度( 、
、 )下,向装有足量
)下,向装有足量 固体的
固体的 恒容密闭容器中通入
恒容密闭容器中通入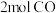 ,测得
,测得 的气体体积分数
的气体体积分数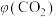 随时间
随时间 的变化曲线如图所示(b、c点都已经达平衡)。请回答:
的变化曲线如图所示(b、c点都已经达平衡)。请回答:

(1)温度为 时,
时, 内,
内, 的平均反应速率v(CO2)=
的平均反应速率v(CO2)=___________  。
。
(2)b点时 的转化率为
的转化率为___________ ,若某温度下测得上述 恒容密闭容器中,反应达平衡时
恒容密闭容器中,反应达平衡时 气体的体积分数为
气体的体积分数为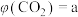 ,则该温度下该反应的平衡常数
,则该温度下该反应的平衡常数
___________ (用含a的代数式表示)。
(3)反应 的
的
___________ 0(填“>”、“<”或“=”)。
(4)上述反应在 下达到平衡时,再向容器中充入物质的量均为
下达到平衡时,再向容器中充入物质的量均为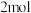 的
的 和
和 气体,则化学平衡
气体,则化学平衡___________ (填“向左”、“向右”或“不”)移动。
(5)下列现象可表示上述反应已达到平衡状态的是___________(填字母)。
(6)若在 温度下,起始时改为向装有足量
温度下,起始时改为向装有足量 固体的
固体的 恒容密闭容器中通入
恒容密闭容器中通入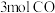 和
和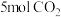 气体,反应达平衡时的能量变化为
气体,反应达平衡时的能量变化为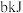 ,则
,则 的
的
___________  (用含b的代数式表示)。
(用含b的代数式表示)。
 消除
消除 污染的反应为
污染的反应为
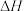 。已知在不同温度(
。已知在不同温度( 、
、 )下,向装有足量
)下,向装有足量 固体的
固体的 恒容密闭容器中通入
恒容密闭容器中通入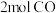 ,测得
,测得 的气体体积分数
的气体体积分数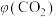 随时间
随时间 的变化曲线如图所示(b、c点都已经达平衡)。请回答:
的变化曲线如图所示(b、c点都已经达平衡)。请回答:
(1)温度为
 时,
时, 内,
内, 的平均反应速率v(CO2)=
的平均反应速率v(CO2)= 。
。(2)b点时
 的转化率为
的转化率为 恒容密闭容器中,反应达平衡时
恒容密闭容器中,反应达平衡时 气体的体积分数为
气体的体积分数为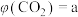 ,则该温度下该反应的平衡常数
,则该温度下该反应的平衡常数
(3)反应
 的
的
(4)上述反应在
 下达到平衡时,再向容器中充入物质的量均为
下达到平衡时,再向容器中充入物质的量均为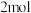 的
的 和
和 气体,则化学平衡
气体,则化学平衡(5)下列现象可表示上述反应已达到平衡状态的是___________(填字母)。
| A.容器内的压强不再变化 |
| B.混合气体的平均相对分子质量不再变化 |
| C.混合气体的密度不再变化 |
D.单位时间内消耗 和生成 和生成 的物质的量之比为 的物质的量之比为 |
 温度下,起始时改为向装有足量
温度下,起始时改为向装有足量 固体的
固体的 恒容密闭容器中通入
恒容密闭容器中通入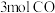 和
和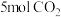 气体,反应达平衡时的能量变化为
气体,反应达平衡时的能量变化为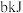 ,则
,则 的
的
 (用含b的代数式表示)。
(用含b的代数式表示)。
您最近一年使用:0次
解题方法
2 . 化学反应产生的各种形式的能量是人类社会所需能量的重要来源,研究化学反应的能量变化具有重要意义。根据要求,回答下列问题:
Ⅰ.实验室用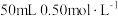 盐酸、
盐酸、 溶液进行测定中和反应反应热(
溶液进行测定中和反应反应热( )的实验,实验装置如图所示,得到的数据如表所示。
)的实验,实验装置如图所示,得到的数据如表所示。

回答下列问题:
(1)实验时,___________ (填“能”或“不能”)用铜丝搅拌棒代替玻璃搅拌器,其理由是___________ 。
(2)已知:反应后溶液的比热容c为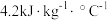 ,各溶液的密度均为
,各溶液的密度均为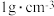 。
。
①根据实验结果计算出 溶液与
溶液与 溶液反应生成
溶液反应生成 水的反应热
水的反应热
___________  。
。
②若实验过程中,未加盖硬纸板,则 将
将___________ (填“偏大”、“偏小”或“无影响”,下同)。
③若用浓硫酸代替 做实验,则
做实验,则 将
将___________ 。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(3) 和
和 反应生成
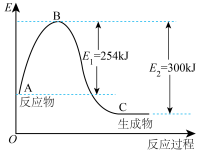
反应生成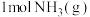 的过程中能量的变化如图,请写出
的过程中能量的变化如图,请写出 和
和 反应生成
反应生成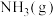 的热化学方程式:
的热化学方程式:___________ 。
(4)用 催化还原
催化还原 ,可以消除氮氧化物的污染。已知:
,可以消除氮氧化物的污染。已知:
①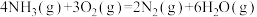
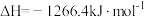
②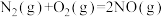
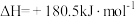
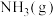 还原
还原 生成
生成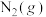 和
和 ,每消耗
,每消耗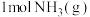 时,该反应过程
时,该反应过程___________ (填“吸收”或“放出”)___________  的热量。
的热量。
Ⅰ.实验室用
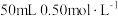 盐酸、
盐酸、 溶液进行测定中和反应反应热(
溶液进行测定中和反应反应热( )的实验,实验装置如图所示,得到的数据如表所示。
)的实验,实验装置如图所示,得到的数据如表所示。
| 实验次数 | 起始温度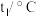 | 终止温度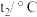 | |
| 盐酸 |  溶液 溶液 | ||
| 1 | 20.2 | 20.3 | 23.6 |
| 2 | 20.3 | 20.4 | 23.6 |
| 3 | 20.5 | 20.6 | 24.9 |
(1)实验时,
(2)已知:反应后溶液的比热容c为
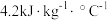 ,各溶液的密度均为
,各溶液的密度均为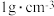 。
。①根据实验结果计算出
 溶液与
溶液与 溶液反应生成
溶液反应生成 水的反应热
水的反应热
 。
。②若实验过程中,未加盖硬纸板,则
 将
将③若用浓硫酸代替
 做实验,则
做实验,则 将
将Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(3)
 和
和 反应生成
反应生成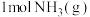 的过程中能量的变化如图,请写出
的过程中能量的变化如图,请写出 和
和 反应生成
反应生成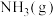 的热化学方程式:
的热化学方程式:
(4)用
 催化还原
催化还原 ,可以消除氮氧化物的污染。已知:
,可以消除氮氧化物的污染。已知:①
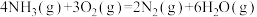
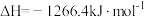
②
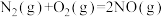
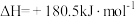
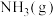 还原
还原 生成
生成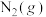 和
和 ,每消耗
,每消耗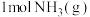 时,该反应过程
时,该反应过程 的热量。
的热量。
您最近一年使用:0次
2023-07-01更新
|
261次组卷
|
2卷引用:陕西省西安市临潼区2022-2023学年高一下学期期末考试化学试题
3 . 回答下列问题:
(1)土壤中的微生物可将H2S经两步反应氧化成 ,两步反应的能量变化示意图如图:
,两步反应的能量变化示意图如图:

1molH2S(g)全部氧化为 (aq)的热化学方程式为
(aq)的热化学方程式为_____________________ 。
(2)标准摩尔生成焓是指在25℃和101kPa时,最稳定的单质生成1mol化合物的焓变。已知25℃和101kPa时下列反应:
①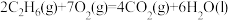

②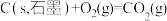

③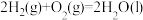

写出乙烷(C2H6)标准摩尔生成焓的焓变 =
=_________ (用含 、
、 、
、 的式子表示)。
的式子表示)。
(3)我国某科研团队设计了一种电解装置,将CO2和NaCl高效转化为CO和NaClO,原理如图2所示:

通入CO2气体的一极为_________ (填“阴极”、“阳极”、“正极”或“负极”),写出该极的电极反应式:__________________________ ,若电解时电路中转移0.4mol电子,则理论上生成NaClO的物质的量为_________ mol。
(1)土壤中的微生物可将H2S经两步反应氧化成
 ,两步反应的能量变化示意图如图:
,两步反应的能量变化示意图如图:
1molH2S(g)全部氧化为
 (aq)的热化学方程式为
(aq)的热化学方程式为(2)标准摩尔生成焓是指在25℃和101kPa时,最稳定的单质生成1mol化合物的焓变。已知25℃和101kPa时下列反应:
①
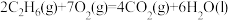

②
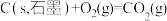

③
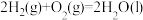

写出乙烷(C2H6)标准摩尔生成焓的焓变
 =
= 、
、 、
、 的式子表示)。
的式子表示)。(3)我国某科研团队设计了一种电解装置,将CO2和NaCl高效转化为CO和NaClO,原理如图2所示:

通入CO2气体的一极为
您最近一年使用:0次
4 . 氨能源是目前研究的热点之一,回答下列问题。
(1)科学家研究利用铁触媒催化合成氨的反应历程如图1所示,其中吸附在催化剂表面的物种用“ad”表示。
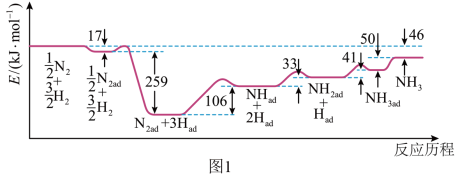
上述历程中反应速率最慢的步骤的化学方程式为___________________ 。由图得出合成氨反应 的
的
__________ (填“<”或“>”);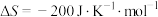 ,则合成氨反应在常温(298K)下
,则合成氨反应在常温(298K)下__________ (填“能”或“不能”)自发进行。
(2)德国哈伯发明以低成本制造大量氨的方法,流程如图2所示:
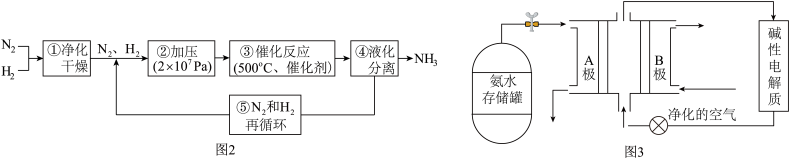
图2中为提高原料转化率而采取的措施是___________ (填序号)。
(3)氨气是一种富氢燃料,可以直接用于燃料电池,供氨水式燃料电池工作原理如图3所示:
①B极为氨气燃料电池的__________ 极(填“正”或“负”)。
②“净化的空气”是指在进入电池装置前除去__________ (填化学式)的气体。
③氨气燃料电池的反应原理是氨气与氧气反应生成一种常见的无毒气体和水,该电池正极上装的电极反应式是_________________ 。
(1)科学家研究利用铁触媒催化合成氨的反应历程如图1所示,其中吸附在催化剂表面的物种用“ad”表示。

上述历程中反应速率最慢的步骤的化学方程式为
 的
的
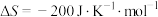 ,则合成氨反应在常温(298K)下
,则合成氨反应在常温(298K)下(2)德国哈伯发明以低成本制造大量氨的方法,流程如图2所示:

图2中为提高原料转化率而采取的措施是
(3)氨气是一种富氢燃料,可以直接用于燃料电池,供氨水式燃料电池工作原理如图3所示:
①B极为氨气燃料电池的
②“净化的空气”是指在进入电池装置前除去
③氨气燃料电池的反应原理是氨气与氧气反应生成一种常见的无毒气体和水,该电池正极上装的电极反应式是
您最近一年使用:0次
2023-02-12更新
|
159次组卷
|
2卷引用:陕西省榆林市2022-2023学年高二上学期教学质量过程性评价化学试题
5 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。二氧化碳催化加氢制甲醇,可减少CO2排放,并合成清洁能源。回答下列问题:
(1)二氧化碳催化加氢制甲醇的总反应可表示为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
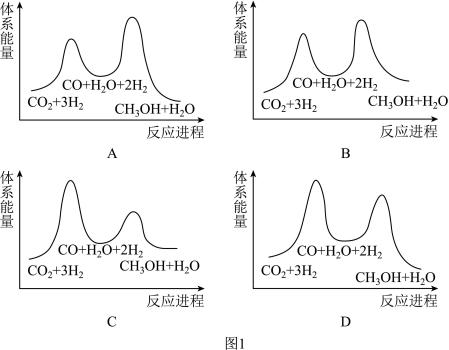
该反应一般认为通过如下步骤来实现:
a.CO2(g)+H2(g) H2O(g)+CO(g) ΔH1=+41kJ•mol-1
H2O(g)+CO(g) ΔH1=+41kJ•mol-1
b.CO(g)+2H2(g) CH3OH(g) ΔH2=-90kJ•mol-1
CH3OH(g) ΔH2=-90kJ•mol-1
①总反应的ΔH=____ kJ•mol-1。
②若反应a为慢反应,图1中能体现上述反应能量变化的是____ (填字母)。
(2)二氧化碳催化加氢制甲醇的总反应在起始物 =3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如图2所示。
=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如图2所示。
①用各物质的平衡分压[如H2的分压可表示为p(H2)]表示总反应的平衡常数,表达式Kp=_____ 。
②图2中对应等温过程的曲线是_____ (填“a”或“b”),判断的理由是_____ 。
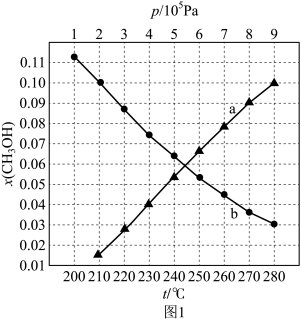
③当x(CH3OH)=0.10时,CO2的平衡转化率=_____ (填分数),反应条件可能为____ 或____ 。
(1)二氧化碳催化加氢制甲醇的总反应可表示为:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH该反应一般认为通过如下步骤来实现:
a.CO2(g)+H2(g)
 H2O(g)+CO(g) ΔH1=+41kJ•mol-1
H2O(g)+CO(g) ΔH1=+41kJ•mol-1b.CO(g)+2H2(g)
 CH3OH(g) ΔH2=-90kJ•mol-1
CH3OH(g) ΔH2=-90kJ•mol-1①总反应的ΔH=
②若反应a为慢反应,图1中能体现上述反应能量变化的是

(2)二氧化碳催化加氢制甲醇的总反应在起始物
 =3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如图2所示。
=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如图2所示。①用各物质的平衡分压[如H2的分压可表示为p(H2)]表示总反应的平衡常数,表达式Kp=
②图2中对应等温过程的曲线是

③当x(CH3OH)=0.10时,CO2的平衡转化率=
您最近一年使用:0次
名校
解题方法
6 . 能源是国民经济发展的重要基础。请根据所学知识回答下列问题:
Ⅰ.火箭推进器中装有还原剂肼( )和强氧化剂过氧化氢(
)和强氧化剂过氧化氢( ),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.4kJ的热量。
),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.4kJ的热量。
(1)肼的结构式为_______ ,过氧化氢的电子式为_______ 。
(2)写出反应的热化学方程式:_______ 。
(3)已知
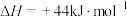 ,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是
,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是_______ kJ。
(4)上述反应用于火箭推进器,除释放大量热和快速产生大量气体外,还有一个很突出的优点是_______ 。
Ⅱ.氨气是一种重要的化学物质,可用于制取化肥和硝酸等。合成氨原料中的H2可用CO在高温下与水蒸气反应制得。已知:在25℃、101kPa下,
①
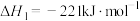
②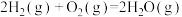
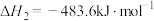
③

(5)25℃、101kPa下,CO与水蒸气反应转化为 和
和 的热化学方程式为
的热化学方程式为_______ 。
(6)已知298K时,正丁烷、异丁烷完全燃烧的热化学方程式分别为:
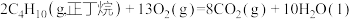
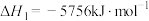
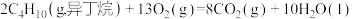

则该温度下,正丁烷转化为异丁烷的热化学方程式为_______ 。
(7)已知298K时,正丁烷不完全燃烧的热化学方程式为
 。在某密闭容器中通入29g正丁烷和68.32L(标准状况)氧气,控制条件使之恰好完全反应。则所得到的CO与
。在某密闭容器中通入29g正丁烷和68.32L(标准状况)氧气,控制条件使之恰好完全反应。则所得到的CO与 的物质的量之比为
的物质的量之比为_______ ,反应过程中放出的热量为_______ 。
Ⅰ.火箭推进器中装有还原剂肼(
 )和强氧化剂过氧化氢(
)和强氧化剂过氧化氢( ),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.4kJ的热量。
),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.4kJ的热量。(1)肼的结构式为
(2)写出反应的热化学方程式:
(3)已知

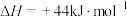 ,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是
,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是(4)上述反应用于火箭推进器,除释放大量热和快速产生大量气体外,还有一个很突出的优点是
Ⅱ.氨气是一种重要的化学物质,可用于制取化肥和硝酸等。合成氨原料中的H2可用CO在高温下与水蒸气反应制得。已知:在25℃、101kPa下,
①

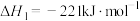
②
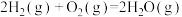
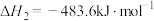
③


(5)25℃、101kPa下,CO与水蒸气反应转化为
 和
和 的热化学方程式为
的热化学方程式为(6)已知298K时,正丁烷、异丁烷完全燃烧的热化学方程式分别为:
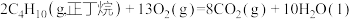
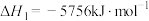
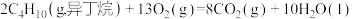

则该温度下,正丁烷转化为异丁烷的热化学方程式为
(7)已知298K时,正丁烷不完全燃烧的热化学方程式为

 。在某密闭容器中通入29g正丁烷和68.32L(标准状况)氧气,控制条件使之恰好完全反应。则所得到的CO与
。在某密闭容器中通入29g正丁烷和68.32L(标准状况)氧气,控制条件使之恰好完全反应。则所得到的CO与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2022-08-04更新
|
300次组卷
|
2卷引用:陕西省延安市富县高级中学2021-2022学年高一下学期期末考试化学试题(B卷)
7 . 生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)S(单斜)和S(正交)是硫的两种同素异形体。已知:
①S(单斜,s)
 ;
;
②S(正交,s)
 。
。
则S(单斜)和S(正交)中更稳定的是_______ 。
(2)常温常压下,几种共价键的键能如下表:
① 单质的分子结构如图所示。
单质的分子结构如图所示。 全部转化成S(g)时要吸收或放出的热量为
全部转化成S(g)时要吸收或放出的热量为_______ kJ。

②写出HBr(g)和 反应生成HF(g)和
反应生成HF(g)和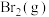 的热化学方程式
的热化学方程式_______ 。
(3)已知: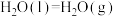
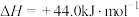 ,甲烷完全燃烧与不完全燃烧的热效应如下图所示。
,甲烷完全燃烧与不完全燃烧的热效应如下图所示。

①写出表示甲烷燃烧热的热化学方程式_______ 。
②CO的燃烧热
_______  。
。
(1)S(单斜)和S(正交)是硫的两种同素异形体。已知:
①S(单斜,s)

 ;
;②S(正交,s)

 。
。则S(单斜)和S(正交)中更稳定的是
(2)常温常压下,几种共价键的键能如下表:
| 共价键 | S-S | F-F | H-F | H-Br | Br-Br |
键能 | 266 | 159 | 565 | 363 | 193 |
 单质的分子结构如图所示。
单质的分子结构如图所示。 全部转化成S(g)时要吸收或放出的热量为
全部转化成S(g)时要吸收或放出的热量为
②写出HBr(g)和
 反应生成HF(g)和
反应生成HF(g)和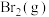 的热化学方程式
的热化学方程式(3)已知:
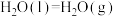
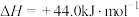 ,甲烷完全燃烧与不完全燃烧的热效应如下图所示。
,甲烷完全燃烧与不完全燃烧的热效应如下图所示。
①写出表示甲烷燃烧热的热化学方程式
②CO的燃烧热

 。
。
您最近一年使用:0次
8 . 回答下列问题:
(1)已知拆开 键、
键、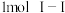 键、
键、 键分别需要吸收的能量为
键分别需要吸收的能量为 、
、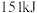 、
、 。则由氢气和碘反应生成1molHI(碘化氢)需要
。则由氢气和碘反应生成1molHI(碘化氢)需要_______ (填“放出”或“吸收”)_______  的热量。
的热量。
(2)发射卫星时可用肼( )为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:①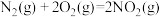
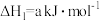
②

写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:_______ 。
(1)已知拆开
 键、
键、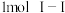 键、
键、 键分别需要吸收的能量为
键分别需要吸收的能量为 、
、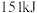 、
、 。则由氢气和碘反应生成1molHI(碘化氢)需要
。则由氢气和碘反应生成1molHI(碘化氢)需要 的热量。
的热量。(2)发射卫星时可用肼(
 )为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知:①
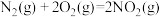
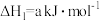
②


写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:
您最近一年使用:0次
2022-01-19更新
|
163次组卷
|
2卷引用:陕西省宝鸡市渭滨区2021-2022学年高二上学期期末考试化学试题
9 . I.如图是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图。
(1)请写出NO2(g)和CO(g)反应的热化学方程式___________

II.用如图所示装置进行中和热的测定实验。

(2)仪器A的名称是___________ ,碎泡沫塑料的作用是___________
(3)理论上强酸强碱的中和热为57.3kJ·mol-1,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式___________
(1)请写出NO2(g)和CO(g)反应的热化学方程式

II.用如图所示装置进行中和热的测定实验。

(2)仪器A的名称是
(3)理论上强酸强碱的中和热为57.3kJ·mol-1,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式
您最近一年使用:0次
2022-01-14更新
|
203次组卷
|
3卷引用:陕西省安康市六校联考2021-2022学年高二上学期期末考试化学试题
名校
解题方法
10 . 能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为_________________________ ;该反应在________ 条件下能自发进行(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)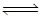 CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
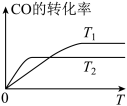
①T1________ T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1________ (填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是________ (填字母)。
a.降低温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是___________________ ;
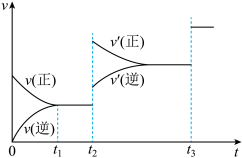
t3时采取的措施可能是_________________ 。
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=________ (MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。负极加入的物质是________ ;正极的电极反应为_______________________ 。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)
 CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
①T1
②若容器容积不变,下列措施不能增加CO转化率的是
a.降低温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是

t3时采取的措施可能是
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。负极加入的物质是
您最近一年使用:0次
2020-03-03更新
|
878次组卷
|
3卷引用:陕西省渭南市大荔县2019-2020学年高二上学期期末教学质量检测化学试题
陕西省渭南市大荔县2019-2020学年高二上学期期末教学质量检测化学试题湖北省咸宁市崇阳一中2019-2020学年高二3月月考化学试题(已下线)本册综合检测(二)——2020-2021学年高二化学选修四同步单元AB卷(人教版)



