1 . 已知:25℃、101kPa时,
Mn(s)+O2(g)=MnO2(s) ∆H=-520kJ/mol
S(s)+O2(g)=SO2(g) ∆H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) ∆H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是___________ 。
Mn(s)+O2(g)=MnO2(s) ∆H=-520kJ/mol
S(s)+O2(g)=SO2(g) ∆H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) ∆H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是
您最近一年使用:0次
2 . 碳的单质及化合物在人类生产生活中起着非常重要的作用。请回答下列问题:
(1)已知CH3OH(l)的燃烧热 ,
,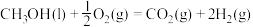
 ,则
,则
______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)Cl2(g)和H2O(g)通过灼热的炭层,生成HCl(g)和CO2(g),当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:___________ 。
(3)火箭和导弹表面的薄层是耐高温物质。下列反应可制得耐高温材料,热化学方程式为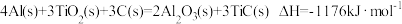 。该反应过程中每转移1mol电子放出的热量为
。该反应过程中每转移1mol电子放出的热量为_________ kJ。
(4)工业上乙烯催化氧化制乙醛的反应原理为: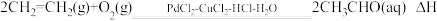 ,该反应原理可以拆解为如下三步反应:
,该反应原理可以拆解为如下三步反应:
I.
II.……
III.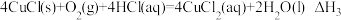
若第II步反应的反应热为 ,且
,且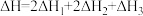 ,则第II步反应的热化学方程式为
,则第II步反应的热化学方程式为__ 。
(5)山西是全国最大的炼焦用煤资源基地,炼焦过程的副产品之一焦炉煤气富含H2、CH4和CO,因此可通过甲烷化反应来提高热值,使绝大部分CO、CO2转化成CH4.甲烷化反应的主要化学原理为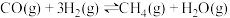 ,已知CO分子中的C与O之间为共价三键。下表所列为常见化学键的键能数据(键能指气态分子中1mol化学键解离成气态原子所吸收的能量):
,已知CO分子中的C与O之间为共价三键。下表所列为常见化学键的键能数据(键能指气态分子中1mol化学键解离成气态原子所吸收的能量):
该反应的
__________  。
。
(1)已知CH3OH(l)的燃烧热
 ,
,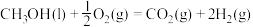
 ,则
,则
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)Cl2(g)和H2O(g)通过灼热的炭层,生成HCl(g)和CO2(g),当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:
(3)火箭和导弹表面的薄层是耐高温物质。下列反应可制得耐高温材料,热化学方程式为
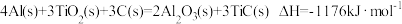 。该反应过程中每转移1mol电子放出的热量为
。该反应过程中每转移1mol电子放出的热量为(4)工业上乙烯催化氧化制乙醛的反应原理为:
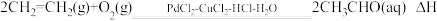 ,该反应原理可以拆解为如下三步反应:
,该反应原理可以拆解为如下三步反应:I.

II.……
III.
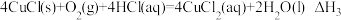
若第II步反应的反应热为
 ,且
,且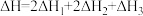 ,则第II步反应的热化学方程式为
,则第II步反应的热化学方程式为(5)山西是全国最大的炼焦用煤资源基地,炼焦过程的副产品之一焦炉煤气富含H2、CH4和CO,因此可通过甲烷化反应来提高热值,使绝大部分CO、CO2转化成CH4.甲烷化反应的主要化学原理为
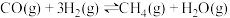 ,已知CO分子中的C与O之间为共价三键。下表所列为常见化学键的键能数据(键能指气态分子中1mol化学键解离成气态原子所吸收的能量):
,已知CO分子中的C与O之间为共价三键。下表所列为常见化学键的键能数据(键能指气态分子中1mol化学键解离成气态原子所吸收的能量):| 化学键 |  |  |  |  |  |  |
键能/( ) ) | 347.7 | 413.4 | 436 | 351 | 1065 | 462.8 |

 。
。
您最近一年使用:0次
名校
解题方法
3 . 工业合成氨的反应N2+3H2=2NH3的能量变化如图所示,请回答有关问题:
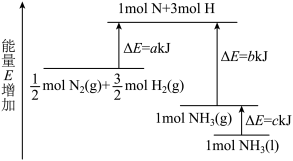
(1)合成1molNH3(l)___________ (填“吸收”或“放出”)___________ kJ的热量。(用字母表示)
(2)已知:拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2(g)完全反应生成NH3(g)产生的能量变化为___________ kJ。
(3)推测反应2NH3(l)=N2(g)+3H2(g)比反应2NH3(g)=N2(g)+3H2(g)___________ (填“吸收”或“放出”)的热量___________ (填“多”或“少”)。

(1)合成1molNH3(l)
(2)已知:拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2(g)完全反应生成NH3(g)产生的能量变化为
(3)推测反应2NH3(l)=N2(g)+3H2(g)比反应2NH3(g)=N2(g)+3H2(g)
您最近一年使用:0次
2021-05-03更新
|
300次组卷
|
8卷引用:山西省朔州市应县第一中学校2019-2020学年高一下学期期中考试化学试题
山西省朔州市应县第一中学校2019-2020学年高一下学期期中考试化学试题江西省南昌市八一中学、洪都中学等七校2020-2021学年高一下学期期中联考化学试题安徽省滁州市定远县育才学校2020-2021学年高一下学期期中考试化学试题江西省赣州市南康区第三中学2020-2021学年高一下学期期中考试化学试题黑龙江省齐齐哈尔市第八中学校2020-2021学年高一下学期期中考试化学试题陕西省渭南市华州区咸林中学2022-2023学年高一下学期期中考试化学试题(已下线)练习3 化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版)云南省昌宁县第一中学2021-2022学年高一 3月月考化学试题
解题方法
4 . 能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是___ (填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源
d.减少资源消耗,增加资源的重复使用和循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
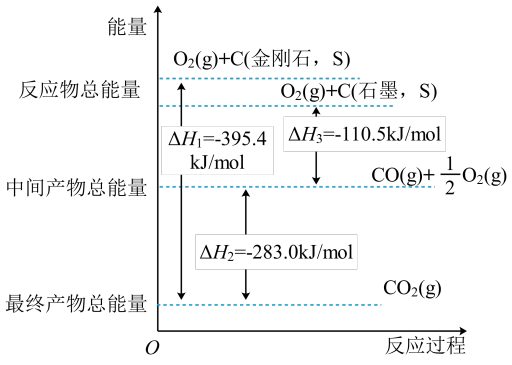
①在通常状况下,___ (填“金刚石”或“石墨”)更稳定;石墨的燃烧热△H为___ 。
②若12g金刚石在24g氧气中燃烧,生成气体36g,则该过程放出的热量为___ 。
(3)已知:N2、O2分子中化学键的键能分别是946mol·L-1、497mol·L-1,N2(g)+O2(g)=2NO(g)△H=+180.0kJ·mol-1,则NO分子中化学键的键能为___ kJ·mol-1。
(4)综合上述有关信息,请写出CO和NO反应生成两种无毒气体的热化学方程式:___ 。
(1)下列做法有助于能源“开源节流”的是
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源
d.减少资源消耗,增加资源的重复使用和循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下,
②若12g金刚石在24g氧气中燃烧,生成气体36g,则该过程放出的热量为
(3)已知:N2、O2分子中化学键的键能分别是946mol·L-1、497mol·L-1,N2(g)+O2(g)=2NO(g)△H=+180.0kJ·mol-1,则NO分子中化学键的键能为
(4)综合上述有关信息,请写出CO和NO反应生成两种无毒气体的热化学方程式:
您最近一年使用:0次
2020-11-24更新
|
370次组卷
|
2卷引用:山西省太原市2020-2021学年高二上学期期中质量监测化学(理)试题
名校
5 . 戴口罩是防控新型冠状病毒的重要手段,口罩生产的主要原料聚丙烯由丙烯聚合而来。丙烷脱氢是丙烯工业生产的重要途径。反应的热化学方程式为C3H8(g) C3H6(g)+H2(g) △H>0。回答下列问题:
C3H6(g)+H2(g) △H>0。回答下列问题:
(1)从工业生产的角度来看。制备丙烯所用的丙烷可以从下面工业气体中获得的是___ 。
A.液化石油气 B.炼铁高炉尾气 C.水煤气 D.焦炉气
(2)104Pa、105Pa时由一定量丙烷脱氢制丙烯,反应在不同温度下达到平衡,测得丙烷、丙烯的物质的量分数变化关系如图所示。

①104Pa时丙烷及丙烯的物质的量分数随温度变化关系的曲线分别是___ 、___ 。
②丙烷脱氢制丙烯反应在___ (选“高温”或“低温”)时更加容易自发进行。
③起始时充入一定量的丙烷发生反应,计算Q点对应温度下该反应的平衡常数KP=___ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)一种丙烷脱氢制丙烯工艺生产中增加了氧化脱氢部分,O2被引入到脱氢反应体系中,这样做的好处是___ 。
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。其反应机理如图所示。

已知:CO和C3H4、C3H6的燃烧热△H分别为-283•0kJ•mol-1、-2217.8kJ•mol-1、-2049.0kJ•mol-1。
②298K时,该工艺总反应的热化学方程式为___ 。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是___ 。
 C3H6(g)+H2(g) △H>0。回答下列问题:
C3H6(g)+H2(g) △H>0。回答下列问题:(1)从工业生产的角度来看。制备丙烯所用的丙烷可以从下面工业气体中获得的是
A.液化石油气 B.炼铁高炉尾气 C.水煤气 D.焦炉气
(2)104Pa、105Pa时由一定量丙烷脱氢制丙烯,反应在不同温度下达到平衡,测得丙烷、丙烯的物质的量分数变化关系如图所示。

①104Pa时丙烷及丙烯的物质的量分数随温度变化关系的曲线分别是
②丙烷脱氢制丙烯反应在
③起始时充入一定量的丙烷发生反应,计算Q点对应温度下该反应的平衡常数KP=
(3)一种丙烷脱氢制丙烯工艺生产中增加了氧化脱氢部分,O2被引入到脱氢反应体系中,这样做的好处是
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。其反应机理如图所示。

已知:CO和C3H4、C3H6的燃烧热△H分别为-283•0kJ•mol-1、-2217.8kJ•mol-1、-2049.0kJ•mol-1。
②298K时,该工艺总反应的热化学方程式为
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是
您最近一年使用:0次
2020-08-28更新
|
544次组卷
|
5卷引用:山西省大同市第一中学2021届高三上学期期中质量检测化学试题
山西省大同市第一中学2021届高三上学期期中质量检测化学试题河南省洛阳市2020届高三第三次统一考试理综化学试题(已下线)专题14 化学反应原理综合-2020年高考真题和模拟题化学分项汇编河南省洛阳市2020届高三三模化学试卷江西省吉安一中2021-2022学年高二上学期第一次段考化学试题
解题方法
6 . 由化学能产生的能量是目前人类使用的主要能源。
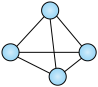
(1)意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构为正四面体(如图所示),与白磷分子相似。已知断裂1molN-N键吸收167kJ热量,生成1molN N键放出942kJ热量。根据以上信息和数据,写出N2气体转化为N4气体的热化学方程式:
N键放出942kJ热量。根据以上信息和数据,写出N2气体转化为N4气体的热化学方程式:___ 。
(2)自嗨锅(自热火锅)的加热原理是利用发热包内的物质与水接触,释放出热量,从而使得上面隔层食材锅内的食物吸收热量后温度升高。一般自嗨锅的发热包是用碳酸钠、焙烧硅藻土、铁粉、铝粉、焦炭粉、活性炭、盐、生石灰等组成,写出发热包中的某一物质与水发生放热反应的化学方程式:___ 。(写出一个即可)
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2gSiH4自燃放出热量89.2kJ,则SiH4自燃的热化学方程式为:__ 。
(4)比较下列两个热化学方程式中ΔH的大小。
4Al(s)+3O2(g)=2Al2O3(s) △H1 4Fe(s)+3O2(g)=2Fe2O3(s) △H2
△H2__ △H1,(填“>”、“<"或“=")
(5)已知:2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=+181kJ·mol-1
若某反应的平衡常数表达式为K=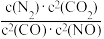 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:___ 。
(1)意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构为正四面体(如图所示),与白磷分子相似。已知断裂1molN-N键吸收167kJ热量,生成1molN
 N键放出942kJ热量。根据以上信息和数据,写出N2气体转化为N4气体的热化学方程式:
N键放出942kJ热量。根据以上信息和数据,写出N2气体转化为N4气体的热化学方程式:
(2)自嗨锅(自热火锅)的加热原理是利用发热包内的物质与水接触,释放出热量,从而使得上面隔层食材锅内的食物吸收热量后温度升高。一般自嗨锅的发热包是用碳酸钠、焙烧硅藻土、铁粉、铝粉、焦炭粉、活性炭、盐、生石灰等组成,写出发热包中的某一物质与水发生放热反应的化学方程式:
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2gSiH4自燃放出热量89.2kJ,则SiH4自燃的热化学方程式为:
(4)比较下列两个热化学方程式中ΔH的大小。
4Al(s)+3O2(g)=2Al2O3(s) △H1 4Fe(s)+3O2(g)=2Fe2O3(s) △H2
△H2
(5)已知:2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=+181kJ·mol-1
若某反应的平衡常数表达式为K=
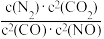 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:
您最近一年使用:0次
名校
解题方法
7 . (1)写出下列物质在水溶液中的电离方程式:
CH3COOH____ HClO4_____
Fe(OH)3____ Ba(OH)2_____
NaHSO4____
(2)常温下2.3g乙醇和一定量的氧气混合,点燃恰好完全燃烧,生成液态水和CO2放出68.35kJ热量,则该反应的热化学方程式为:___ 。
(3)根据下列热化学方程式分析,C(s)的燃烧热△H等于___ 。
C(s)+H2O(l)=CO(g)+H2(g) △H1=+175.3kJ·mol-1
2CO(g) + O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g) + O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
CH3COOH
Fe(OH)3
NaHSO4
(2)常温下2.3g乙醇和一定量的氧气混合,点燃恰好完全燃烧,生成液态水和CO2放出68.35kJ热量,则该反应的热化学方程式为:
(3)根据下列热化学方程式分析,C(s)的燃烧热△H等于
C(s)+H2O(l)=CO(g)+H2(g) △H1=+175.3kJ·mol-1
2CO(g) + O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g) + O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
您最近一年使用:0次
名校
8 . 实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=c(H2O)/[ c(CO)·c(H2)]所对应的化学反应方程式为:________ 。
(2)已知在一定温度下:
①C(s)+CO2(g) 2CO(g) △H1=a kJ/mol 平衡常数K1;
2CO(g) △H1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g) H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g) CO(g)+H2(g) △H3 平衡常数K3。
CO(g)+H2(g) △H3 平衡常数K3。
则K1、K2、K3之间的关系是:________ ,△H3=________ (用含a、b的代数式表示)。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是________ 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为:________ 。
(1)已知某温度下某反应的化学平衡常数表达式为:K=c(H2O)/[ c(CO)·c(H2)]所对应的化学反应方程式为:
(2)已知在一定温度下:
①C(s)+CO2(g)
 2CO(g) △H1=a kJ/mol 平衡常数K1;
2CO(g) △H1=a kJ/mol 平衡常数K1;②CO(g)+H2O(g)
 H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;③C(s)+H2O(g)
 CO(g)+H2(g) △H3 平衡常数K3。
CO(g)+H2(g) △H3 平衡常数K3。则K1、K2、K3之间的关系是:
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)
 H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是
您最近一年使用:0次
9 . I.可逆反应2Cl2(g)+2H2O(g) 4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
(1)降低温度,Cl2的转化率________ ;v正 ________________ ;
(2)保持容器体积不变,加入He,则HCl的物质的量_______________________ .
(3)保持容器压强不变,加入He,则O2的体积分数______________________ ;
(4)若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度____________ ,相对分子质量 ______________________ .
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1.
利用CO、H2合成液态甲醇的热化学方程式为____________________________________
 4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):(1)降低温度,Cl2的转化率
(2)保持容器体积不变,加入He,则HCl的物质的量
(3)保持容器压强不变,加入He,则O2的体积分数
(4)若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1.
利用CO、H2合成液态甲醇的热化学方程式为
您最近一年使用:0次
名校
10 . (1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652kJ的热量。
反应的热化学方程式为___________________________________________ 。
又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是___________ kJ。
(2)已知: C(s)+ O2(g) = CO2(g) △H2=-393.5kJ/mol
H2(g)+1/2 O2(g) =H2O(g) △H3 = -241.8 kJ/mol
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中 C与 H2的物质的量之比为___________________ 。
(3)盖斯定律在生产和科学研究中有很重要的意义。现根据下列2个热化学方程式: Fe2O3(s)+3CO(g)=Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
Fe2O3(s)+CO(g)=2FeO(s)+CO2(g) ΔH=+411.2kJ/mol
写出CO(g)还原FeO(s)得到Fe(s)和CO2(g)的热化学方程式:___________ 。
反应的热化学方程式为
又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是
(2)已知: C(s)+ O2(g) = CO2(g) △H2=-393.5kJ/mol
H2(g)+1/2 O2(g) =H2O(g) △H3 = -241.8 kJ/mol
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中 C与 H2的物质的量之比为
(3)盖斯定律在生产和科学研究中有很重要的意义。现根据下列2个热化学方程式: Fe2O3(s)+3CO(g)=Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
Fe2O3(s)+CO(g)=2FeO(s)+CO2(g) ΔH=+411.2kJ/mol
写出CO(g)还原FeO(s)得到Fe(s)和CO2(g)的热化学方程式:
您最近一年使用:0次
2018-11-30更新
|
137次组卷
|
2卷引用:山西省晋中市平遥县第二中学2018-2019学年高二上学期期中考试化学试题



