I.可逆反应2Cl2(g)+2H2O(g) 4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
(1)降低温度,Cl2的转化率________ ;v正 ________________ ;
(2)保持容器体积不变,加入He,则HCl的物质的量_______________________ .
(3)保持容器压强不变,加入He,则O2的体积分数______________________ ;
(4)若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度____________ ,相对分子质量 ______________________ .
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1.
利用CO、H2合成液态甲醇的热化学方程式为____________________________________
 4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):(1)降低温度,Cl2的转化率
(2)保持容器体积不变,加入He,则HCl的物质的量
(3)保持容器压强不变,加入He,则O2的体积分数
(4)若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1.
利用CO、H2合成液态甲醇的热化学方程式为
更新时间:2018/11/30 08:12:17
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】(1)在101kPa时,H2在1mol O2中完全燃烧生成2mol液态水,放出571.6kJ的热量,H2的燃烧热为___ ,表示H2燃烧热的热化学方程式为___ 。
(2)①已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H= +206.2kJ·mol-1,CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.4kJ·mol-1,则以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:____ 。
②由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据,则N2(g)+3H2(g) 2NH3(g) △H=
2NH3(g) △H=__ kJ·mol-1。
(2)①已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H= +206.2kJ·mol-1,CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.4kJ·mol-1,则以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:
②由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据,则N2(g)+3H2(g)
 2NH3(g) △H=
2NH3(g) △H=| 化学键 | H-H | N-H | N≡N |
| 键能kJ·mol-1 | 436 | 391 | 945 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】Ⅰ.已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l) △H=-570kJ/mol
②2H2O(g)=2H2(g)+O2(g) △H=+483.6kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_______ (填写序号)。
(2)燃烧10gH2生成液态水,放出的热量为_______ 。
(3)已知:1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应,写出该中和热的热化学方程式为_______ 。
Ⅱ.已知:工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.7kJ·mol-1 ①
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 ②
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
(4)反应器中的总反应可表示为3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),计算该反应的ΔH=_______ 。
①2H2(g)+O2(g)=2H2O(l) △H=-570kJ/mol
②2H2O(g)=2H2(g)+O2(g) △H=+483.6kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是
(2)燃烧10gH2生成液态水,放出的热量为
(3)已知:1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应,写出该中和热的热化学方程式为
Ⅱ.已知:工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.7kJ·mol-1 ①
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 ②
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
(4)反应器中的总反应可表示为3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),计算该反应的ΔH=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】化学变化总是伴随着能量变化,能源发展很大程度上依赖于以化学为核心的技术发展。 与
与 经催化重整,制得合成气:
经催化重整,制得合成气:
 kJ⋅mol
kJ⋅mol 。
。
(1)请在下图中,绘制该反应方向箭头(用→表示),并在合适位置标明物质与焓变___________ 。
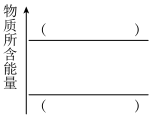
(2)常温下,在2 L恒容密闭容器中,下列能说明该反应达到平衡状态的是___________。
(3)按一定体积比加入 和
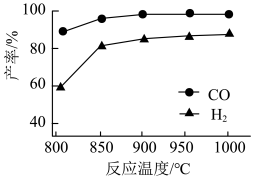
和 ,在一定压强下发生反应,温度对CO和
,在一定压强下发生反应,温度对CO和 平衡产率的影响如右图所示。此反应优选温度为900℃的原因是:
平衡产率的影响如右图所示。此反应优选温度为900℃的原因是:___________ 。
 与
与 经催化重整,制得合成气:
经催化重整,制得合成气:
 kJ⋅mol
kJ⋅mol 。
。(1)请在下图中,绘制该反应方向箭头(用→表示),并在合适位置标明物质与焓变

(2)常温下,在2 L恒容密闭容器中,下列能说明该反应达到平衡状态的是___________。
A.每消耗16 g  的同时生成4 g 的同时生成4 g  |
| B.容器中气体的压强不再改变 |
| C.混和气体的平均相对分子质量不发生改变 |
| D.容器中气体的密度不再改变 |
(3)按一定体积比加入
 和
和 ,在一定压强下发生反应,温度对CO和
,在一定压强下发生反应,温度对CO和 平衡产率的影响如右图所示。此反应优选温度为900℃的原因是:
平衡产率的影响如右图所示。此反应优选温度为900℃的原因是:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】反应A(g)+B(g C(g) +D(g)过程中的能量变化如下图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如下图所示,回答下列问题。
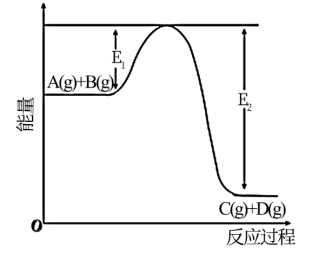
(1)该反应是_____ 反应(填“吸热”“放热”);
(2)反应体系中加入催化剂对反应热是否有影响?_________________________  ,原因是
,原因是______________________________________________ (从能量说明)
 C(g) +D(g)过程中的能量变化如下图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如下图所示,回答下列问题。
(1)该反应是
(2)反应体系中加入催化剂对反应热是否有影响?
 ,原因是
,原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】工业上合成氨的化学反应为N2(g)+3H2(g) ⇌ 2NH3(g)ΔH=-92.4kJ·mol-1。在容积为10L的密闭容器中,通入40molN2和120molH2在一定条件下进行反应,4s后达到平衡状态,此时N2的浓度为2mol·L-1。通过计算回答下列问题:
(1)该反应的ΔS_____ 0。
(2)4s内,用N2表示的平均反应速率是_____ 。
(3)在该条件下N2的最大转化率是_____ ;此时平衡常数为_____ (结果保留两位有效数字,下同),混合气体中NH3的体积分数是_______ 。
(4)为了提高氨气的产率,可以选择的方法是_____ (填序号)。
①升高温度 ②增大压强 ③使用催化剂 ④及时分离出NH3
(1)该反应的ΔS
(2)4s内,用N2表示的平均反应速率是
(3)在该条件下N2的最大转化率是
(4)为了提高氨气的产率,可以选择的方法是
①升高温度 ②增大压强 ③使用催化剂 ④及时分离出NH3
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】容积可变的密闭容器中,反应2SO2(g)十O2(g)  2SO3(g)在一定条件下达到平衡,完成下列填空:
2SO3(g)在一定条件下达到平衡,完成下列填空:
(1)工业上该反应是在________ (填设备名称)进行的,所用的催化剂是________ 。
(2)其他条件不变时,降低温度,平衡向正反应方向移动,则正反应为_______ (选填“吸热”“放热”)。下图为反应速率(ν)与时间(t)的关系,判断在t1时刻曲线发生变化的原因是__________ (选填编号)。

a.增大O2的浓度
b. 扩大容器体积
c. 加入催化剂
d. 升高温度
(3)改变条件后,平衡混合物中SO3的百分含量_______ (选填“增大”“减小”“不变”)。
(4)工业上用氨水来吸收SO2尾气,最终形成化肥(NH4)2 SO4,将(NH4)2 SO4固体溶于水,溶液呈_______ 性,理由是____________________ (用离子方程式表示),该溶液体系中存在多种守恒,请任写出其中一种守恒关系(用离子浓度表示) _______________________ 。
 2SO3(g)在一定条件下达到平衡,完成下列填空:
2SO3(g)在一定条件下达到平衡,完成下列填空:(1)工业上该反应是在
(2)其他条件不变时,降低温度,平衡向正反应方向移动,则正反应为

a.增大O2的浓度
b. 扩大容器体积
c. 加入催化剂
d. 升高温度
(3)改变条件后,平衡混合物中SO3的百分含量
(4)工业上用氨水来吸收SO2尾气,最终形成化肥(NH4)2 SO4,将(NH4)2 SO4固体溶于水,溶液呈
您最近一年使用:0次



