实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=c(H2O)/[ c(CO)·c(H2)]所对应的化学反应方程式为:________ 。
(2)已知在一定温度下:
①C(s)+CO2(g) 2CO(g) △H1=a kJ/mol 平衡常数K1;
2CO(g) △H1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g) H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g) CO(g)+H2(g) △H3 平衡常数K3。
CO(g)+H2(g) △H3 平衡常数K3。
则K1、K2、K3之间的关系是:________ ,△H3=________ (用含a、b的代数式表示)。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是________ 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为:________ 。
(1)已知某温度下某反应的化学平衡常数表达式为:K=c(H2O)/[ c(CO)·c(H2)]所对应的化学反应方程式为:
(2)已知在一定温度下:
①C(s)+CO2(g)
 2CO(g) △H1=a kJ/mol 平衡常数K1;
2CO(g) △H1=a kJ/mol 平衡常数K1;②CO(g)+H2O(g)
 H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;③C(s)+H2O(g)
 CO(g)+H2(g) △H3 平衡常数K3。
CO(g)+H2(g) △H3 平衡常数K3。则K1、K2、K3之间的关系是:
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)
 H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是
更新时间:2018-12-19 19:20:14
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】次氯酸钠氧化法可以制备Na2FeO4。
已知:2H2(g)+O2(g)=2H2O(l) ΔH=akJ·mol-1
NaCl(aq)+H2O(l)=NaClO(aq)+H2(g) ΔH=bkJ·mol-1
4Na2FeO4(aq)+10H2O(l)=4Fe(OH)3(s)+3O2(g)+8NaOH(aq) ΔH=ckJ·mol-1
反应2Fe(OH)3(s)+3NaClO(aq)+4NaOH(aq)=2Na2FeO4(aq)+3NaCl(aq)+5H2O(l)的ΔH=_____ kJ·mol-1.
已知:2H2(g)+O2(g)=2H2O(l) ΔH=akJ·mol-1
NaCl(aq)+H2O(l)=NaClO(aq)+H2(g) ΔH=bkJ·mol-1
4Na2FeO4(aq)+10H2O(l)=4Fe(OH)3(s)+3O2(g)+8NaOH(aq) ΔH=ckJ·mol-1
反应2Fe(OH)3(s)+3NaClO(aq)+4NaOH(aq)=2Na2FeO4(aq)+3NaCl(aq)+5H2O(l)的ΔH=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】CO2的有效利用可以缓解温室效应和能源短缺问题。
(1)CO2的分子结构决定了其性质和用途。
①CO2的电子式是_____________ 。
②在温度高于31.26 ℃、压强高于7.29×106Pa时,CO2处于超临界状态,称为超临界CO2流体,它可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,用超临界CO2萃取的优点有:___________ (答出一点即可)。
(2)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如下图。
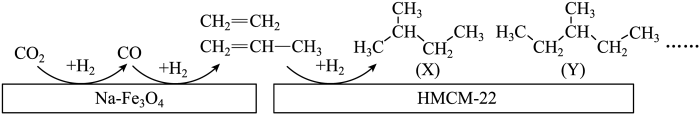
上图中CO2转化为CO的反应为:CO2(g)+H2(g) = CO(g)+H2O(g) △H= +41kJ/mol
已知:2CO2(g)+6H2(g) = C2H4(g)+4H2O(g) △H= -128kJ/mol
①则图中CO转化为C2H4的热化学方程式是____________________ 。
②关于X与Y的说法正确的是________ (填序号〕。
a.实验式相同 b.都有4种一氯代物
c.都易使酸性KMnO4溶液褪色 d.互为同系物
③催化剂中Fe3O4的制备方法如下:将一定比例的FeCl2和FeCl3溶于盐酸,然后在 60 ℃下逐滴加入NaOH溶液至pH≈10,继续搅拌,得Fe3O4。该反应的离子方程式是____________________ 。
(1)CO2的分子结构决定了其性质和用途。
①CO2的电子式是
②在温度高于31.26 ℃、压强高于7.29×106Pa时,CO2处于超临界状态,称为超临界CO2流体,它可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,用超临界CO2萃取的优点有:
(2)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如下图。

上图中CO2转化为CO的反应为:CO2(g)+H2(g) = CO(g)+H2O(g) △H= +41kJ/mol
已知:2CO2(g)+6H2(g) = C2H4(g)+4H2O(g) △H= -128kJ/mol
①则图中CO转化为C2H4的热化学方程式是
②关于X与Y的说法正确的是
a.实验式相同 b.都有4种一氯代物
c.都易使酸性KMnO4溶液褪色 d.互为同系物
③催化剂中Fe3O4的制备方法如下:将一定比例的FeCl2和FeCl3溶于盐酸,然后在 60 ℃下逐滴加入NaOH溶液至pH≈10,继续搅拌,得Fe3O4。该反应的离子方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】已知:
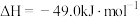 ,该反应一般通过如下步骤来实现:
,该反应一般通过如下步骤来实现:
①

②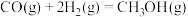
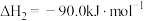
(1)反应①的
___________ 。
(2)反应①为慢反应,下列示意图中能体现该反应能量变化的是___________。
(3)若 和
和 按一定投料比发生反应
按一定投料比发生反应 ,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示。490K之后,甲醇产率下降,请分析其变化产生的原因:
,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示。490K之后,甲醇产率下降,请分析其变化产生的原因:
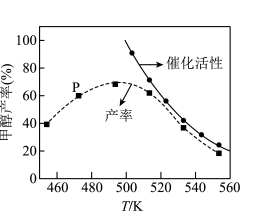
原因1:___________ 、原因2:___________ 。(任填2个原因)

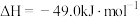 ,该反应一般通过如下步骤来实现:
,该反应一般通过如下步骤来实现:①


②
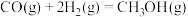
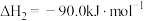
(1)反应①的

(2)反应①为慢反应,下列示意图中能体现该反应能量变化的是___________。
A.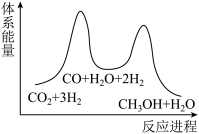 | B.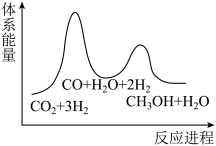 |
C.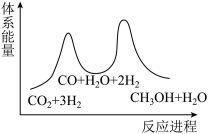 | D.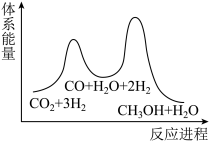 |
(3)若
 和
和 按一定投料比发生反应
按一定投料比发生反应 ,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示。490K之后,甲醇产率下降,请分析其变化产生的原因:
,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示。490K之后,甲醇产率下降,请分析其变化产生的原因:
原因1:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)⇌Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
(1)上述生成Ni(CO)4(g)的反应为_______ 反应(填“放热”或“吸热”)
(2)在25 ℃时,反应Ni(CO)4(g)⇌Ni(s)+4CO(g)的平衡常数为_______ 。
(3)在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v正_______ v逆。
(4)在80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为_______ 。
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
(2)在25 ℃时,反应Ni(CO)4(g)⇌Ni(s)+4CO(g)的平衡常数为
(3)在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v正
(4)在80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】对可逆反应aA(g)+bB(g) cC(g)+dD(g),达到平衡时,各物质的物质的量浓度应满足以下关系:
cC(g)+dD(g),达到平衡时,各物质的物质的量浓度应满足以下关系: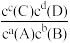 =K,K为一常数,称为化学平衡常数,其反应的K值只与温度有关,现有反应:CO(g)+H2O(g)
=K,K为一常数,称为化学平衡常数,其反应的K值只与温度有关,现有反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,在850℃时,K=1。
CO2(g)+H2(g) ΔH<0,在850℃时,K=1。
(1)若升高温度到950℃,达到平衡时K________ (填“大于”、“小于”或“等于”)1。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向________ (填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________ 。
 cC(g)+dD(g),达到平衡时,各物质的物质的量浓度应满足以下关系:
cC(g)+dD(g),达到平衡时,各物质的物质的量浓度应满足以下关系: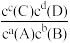 =K,K为一常数,称为化学平衡常数,其反应的K值只与温度有关,现有反应:CO(g)+H2O(g)
=K,K为一常数,称为化学平衡常数,其反应的K值只与温度有关,现有反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,在850℃时,K=1。
CO2(g)+H2(g) ΔH<0,在850℃时,K=1。(1)若升高温度到950℃,达到平衡时K
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】Cu2O是一种重要的工业原料,广泛川作催化剂。
Ⅰ.制备Cu2O
(1)微乳液—还原法:在100℃的Cu(NO3)2溶液中加入一定体积的NaOH溶液,搅拌均匀,再逐滴加入肼(N2H4)产生红色沉淀,抽滤、洗涤、干燥,得到Cu2O。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-akJ·mol-1
Cu(OH)2(s)=CuO(s)+H2O(l)△H=+bkJ·mol-1
4CuO(s)=2Cu2O(s)+O2(g)△H=+ckJ·mol-1
则由N2H4(l)和Cu(OH)2(s)反应制备Cu2O(s)的热化学方程式为__ 。
(2)电解法:纳米级Cu2O由于具有优良的催化性能而受到关注。
采用阴离子交换膜制备纳米级Cu2O的装置如图所示:

阳极的电极反应式为___ 。
Ⅱ.纳米级Cu2O催化剂可用于工业上合成甲醇:CO(g)+2H2(g) CH3OH(g)△H=-90.8kJ·mol-1
CH3OH(g)△H=-90.8kJ·mol-1
(3)能说明反应CO(g)+2H2(g) CH3OH(g)已达平衡状态的是
CH3OH(g)已达平衡状态的是__ (填字母)。
A.CO的消耗速率等于CH3OH的生成速率
B.一定条件,CO的转化率不再变化
C.在绝热恒容的容器中,反应的平衡常数不再变化
(4)t℃时,在体积为2L固定体积的密闭容器中加入2.00molH2(g)和1.00mol的CO(g)的物质的量随时间的变化如表:
根据表中数据回答:
①氢气平衡转化率为___ 。
②2t℃时该反应的平衡常数为___ 。
③保持其它条件不变,向平衡体系中充入1molCO(g)、2molH2(g)、1molCH3OH(g);此时v正__ v逆(填“>”“<”或“=”)。
(5)工业实际合成CH3OH生产中,采用如图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:__ 。

Ⅰ.制备Cu2O
(1)微乳液—还原法:在100℃的Cu(NO3)2溶液中加入一定体积的NaOH溶液,搅拌均匀,再逐滴加入肼(N2H4)产生红色沉淀,抽滤、洗涤、干燥,得到Cu2O。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-akJ·mol-1
Cu(OH)2(s)=CuO(s)+H2O(l)△H=+bkJ·mol-1
4CuO(s)=2Cu2O(s)+O2(g)△H=+ckJ·mol-1
则由N2H4(l)和Cu(OH)2(s)反应制备Cu2O(s)的热化学方程式为
(2)电解法:纳米级Cu2O由于具有优良的催化性能而受到关注。
采用阴离子交换膜制备纳米级Cu2O的装置如图所示:

阳极的电极反应式为
Ⅱ.纳米级Cu2O催化剂可用于工业上合成甲醇:CO(g)+2H2(g)
 CH3OH(g)△H=-90.8kJ·mol-1
CH3OH(g)△H=-90.8kJ·mol-1(3)能说明反应CO(g)+2H2(g)
 CH3OH(g)已达平衡状态的是
CH3OH(g)已达平衡状态的是A.CO的消耗速率等于CH3OH的生成速率
B.一定条件,CO的转化率不再变化
C.在绝热恒容的容器中,反应的平衡常数不再变化
(4)t℃时,在体积为2L固定体积的密闭容器中加入2.00molH2(g)和1.00mol的CO(g)的物质的量随时间的变化如表:
| 时间(s) | 0 | 2 | 5 | 10 | 20 | 40 | 80 |
| 物质的量(mol) | 1.00 | 0.50 | 0.375 | 0.25 | 0.20 | 0.20 | 0.20 |
①氢气平衡转化率为
②2t℃时该反应的平衡常数为
③保持其它条件不变,向平衡体系中充入1molCO(g)、2molH2(g)、1molCH3OH(g);此时v正
(5)工业实际合成CH3OH生产中,采用如图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:

您最近一年使用:0次



