名校
1 . 羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应:COS(g)+ H2O(g) H2S(g) +CO2(g) △H=-34 kJ·mol1
H2S(g) +CO2(g) △H=-34 kJ·mol1
氢解反应:COS(g) +H2(g) H2S(g)+CO(g) △H=+7 kJ·mol1。
H2S(g)+CO(g) △H=+7 kJ·mol1。
已知:2H2(g) +O2(g)=== 2H2O(g) △H=-484 kJ·mol1。
写出表示CO燃烧热的热化学方程式:______________ 。
(2)氢解反应达到平衡后,保持体系的温度和总压强不变,通入适量的He,正反应速率______ (填“增大”“减小”或“不变”,下同),COS 的转化率_______ 。
(3)某温度下,向体积为2L的恒容密闭容器中通入2molCOS(g)和4molH2O(g),发生水解反应,5 min后反应达到平衡,测得COS(g)的转化率为75%。
回答下列问题:
①反应从起始至5 min 内,v(H2S)=_______ mol·L-1·min-1。
②该温度下,上述水解反应的平衡常数K=____________ 。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应:COS(g)+ H2O(g)
 H2S(g) +CO2(g) △H=-34 kJ·mol1
H2S(g) +CO2(g) △H=-34 kJ·mol1氢解反应:COS(g) +H2(g)
 H2S(g)+CO(g) △H=+7 kJ·mol1。
H2S(g)+CO(g) △H=+7 kJ·mol1。已知:2H2(g) +O2(g)=== 2H2O(g) △H=-484 kJ·mol1。
写出表示CO燃烧热的热化学方程式:
(2)氢解反应达到平衡后,保持体系的温度和总压强不变,通入适量的He,正反应速率
(3)某温度下,向体积为2L的恒容密闭容器中通入2molCOS(g)和4molH2O(g),发生水解反应,5 min后反应达到平衡,测得COS(g)的转化率为75%。
回答下列问题:
①反应从起始至5 min 内,v(H2S)=
②该温度下,上述水解反应的平衡常数K=
您最近一年使用:0次
2017-11-19更新
|
315次组卷
|
5卷引用:山西省临汾一中、康杰中学、鄂尔多斯一中等五校2017-2018学年高二上学期期中联考化学试题
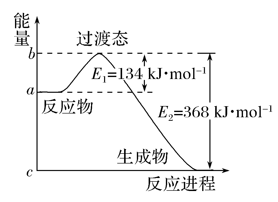
2 . (1)如图是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,则E1________ (填“增大”、“减小”或“不变”,下同),ΔH________ 。请写出NO2和CO反应的热化学方程式:________________ 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ· mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ· mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ· mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式为________________________________________________________________ 。

(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ· mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ· mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ· mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式为
您最近一年使用:0次
2017-08-19更新
|
155次组卷
|
3卷引用:山西省天镇县实验中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
3 . 保护环境已成为当前和未来的一项全球性重大课题.为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示:
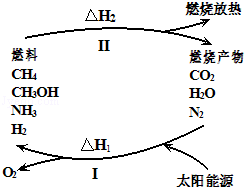
过程I可用如下反应表示:
①2CO2 2CO+O2
2CO+O2
②2H2O 2H2+O2
2H2+O2
③2N2+6H2O 4NH3+3O2
4NH3+3O2
④2CO2+4H2O 2CH3OH+3O2
2CH3OH+3O2
⑤2CO+H2O ?+3O2
?+3O2
请回答下列问题:
(1)过程I的能量转化形式为:_______ 能转化为_______ 能.
(2)请完成第⑤个反应的化学方程式______________
(3)上述转化过程中,△H1和△H2的关系是______________
(4)断裂1mol化学键所需的能量见表:
常温下,N2和H2O反应生成NH3的热化学方程式为________________

过程I可用如下反应表示:
①2CO2
 2CO+O2
2CO+O2②2H2O
 2H2+O2
2H2+O2③2N2+6H2O
 4NH3+3O2
4NH3+3O2④2CO2+4H2O
 2CH3OH+3O2
2CH3OH+3O2⑤2CO+H2O
 ?+3O2
?+3O2请回答下列问题:
(1)过程I的能量转化形式为:
(2)请完成第⑤个反应的化学方程式
(3)上述转化过程中,△H1和△H2的关系是
(4)断裂1mol化学键所需的能量见表:
| 共价键 | H﹣N | H﹣O | N≡N | O=O |
| 断裂1mol化学键所需能量/kJ•mol﹣1 | 393 | 460 | 941 | 499 |
常温下,N2和H2O反应生成NH3的热化学方程式为
您最近一年使用:0次
2016-12-09更新
|
918次组卷
|
5卷引用:山西省大同市第一中学2017-2018学年高二上学期期中考试化学试题
山西省大同市第一中学2017-2018学年高二上学期期中考试化学试题2015-2016学年安徽省阜阳市太和八中高二上学期期末理化学试卷湖南省衡阳市樟树中学2016-2017学年高一下学期第四次月考化学试题江西省赣州市蓉江新区潭口中学2019-2020学年高二下学期第一次月考化学试题(已下线)第一章 化学反应与能量(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)



