我国力争于2030年前做到碳达峰,2060年前实现碳中和。
(1)CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a)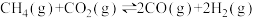

b)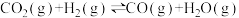

c)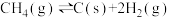

d)

e)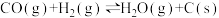

①根据盖斯定律,反应a的
___________ (写出一个代数式即可)。
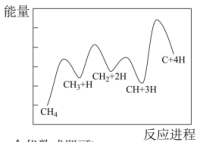
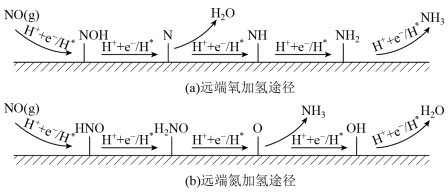
②一定条件下,CH4分解形成碳的反应历程如图所示。该历程分___________ 步进行,其中,第___________ 步的反应最慢。
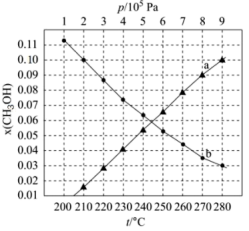
(2)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。反应可表示为: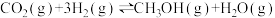 。在起始物
。在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 下的
下的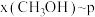 、在
、在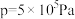 下的
下的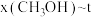 如图所示。
如图所示。
①用各物质的平衡分压[如 的分压可表示为
的分压可表示为 ]表示该反应平衡常数,表达式
]表示该反应平衡常数,表达式
___________ ;
②图中对应等温过程的曲线是___________ ,判断的理由是___________ ;
③当 时,
时, 的平衡转化率
的平衡转化率
___________ ,反应条件可能为___________ 或___________ 。
(1)CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a)
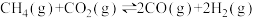

b)
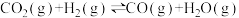

c)
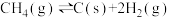

d)


e)
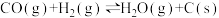

①根据盖斯定律,反应a的

②一定条件下,CH4分解形成碳的反应历程如图所示。该历程分

(2)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。反应可表示为:
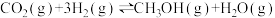 。在起始物
。在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为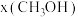 ,在
,在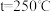 下的
下的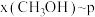 、在
、在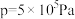 下的
下的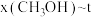 如图所示。
如图所示。
①用各物质的平衡分压[如
 的分压可表示为
的分压可表示为 ]表示该反应平衡常数,表达式
]表示该反应平衡常数,表达式
②图中对应等温过程的曲线是
③当
 时,
时, 的平衡转化率
的平衡转化率
更新时间:2021/11/17 00:09:51
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题:
(1)合成氨反应的能量变化如图所示,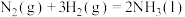 ΔH=
ΔH=________ 。
(2)室温下, (Si为-4价)是一种无色气体,遇到空气能发生爆炸性自燃,生成
(Si为-4价)是一种无色气体,遇到空气能发生爆炸性自燃,生成 固体和
固体和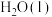 。已知室温下
。已知室温下 自燃时每转移0.05mol电子,放出a kJ的热量,该反应的热化学方程式为
自燃时每转移0.05mol电子,放出a kJ的热量,该反应的热化学方程式为________ 。
(3)如图是 和
和 反应生成1mol
反应生成1mol  过程中的能量变化示意图,表格中若已知下列数据:
过程中的能量变化示意图,表格中若已知下列数据:
计算N-H的键能为________  。
。________ (填“大于”“等于”“小于”)。
(1)合成氨反应的能量变化如图所示,
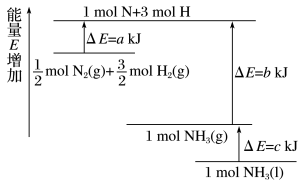
 ΔH=
ΔH=(2)室温下,
 (Si为-4价)是一种无色气体,遇到空气能发生爆炸性自燃,生成
(Si为-4价)是一种无色气体,遇到空气能发生爆炸性自燃,生成 固体和
固体和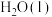 。已知室温下
。已知室温下 自燃时每转移0.05mol电子,放出a kJ的热量,该反应的热化学方程式为
自燃时每转移0.05mol电子,放出a kJ的热量,该反应的热化学方程式为(3)如图是
 和
和 反应生成1mol
反应生成1mol  过程中的能量变化示意图,表格中若已知下列数据:
过程中的能量变化示意图,表格中若已知下列数据:化学键 | H-H |
|
键能/ | 435 | 943 |
 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】(1)贮氢合金ThNi5可催化由CO、H2合成CH4的反应。温度为T时,该反应的热化学方程式为______
已知温度为T时:CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH=+165kJ·mol-1
CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41kJ·mol-1
(2)用O2将HCl转化为Cl2,可提高效益,减少污染。

传统上该转化通过如图所示的催化循环实现。其中,反应①为:2HCl(g)+CuO(s) H2O(g)+CuCl2(s) ΔH1,反应②生成1molCl2(g)的反应热为ΔH2,则总反应的热化学方程式为
H2O(g)+CuCl2(s) ΔH1,反应②生成1molCl2(g)的反应热为ΔH2,则总反应的热化学方程式为_________________ (反应热用ΔH1和ΔH2表示)。
(3)已知:①Fe2O3(s)+3C(s)===2Fe(s)+3CO(g) ΔH=+494kJ·mol-1
②CO(g)+1/2O2(g)===CO2(g) ΔH=-283kJ·mol-1
③C(s)+1/2O2(g)===CO(g) ΔH=-110kJ·mol-1
则反应Fe2O3(s)+3C(s)+3/2O2(g)===2Fe(s)+3CO2(g)的ΔH=________ kJ·mol-1。理论上反应________ 放出的热量足以供给反应________ 所需要的热量(填上述方程式序号)。
已知温度为T时:CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH=+165kJ·mol-1
CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41kJ·mol-1
(2)用O2将HCl转化为Cl2,可提高效益,减少污染。

传统上该转化通过如图所示的催化循环实现。其中,反应①为:2HCl(g)+CuO(s)
 H2O(g)+CuCl2(s) ΔH1,反应②生成1molCl2(g)的反应热为ΔH2,则总反应的热化学方程式为
H2O(g)+CuCl2(s) ΔH1,反应②生成1molCl2(g)的反应热为ΔH2,则总反应的热化学方程式为(3)已知:①Fe2O3(s)+3C(s)===2Fe(s)+3CO(g) ΔH=+494kJ·mol-1
②CO(g)+1/2O2(g)===CO2(g) ΔH=-283kJ·mol-1
③C(s)+1/2O2(g)===CO(g) ΔH=-110kJ·mol-1
则反应Fe2O3(s)+3C(s)+3/2O2(g)===2Fe(s)+3CO2(g)的ΔH=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】甲醇水蒸气重整制氢(SRM)系统简单,产物中H2 含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。反应如下:
反应Ⅰ(主) :CH3OH(g)+ H2O(g) CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
反应Ⅱ(副) :H2(g)+ CO2(g) CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol
温度高于300℃则会同时发生反应Ⅲ: CH3OH(g) CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)计算反应Ⅲ的ΔH3=_________ 。
(2)反应1能够自发进行的原因是_______________ ,升温有利于提高CH3OH转化率,但也存在一个明显的缺点是__________ 。
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是____________ (填标号)。
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是______ 。
③写出一条能提高CH3OH转化率而降低CO生成率的措施_________ 。
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率_________ ,反应Ⅱ的平衡常数_________ (结果保留两位有效数字)
反应Ⅰ(主) :CH3OH(g)+ H2O(g)
 CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol反应Ⅱ(副) :H2(g)+ CO2(g)
 CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol温度高于300℃则会同时发生反应Ⅲ: CH3OH(g)
 CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3(1)计算反应Ⅲ的ΔH3=
(2)反应1能够自发进行的原因是
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是
③写出一条能提高CH3OH转化率而降低CO生成率的措施
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】Burns和Dainton研究了反应Cl2(g)+CO(g) COCl2(g)的动力学,获得其速率方程v=k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
COCl2(g)的动力学,获得其速率方程v=k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
(1)该反应可认为经过以下反应历程:
第一步:Cl2 2Cl 快速平衡
2Cl 快速平衡
第二步:Cl+CO COCl 快速平衡
COCl 快速平衡
第三步:COCl+Cl2→COCl2+Cl 慢反应
下列表述正确的是______(填标号)。
(2)在某温度下进行实验,测得各组分初浓度和反应初速度如下:
CO的反应级数m=______ ,当实验4进行到某时刻,测得c(Cl2)=0.010mol·L-1,则此时的反应速率v=______ mol·L-1·s-1(已知: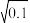 ≈0.32)。
≈0.32)。
 COCl2(g)的动力学,获得其速率方程v=k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
COCl2(g)的动力学,获得其速率方程v=k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。(1)该反应可认为经过以下反应历程:
第一步:Cl2
 2Cl 快速平衡
2Cl 快速平衡第二步:Cl+CO
 COCl 快速平衡
COCl 快速平衡第三步:COCl+Cl2→COCl2+Cl 慢反应
下列表述正确的是______(填标号)。
| A.COCl属于反应的中间产物 |
| B.第一步和第二步的活化能较高 |
| C.决定总反应快慢的是第三步 |
| D.第三步的有效碰撞频率较大 |
| 实验序号 | c(Cl2)/mol·L-1 | c(CO)/mol·L-1 | v/mol·L-1·s-1 |
| 1 | 0.100 | 0.100 | 1.2×10-2 |
| 2 | 0.050 | 0.100 | 4.26×10-3 |
| 3 | 0.100 | 0.200 | 2.4×10-2 |
| 4 | 0.050 | 0.050 | 2.13×10-3 |
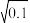 ≈0.32)。
≈0.32)。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】以 、
、 为原料生产尿素
为原料生产尿素 的反应历程与能量变化如图所示。
的反应历程与能量变化如图所示。 、CO2为原料生产尿素
、CO2为原料生产尿素 的
的 H=
H=_____________  。
。
(2)两步反应中,第_______ 步(填“一”或“二”)反应是快反应。
 、
、 为原料生产尿素
为原料生产尿素 的反应历程与能量变化如图所示。
的反应历程与能量变化如图所示。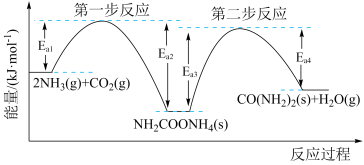
 、CO2为原料生产尿素
、CO2为原料生产尿素 的
的 H=
H= 。
。(2)两步反应中,第
您最近一年使用:0次
填空题
|
适中
(0.65)
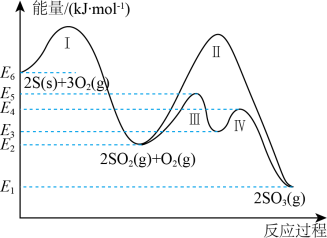
【推荐3】煤和石油燃烧生成的二氧化硫及氮氧化物是大气主要污染物之一,请按要求回答下列问题。硫与硫的氧化物在转化过程中的能量变化如下图所示。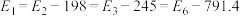 。
。
(1)图中的反应I、Ⅱ、Ⅲ、IV中属于吸热反应的是_______ 。
(2)表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ 。
(3)从图中可看出将 氧化成
氧化成 有两条途径:a.
有两条途径:a. 经过途径Ⅲ、途径Ⅳ转化成
经过途径Ⅲ、途径Ⅳ转化成 ;b.
;b. 经过途径Ⅱ转化成
经过途径Ⅱ转化成 。这两种途径相比,a改变的条件是
。这两种途径相比,a改变的条件是_______ ,该条件能改变反应速率的原因是_______ 。
(4)用 溶液作吸收液处理大气污染物氮氧化物时,氮氧化物被吸收生成
溶液作吸收液处理大气污染物氮氧化物时,氮氧化物被吸收生成 。用石墨电极电解处理后溶液中的
。用石墨电极电解处理后溶液中的 ,使其转化为无毒物质,同时使吸收液再生。
,使其转化为无毒物质,同时使吸收液再生。
①写出电解时阳极的电极反应式_______ 。
②若电解后阴极生成 还原产物,阳极生成气体在标准状况下的体积是
还原产物,阳极生成气体在标准状况下的体积是_______ 。
 。
。(1)图中的反应I、Ⅱ、Ⅲ、IV中属于吸热反应的是
(2)表示
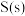 燃烧热的热化学方程式为
燃烧热的热化学方程式为(3)从图中可看出将
 氧化成
氧化成 有两条途径:a.
有两条途径:a. 经过途径Ⅲ、途径Ⅳ转化成
经过途径Ⅲ、途径Ⅳ转化成 ;b.
;b. 经过途径Ⅱ转化成
经过途径Ⅱ转化成 。这两种途径相比,a改变的条件是
。这两种途径相比,a改变的条件是(4)用
 溶液作吸收液处理大气污染物氮氧化物时,氮氧化物被吸收生成
溶液作吸收液处理大气污染物氮氧化物时,氮氧化物被吸收生成 。用石墨电极电解处理后溶液中的
。用石墨电极电解处理后溶液中的 ,使其转化为无毒物质,同时使吸收液再生。
,使其转化为无毒物质,同时使吸收液再生。①写出电解时阳极的电极反应式
②若电解后阴极生成
 还原产物,阳极生成气体在标准状况下的体积是
还原产物,阳极生成气体在标准状况下的体积是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】甲醇是一种理想的储氢载体,我国科学家研发的全球首套太阳能燃料合成项目被称为“液态阳光”计划,可利用太阳能电解水产生H,再将CO2与H2转化为甲醇,以实现碳中和。在2L恒容密闭容器中充入2molCO2和nmolH2,在一定条件下发生反应: 。CO2的转化率与温度、投料比
。CO2的转化率与温度、投料比 的关系如下图所示。
的关系如下图所示。
_______ mol·L-1·s-1。
(2)根据图象判断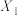
_______ 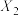 (填“>”、“<”或“=”,下同),该反应的焓变△H
(填“>”、“<”或“=”,下同),该反应的焓变△H_______ 0,平衡常数
_______  。
。
(3)若在500K时,按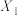 投料,在恒压下进行,达到平衡状态,此时CO2的转化率
投料,在恒压下进行,达到平衡状态,此时CO2的转化率_______ (填“>”、“<”或“=”)75%。
(4)该反应的平衡常数表达式为_______ 。
(5)若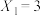 ,保持CO2投料为2mol不变,则B点的
,保持CO2投料为2mol不变,则B点的
_______ (填数值)。
 。CO2的转化率与温度、投料比
。CO2的转化率与温度、投料比 的关系如下图所示。
的关系如下图所示。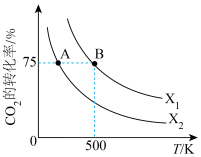

(2)根据图象判断
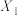
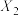 (填“>”、“<”或“=”,下同),该反应的焓变△H
(填“>”、“<”或“=”,下同),该反应的焓变△H
 。
。(3)若在500K时,按
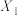 投料,在恒压下进行,达到平衡状态,此时CO2的转化率
投料,在恒压下进行,达到平衡状态,此时CO2的转化率(4)该反应的平衡常数表达式为
(5)若
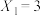 ,保持CO2投料为2mol不变,则B点的
,保持CO2投料为2mol不变,则B点的
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】脱硝技术是处理氮氧化物的有效方法之一。在1 L的恒容密闭容器中充入2 mol NH3、1 mol NO和1 mol NO2,发生反应:2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) ΔH。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:
2N2(g)+3H2O(g) ΔH。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:
回答下列问题:
(1)T1____ (填“>”“<”或“=”)T2,理由是_______ 。
(2)平衡后,增大压强反应向____ (填“正”或“逆”,下同)反应方向移动,升高温度反应向____ 反应方向移动。
(3)T1 K下,0~20 min内v(NO)=____________ 。
(4)T2 K下,NO2的平衡转化率为____ 。
 2N2(g)+3H2O(g) ΔH。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:
2N2(g)+3H2O(g) ΔH。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:| 0 min | 10 min | 20 min | 30 min | 40 min | |
| T1 K | 0 | 0.6 | 1.1 | 1.5 | 1.5 |
| T2 K | 0 | 0.8 | 1.4 | 1.4 | 1.4 |
回答下列问题:
(1)T1
(2)平衡后,增大压强反应向
(3)T1 K下,0~20 min内v(NO)=
(4)T2 K下,NO2的平衡转化率为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】下图中,P为可自由滑动的活塞,关闭K,V(A)=aL,V(B)=0.8aL(连通管的体积忽略不计)。在相同温度和有催化剂存在的条件下,分别向容器A、B中各充入1molN2和3molH2,发生反应N2(g)+3H2(g) 2NH3(g);ΔH=-92.4kJ/mol。达到平衡后,V(B)=0.6aL。
2NH3(g);ΔH=-92.4kJ/mol。达到平衡后,V(B)=0.6aL。
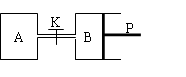
⑴B中N2的转化率是_______ 。A中N2的转化率______ (填“大于”、“等于”或“小于”)B中N2的转化率。理由是_______________________ 。
⑵打开K,一段时间后反应再次达到平衡,则B的体积为_______ 。请说明理由?
⑶A反应达到平衡时,放出akJ的热量,若向A中充入2molNH3,在相同条件下达到平衡时吸收热量为bkJ,则a和b的关系是______________ 。
⑷B中反应达到平衡后,只改变下列条件,c(NH3)不改变的是_____ (填序号)。
A. 升高温度 B. 向容器充入1molAr(g)
C. 向容器中充入2molNH3 D. 选用效果更好的催化剂
 2NH3(g);ΔH=-92.4kJ/mol。达到平衡后,V(B)=0.6aL。
2NH3(g);ΔH=-92.4kJ/mol。达到平衡后,V(B)=0.6aL。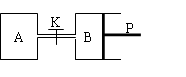
⑴B中N2的转化率是
⑵打开K,一段时间后反应再次达到平衡,则B的体积为
⑶A反应达到平衡时,放出akJ的热量,若向A中充入2molNH3,在相同条件下达到平衡时吸收热量为bkJ,则a和b的关系是
⑷B中反应达到平衡后,只改变下列条件,c(NH3)不改变的是
A. 升高温度 B. 向容器充入1molAr(g)
C. 向容器中充入2molNH3 D. 选用效果更好的催化剂
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】150℃时,向下图所示的恒压容器中加入4LN2和 H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),正反应放热。反应后恢复到原温度。平衡后容器体轵变为3.4L,容器内气体对相同条件的氢气的相对密度为5。

(1)反应前混合气体中V(N2):V(H2)=______ ;反应达平衡后V(NH3)=__ L;该反应中N2转化率为___ 。
(2)向平衡后的容器中充入0.2mol的NH3,一段时间后反应再次达到平衡,恢复到150℃时测得此过程中从外界吸收了6.44 kJ的热量。请回答:充入NH3时,混合气体的密度将__________ (填“增大”、“减小”或“不变”),在达到平衡的过程中,混合气体的密度将____ (填“增大”、“减小”或“不变”)。反应重新达平衡昀混合气体对氢气的相对密度将______ 5(填“>”、“<”或 “ = ”)

(1)反应前混合气体中V(N2):V(H2)=
(2)向平衡后的容器中充入0.2mol的NH3,一段时间后反应再次达到平衡,恢复到150℃时测得此过程中从外界吸收了6.44 kJ的热量。请回答:充入NH3时,混合气体的密度将
您最近一年使用:0次
【推荐2】氯及其化合物在生活和生产中应用广泛。已知下列反应: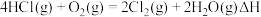
900 K时,将 和
和 按4:1充入恒容的密闭容器中。
按4:1充入恒容的密闭容器中。
(1)若该反应可自发进行,则
_______ (填“>”或“<”)。
(2)下列不可以 作为该反应达到平衡的判据是_______。
(3)已知:某气体的分压=气体总压强×该气体的体积分数(或物质的量分数),且在化学平衡体系中,各气体物质的分压替代浓度,计算的平衡常数即为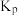 。若上述反应达到平衡时,混合气体平衡总压强为p,
。若上述反应达到平衡时,混合气体平衡总压强为p, 气体的平衡转化率为50%,则该反应的压强平衡常数
气体的平衡转化率为50%,则该反应的压强平衡常数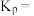
_______ 。
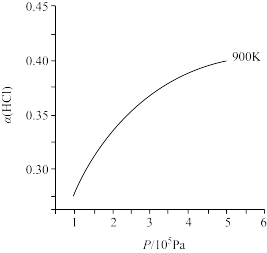
(4) 的平衡转化率
的平衡转化率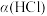 随压强(P)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在
随压强(P)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在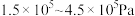 范围内,
范围内, 的平衡转化率
的平衡转化率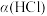 随压强(P)变化曲线示意图。
随压强(P)变化曲线示意图。_______
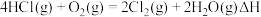
900 K时,将
 和
和 按4:1充入恒容的密闭容器中。
按4:1充入恒容的密闭容器中。(1)若该反应可自发进行,则

(2)下列
| A.气体的压强不变 | B. |
| C.K不变 | D.容器内气体的密度不变 |
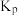 。若上述反应达到平衡时,混合气体平衡总压强为p,
。若上述反应达到平衡时,混合气体平衡总压强为p, 气体的平衡转化率为50%,则该反应的压强平衡常数
气体的平衡转化率为50%,则该反应的压强平衡常数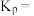
(4)
 的平衡转化率
的平衡转化率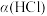 随压强(P)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在
随压强(P)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在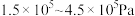 范围内,
范围内, 的平衡转化率
的平衡转化率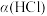 随压强(P)变化曲线示意图。
随压强(P)变化曲线示意图。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运。某兴趣小组对反应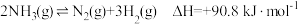 进行了实验探究。在一定温度和催化剂的条件下,将
进行了实验探究。在一定温度和催化剂的条件下,将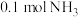 通入
通入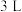 的密闭容器中进行反应(此时容器内总压为
的密闭容器中进行反应(此时容器内总压为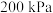 ),各物质的分压随时间的变化曲线如图所示。
),各物质的分压随时间的变化曲线如图所示。
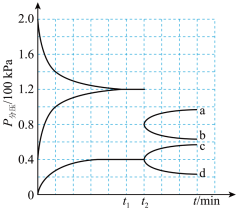
(1)t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是
分压变化趋势的曲线是_______ (用图中a、b、c、d表示),理由是______________ 。
(2)在该温度下,反应的标准平衡常数
_______ 。(已知:分压=总压×该组分物质的量分数,对于反应 ,
, ,其中
,其中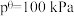 ,
,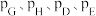 为各组分的平衡分压)
为各组分的平衡分压)
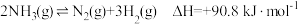 进行了实验探究。在一定温度和催化剂的条件下,将
进行了实验探究。在一定温度和催化剂的条件下,将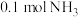 通入
通入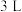 的密闭容器中进行反应(此时容器内总压为
的密闭容器中进行反应(此时容器内总压为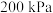 ),各物质的分压随时间的变化曲线如图所示。
),各物质的分压随时间的变化曲线如图所示。
(1)t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
 分压变化趋势的曲线是
分压变化趋势的曲线是(2)在该温度下,反应的标准平衡常数

 ,
, ,其中
,其中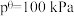 ,
,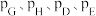 为各组分的平衡分压)
为各组分的平衡分压)
您最近一年使用:0次




