1 . Ⅰ.在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
(1)一定温度下,将2 mol N2和6 mol H2置于1 L的恒容密闭容器中发生如下反应: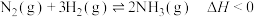 ,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:
,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:
①上表中T1_______ T2(用含“>”“<”“=”的关系式表示),其中a、b、80%三者的大小关系是_______ (用含“>”“<”“=”的关系式表示)。
②研究表明,合成氨的速率与相关物质的浓度关系为 ,k为速率常数。以下说法正确的是
,k为速率常数。以下说法正确的是_______ (填字母序号)。
A.升高温度,k值增大
B.T2℃时若容器内混合气体平均相对分子质量为12且保持不变,则反应达到平衡状态
C.一定温度下将原容器中的NH3及时分离出来可使v减小
D.合成氨达到平衡后,增大c(N2)可使正反应速率在达到新平衡的过程中始终增大
③已知某温度下该反应达平衡时各物质均为1 mol,容器容积为1 L,保持温度和压强不变,又充入3 mol N2后,平衡_______ (填“向左移动”“向右移动”或“不移动”)。
Ⅱ.甲醚(CH3OCH)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为 。该过程可分为以下两步反应完成:
。该过程可分为以下两步反应完成:
甲醇合成反应:_______。
甲醇脱水反应: 。
。
(2)起始时向容器中投入2 mol CO和4 mol H2,测得某时刻上述总反应中放出的热量为51.5 kJ,此时CO的转化率为_______ 。
(3)请写出甲醇合成反应的热化学方程式:_______ 。
(4)在一定条件下,将CO和H2按体积比1:2充入恒容密闭容器中,反应生成CH3OCH3(g)和H2O(g)。下列能说明该反应达到平衡状态的是_______ (填字母)。
a.混合气体的总物质的量保持不变
b.混合气体的密度保持不变
c.CH3OCH3(g)和H2O(g)的物质的量之比保持不变
d.每生成1 mol CH3OCH3(g),同时生成2 mol CO
(1)一定温度下,将2 mol N2和6 mol H2置于1 L的恒容密闭容器中发生如下反应:
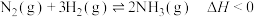 ,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:
,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:| 1小时 | 2小时 | 3小时 | 4小时 | |
| T1 | 30% | 50% | 80% | 80% |
| T2 | 35% | 60% | a | b |
①上表中T1
②研究表明,合成氨的速率与相关物质的浓度关系为
 ,k为速率常数。以下说法正确的是
,k为速率常数。以下说法正确的是A.升高温度,k值增大
B.T2℃时若容器内混合气体平均相对分子质量为12且保持不变,则反应达到平衡状态
C.一定温度下将原容器中的NH3及时分离出来可使v减小
D.合成氨达到平衡后,增大c(N2)可使正反应速率在达到新平衡的过程中始终增大
③已知某温度下该反应达平衡时各物质均为1 mol,容器容积为1 L,保持温度和压强不变,又充入3 mol N2后,平衡
Ⅱ.甲醚(CH3OCH)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为
 。该过程可分为以下两步反应完成:
。该过程可分为以下两步反应完成:甲醇合成反应:_______。
甲醇脱水反应:
 。
。(2)起始时向容器中投入2 mol CO和4 mol H2,测得某时刻上述总反应中放出的热量为51.5 kJ,此时CO的转化率为
(3)请写出甲醇合成反应的热化学方程式:
(4)在一定条件下,将CO和H2按体积比1:2充入恒容密闭容器中,反应生成CH3OCH3(g)和H2O(g)。下列能说明该反应达到平衡状态的是
a.混合气体的总物质的量保持不变
b.混合气体的密度保持不变
c.CH3OCH3(g)和H2O(g)的物质的量之比保持不变
d.每生成1 mol CH3OCH3(g),同时生成2 mol CO
您最近一年使用:0次
2 . 在“碳达峰、碳中和”的目标引领下,减少 排放实现
排放实现 的有效转化成为科研工作者的研究热点。根据以下几种常见的
的有效转化成为科研工作者的研究热点。根据以下几种常见的 利用方法,回答下列问题。
利用方法,回答下列问题。
I.以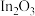 作催化剂,采用“
作催化剂,采用“ 催化加氢制甲醇”方法将其资源化利用。反应历程如下:
催化加氢制甲醇”方法将其资源化利用。反应历程如下:
i.催化剂活化: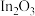 (无活性)
(无活性)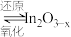 (有活性);
(有活性);
ii. 与
与 在活化的催化剂表面同时发生如下反应:
在活化的催化剂表面同时发生如下反应:
①主反应:
 ,
,
②副反应:
 。
。
(1)某温度下,在恒容反应器中,能说明反应①达到平衡状态的是_______(填序号)。
(2)a. 选择性随气体流速增大而升高的原因可能是
选择性随气体流速增大而升高的原因可能是_______ 。(已知: 选择性
选择性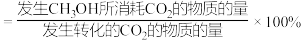 )
)
b.某温度下, 与
与 的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中
的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中 的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:
的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:_______ 。
(3)反应①、②的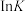 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。

升高温度,反应 的化学平衡常数
的化学平衡常数_______ (填“增大”或“减小”或“不变”)。
(4)恒温恒压密闭容器中,加入2mol 和4mol
和4mol ,只发生反应①和反应②,初始压强为
,只发生反应①和反应②,初始压强为 。
。
a.在230℃以上,升高温度 的平衡转化率增大,但甲醇的产率降低,原因是
的平衡转化率增大,但甲醇的产率降低,原因是_______ 。
b.在300℃发生反应,反应达平衡时, 的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=
的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=_______ (保留两位有效数字)。
II.利用干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
i.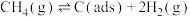
ii.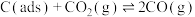
上述反应中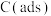 为吸附活性炭,反应历程的能量变化如图1所示:
为吸附活性炭,反应历程的能量变化如图1所示:

(5) 干重整反应的速率由决定
干重整反应的速率由决定_______ (填“反应i”或“反应ⅱ”), 干重整反应的热化方程式为
干重整反应的热化方程式为_______ 。(选取图1中 、
、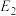 、
、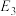 表示反应热)。
表示反应热)。
 排放实现
排放实现 的有效转化成为科研工作者的研究热点。根据以下几种常见的
的有效转化成为科研工作者的研究热点。根据以下几种常见的 利用方法,回答下列问题。
利用方法,回答下列问题。I.以
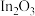 作催化剂,采用“
作催化剂,采用“ 催化加氢制甲醇”方法将其资源化利用。反应历程如下:
催化加氢制甲醇”方法将其资源化利用。反应历程如下:i.催化剂活化:
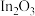 (无活性)
(无活性)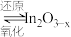 (有活性);
(有活性);ii.
 与
与 在活化的催化剂表面同时发生如下反应:
在活化的催化剂表面同时发生如下反应:①主反应:

 ,
,②副反应:

 。
。(1)某温度下,在恒容反应器中,能说明反应①达到平衡状态的是_______(填序号)。
A.分别用 和 和 表示的速率之比为3:1 表示的速率之比为3:1 |
| B.混合气体的平均摩尔质量不变 |
| C.混合气体的密度不变 |
D. 和 和 的分压之比不变 的分压之比不变 |
 选择性随气体流速增大而升高的原因可能是
选择性随气体流速增大而升高的原因可能是 选择性
选择性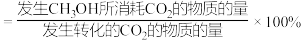 )
)b.某温度下,
 与
与 的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中
的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中 的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:
的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:(3)反应①、②的
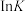 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
升高温度,反应
 的化学平衡常数
的化学平衡常数(4)恒温恒压密闭容器中,加入2mol
 和4mol
和4mol ,只发生反应①和反应②,初始压强为
,只发生反应①和反应②,初始压强为 。
。a.在230℃以上,升高温度
 的平衡转化率增大,但甲醇的产率降低,原因是
的平衡转化率增大,但甲醇的产率降低,原因是b.在300℃发生反应,反应达平衡时,
 的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=
的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=II.利用干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
i.
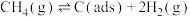
ii.
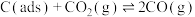
上述反应中
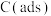 为吸附活性炭,反应历程的能量变化如图1所示:
为吸附活性炭,反应历程的能量变化如图1所示:
(5)
 干重整反应的速率由决定
干重整反应的速率由决定 干重整反应的热化方程式为
干重整反应的热化方程式为 、
、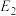 、
、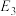 表示反应热)。
表示反应热)。
您最近一年使用:0次
3 . 工业废气的排放对环境造成了极大的影响,研究其吸收或再利用对缓解环境污染有重要意义。请根据所学知识回答下列问题。
(1)工业废气中的H2S可用Fe2(SO4)3溶液吸收,反应后的溶液可在硫杆菌的作用下实现吸收液的再生。用Fe2(SO4)3吸收液脱除H2S经历以下三步:
I: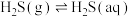 ΔH<0
ΔH<0
II: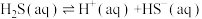
III: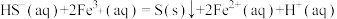
①步骤I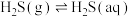 在
在_______ (填“高温下”“低温下”或“任何条件下”)有利于自发进行。
②第II步的电离平衡常数的表达式为_______ 。
③反应后的溶液在硫杆菌的作用下进行的再生反应为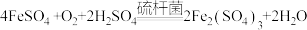 。该反应中每消耗标准状况下11.2LO2,可以再生出
。该反应中每消耗标准状况下11.2LO2,可以再生出_______ mol Fe2(SO4)3.该再生反应_______ (填“能”或“不能”)在高温下进行,理由是_______ 。
(2)CO2的大量排放会加剧温室效应,实现CO2的资源化利用不但能有效减少CO2排放,还可以变废为宝。CO2催化加氢合成二甲醚是一种CO2转化方法,转化过程中主要发生下列反应:
反应I: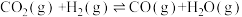 ΔH1=+41.2kJ·mol-1
ΔH1=+41.2kJ·mol-1
反应II: ΔH2=-122.5kJ·mol-1
ΔH2=-122.5kJ·mol-1
① ΔH3=
ΔH3=_______ kJ·mol-1
②在一压强为170kPa的恒压密闭容器中充入1molCO2和1mol H2发生反应I、II,CO2平衡转化率和平衡时CH3OCH3的选择性(CH3OCH3的选择性=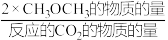 ×100%)随温度的变化如图。
×100%)随温度的变化如图。
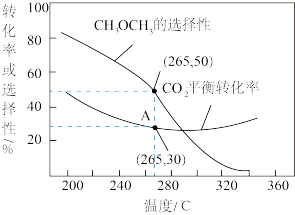
计算A点时H2(g)的转化率为_______ %,此温度下反应I的分压(分压=物质的量分数×总压)平衡常数Kp=_______ (保留一位有效数字)。
(1)工业废气中的H2S可用Fe2(SO4)3溶液吸收,反应后的溶液可在硫杆菌的作用下实现吸收液的再生。用Fe2(SO4)3吸收液脱除H2S经历以下三步:
I:
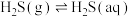 ΔH<0
ΔH<0II:
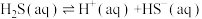
III:
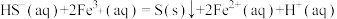
①步骤I
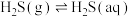 在
在②第II步的电离平衡常数的表达式为
③反应后的溶液在硫杆菌的作用下进行的再生反应为
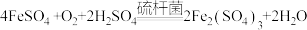 。该反应中每消耗标准状况下11.2LO2,可以再生出
。该反应中每消耗标准状况下11.2LO2,可以再生出(2)CO2的大量排放会加剧温室效应,实现CO2的资源化利用不但能有效减少CO2排放,还可以变废为宝。CO2催化加氢合成二甲醚是一种CO2转化方法,转化过程中主要发生下列反应:
反应I:
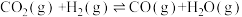 ΔH1=+41.2kJ·mol-1
ΔH1=+41.2kJ·mol-1反应II:
 ΔH2=-122.5kJ·mol-1
ΔH2=-122.5kJ·mol-1①
 ΔH3=
ΔH3=②在一压强为170kPa的恒压密闭容器中充入1molCO2和1mol H2发生反应I、II,CO2平衡转化率和平衡时CH3OCH3的选择性(CH3OCH3的选择性=
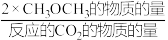 ×100%)随温度的变化如图。
×100%)随温度的变化如图。
计算A点时H2(g)的转化率为
您最近一年使用:0次
2022-11-14更新
|
165次组卷
|
3卷引用:山西省部分名校2022-2023学年高二上学期期中联合考试化学试题
4 . 合成氨的工艺流程一般分三步:第一步为原料气的制备,将天然气等原料制成含氢和氮的粗原料气;第二步为净化,主要包括变换过程、脱硫脱碳过程以及气体精制过程;第三步为氨合成,将纯净的氢氮混合气压缩,增大压强,在催化剂的作用下合成氨。
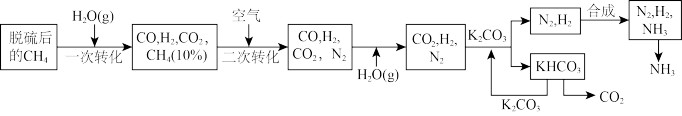
已知几种物质的燃烧热如表所示:
回答下列问题:
(1)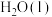 的汽化热(
的汽化热( )为+44 kJ·mol
)为+44 kJ·mol ,则“一次转化”过程中生成CO的热化学方程式为
,则“一次转化”过程中生成CO的热化学方程式为_________ 。
(2)“二次转化”时进口处混合气的温度在1200℃左右,随后混合气开始急剧升温,而在出口处混合气的温度降到1000℃左右,试解释其原因:_________ 。
(3)整个流程图中有两处循环,一处是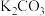 循环,还有一处循环,请在流程图上标出循环方向和循环物质
循环,还有一处循环,请在流程图上标出循环方向和循环物质_________ 。
(4)合成氨反应过程中的能量变化如图所示,图中A、C分别表示_________ 、_________ ,E的大小对该反应的反应热_________ (填“有”或“无”)影响。该反应常用铁作催化剂,其反应机理可能为 在催化剂表面反应生成
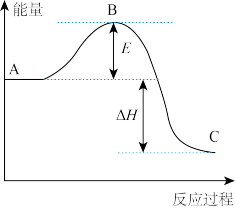
在催化剂表面反应生成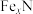 ,接着催化剂吸附的氢气不断与
,接着催化剂吸附的氢气不断与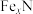 作用,最后生成
作用,最后生成 ,该催化循环机理的化学方程式可表示为
,该催化循环机理的化学方程式可表示为_________ 。
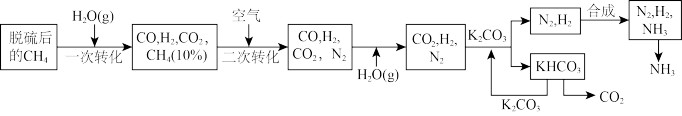
已知几种物质的燃烧热如表所示:
| 物质 |  |  |  |  |
燃烧热 | -285.5 | -890.3 | -283 | -393.5 |
(1)
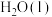 的汽化热(
的汽化热( )为+44 kJ·mol
)为+44 kJ·mol ,则“一次转化”过程中生成CO的热化学方程式为
,则“一次转化”过程中生成CO的热化学方程式为(2)“二次转化”时进口处混合气的温度在1200℃左右,随后混合气开始急剧升温,而在出口处混合气的温度降到1000℃左右,试解释其原因:
(3)整个流程图中有两处循环,一处是
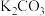 循环,还有一处循环,请在流程图上标出循环方向和循环物质
循环,还有一处循环,请在流程图上标出循环方向和循环物质(4)合成氨反应过程中的能量变化如图所示,图中A、C分别表示
 在催化剂表面反应生成
在催化剂表面反应生成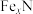 ,接着催化剂吸附的氢气不断与
,接着催化剂吸附的氢气不断与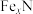 作用,最后生成
作用,最后生成 ,该催化循环机理的化学方程式可表示为
,该催化循环机理的化学方程式可表示为
您最近一年使用:0次
2022-11-11更新
|
141次组卷
|
3卷引用:山西省部分名校2022-2023学年高二上学期期中联合考试化学试题
5 . 甲烷及其衍生物在国民经济中有着重要的作用。回答下列问题:
(1)研究表明 与
与 在催化剂存在下可发生反应制得合成气:
在催化剂存在下可发生反应制得合成气: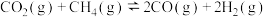

已知:①
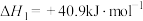
②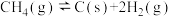
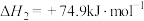
③
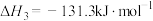
则上述制取合成气反应的
_______  ,利于反应自发进行的条件是
,利于反应自发进行的条件是_______ (填“高温”或“低温”)。
(2)在T℃,向VL体积恒定的密闭容器中,充入10mol 和15mol
和15mol 发生反应
发生反应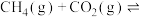
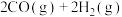 。
。
①为了加快该反应的速率,下列措施可行的是_______ (填字母)。
A.按原比例充入 、
、 B.缩小容器体积
B.缩小容器体积
C.增大反应物与催化剂的接触面积 D.移出产物CO、
②起始时容器内的总压强为25kPa,测得t min后反应达到平衡, 的平衡转化率为60%。则从起始到平衡反应的平均速率
的平衡转化率为60%。则从起始到平衡反应的平均速率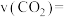
_______  ,在该温度下反应的平衡常数
,在该温度下反应的平衡常数
_______ ( 为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
(3)下列能说明反应达到平衡状态的是_______(填字母)。
(4)甲醇是重要的化工原料。利用CO与 合成甲醇,其反应的化学方程式为
合成甲醇,其反应的化学方程式为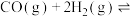
 。在一容积可变的密闭容器中按一定的投料比充入CO与
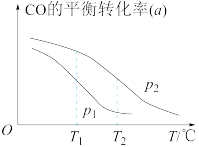
。在一容积可变的密闭容器中按一定的投料比充入CO与 ,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。
,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。
①该反应平衡常数大小: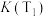
_______ 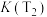 (填“>”或“<”)。
(填“>”或“<”)。
②图中压强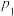
_______  (填“>”或“<”)。
(填“>”或“<”)。
(1)研究表明
 与
与 在催化剂存在下可发生反应制得合成气:
在催化剂存在下可发生反应制得合成气: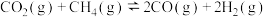

已知:①

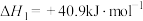
②
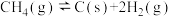
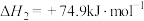
③

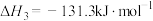
则上述制取合成气反应的

 ,利于反应自发进行的条件是
,利于反应自发进行的条件是(2)在T℃,向VL体积恒定的密闭容器中,充入10mol
 和15mol
和15mol 发生反应
发生反应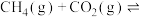
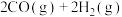 。
。①为了加快该反应的速率,下列措施可行的是
A.按原比例充入
 、
、 B.缩小容器体积
B.缩小容器体积C.增大反应物与催化剂的接触面积 D.移出产物CO、

②起始时容器内的总压强为25kPa,测得t min后反应达到平衡,
 的平衡转化率为60%。则从起始到平衡反应的平均速率
的平衡转化率为60%。则从起始到平衡反应的平均速率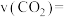
 ,在该温度下反应的平衡常数
,在该温度下反应的平衡常数
 为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
为以分压表示的平衡常数,气体分压=气体总压×体积分数)。(3)下列能说明反应达到平衡状态的是_______(填字母)。
| A.混合气体的密度保持不变 |
B. 的物质的量保持不变 的物质的量保持不变 |
| C.容器内混合气体原子总数不变 |
D.每生成1molCO的同时消耗1mol |
 合成甲醇,其反应的化学方程式为
合成甲醇,其反应的化学方程式为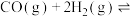
 。在一容积可变的密闭容器中按一定的投料比充入CO与
。在一容积可变的密闭容器中按一定的投料比充入CO与 ,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。
,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。
①该反应平衡常数大小:
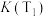
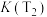 (填“>”或“<”)。
(填“>”或“<”)。②图中压强
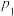
 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
名校
6 . TiN具有良好的导电和导热性,可用于高温结构材料和超导材料。可利用化学气相沉积技术来制备氮化钛。请回答下列问题:
(1)已知1200℃下,三种制备氮化钛反应的热化学方程式:
(ⅰ)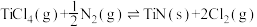
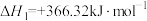
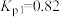
(ⅱ)
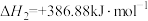
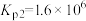
(ⅲ)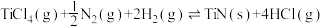
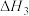
①已知反应(ⅳ)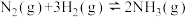
 ,则
,则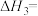
_______  。
。
②利用反应ⅰ和ⅱ两种方式制备TiN时。反应ⅱ的反应趋势远大于ⅰ,其原因是_______ 。
(2)在1200℃、130kPa反应条件下,将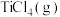 、
、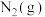 、
、 以物质的量之比1∶1∶2加入反应容器进行反应ⅲ。20min后反应达到平衡状态,平衡时混合气中
以物质的量之比1∶1∶2加入反应容器进行反应ⅲ。20min后反应达到平衡状态,平衡时混合气中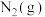 与
与 的分压相等,则
的分压相等,则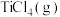 平衡转化率为
平衡转化率为_______ (保留三位有效数字),0~20min之间,以分压表示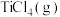 的平均反应速率为
的平均反应速率为_______ 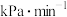 。
。
(3)制备氮化钛的原料氨气的合成。将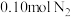 和
和 投入到某刚性反应容器中,测得反应过程中
投入到某刚性反应容器中,测得反应过程中 的体积分数和反应体系的总压p随着温度的升高而变化的曲线如图:
的体积分数和反应体系的总压p随着温度的升高而变化的曲线如图:
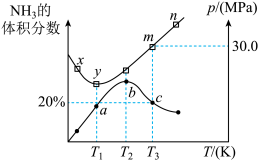
①对于该可逆反应过程,下列有关说法正确的是_______ (填序号)。
A.a、b、c三点时,该反应均处于平衡状态
B.m→n过程中,该反应平衡逆向移动
C.混合气体的平均摩尔质量M(b)>M(c)>M(a)
D.混合气体的密度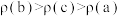
②x、y、m三点对应温度下的平衡常数由大到小的顺序为_______ 。
③当温度为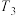 ,该反应达到平衡时,以气体分压表示的该反应的平衡常数
,该反应达到平衡时,以气体分压表示的该反应的平衡常数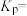
_______ 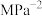 (列出计算式即可)。
(列出计算式即可)。
(1)已知1200℃下,三种制备氮化钛反应的热化学方程式:
(ⅰ)
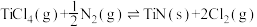
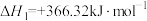
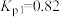
(ⅱ)

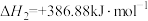
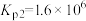
(ⅲ)
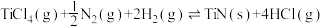
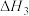
①已知反应(ⅳ)
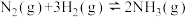
 ,则
,则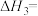
 。
。②利用反应ⅰ和ⅱ两种方式制备TiN时。反应ⅱ的反应趋势远大于ⅰ,其原因是
(2)在1200℃、130kPa反应条件下,将
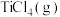 、
、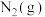 、
、 以物质的量之比1∶1∶2加入反应容器进行反应ⅲ。20min后反应达到平衡状态,平衡时混合气中
以物质的量之比1∶1∶2加入反应容器进行反应ⅲ。20min后反应达到平衡状态,平衡时混合气中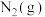 与
与 的分压相等,则
的分压相等,则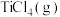 平衡转化率为
平衡转化率为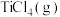 的平均反应速率为
的平均反应速率为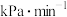 。
。(3)制备氮化钛的原料氨气的合成。将
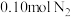 和
和 投入到某刚性反应容器中,测得反应过程中
投入到某刚性反应容器中,测得反应过程中 的体积分数和反应体系的总压p随着温度的升高而变化的曲线如图:
的体积分数和反应体系的总压p随着温度的升高而变化的曲线如图:
①对于该可逆反应过程,下列有关说法正确的是
A.a、b、c三点时,该反应均处于平衡状态
B.m→n过程中,该反应平衡逆向移动
C.混合气体的平均摩尔质量M(b)>M(c)>M(a)
D.混合气体的密度
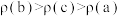
②x、y、m三点对应温度下的平衡常数由大到小的顺序为
③当温度为
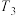 ,该反应达到平衡时,以气体分压表示的该反应的平衡常数
,该反应达到平衡时,以气体分压表示的该反应的平衡常数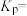
 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2022-09-03更新
|
477次组卷
|
3卷引用:山西省阳泉市第一中学校2022-2023学年高三上学期11月期中考试化学试题
7 . “一碳化学”的研究对象为含有一个碳原子的物质,如CO、CO2、CH4等,“一碳化学”在消除二氧化碳排放、有效降低全球变暖风险中具有十分广泛的应用。请完成下列各题:。
(1)CH4与CO2反应可获得应用广泛的合成气(CO和H2):CH4+CO2=2CO+2H2。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-820kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ΔH3=-566kJ·mol-1
则反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=_______ kJ·mol-1。其正反应的活化能为EakJ·mol-1,则逆反应的活化能为_______ kJ·mol-1。该反应自发进行的条件是_______ (填“高温”“低温”或“任意条件”)。
(2)一定条件下,将CO2与H2的混合气体通过催化剂可实现将CO2转变为二甲醚(CH3OCH3)(g),同时有H2O(g)生成。在某压强下,在不同温度、不同投料比时,CO2与H2反应生成二甲醚的反应中,CO2的平衡转化率如图甲所示:
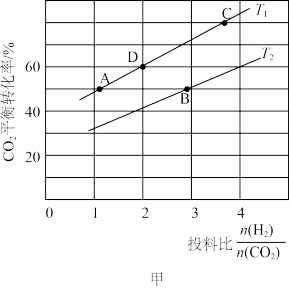
①写出该反应的化学方程式:_______ 。
②T1温度下,在2L密闭容器中充入18mol原料气,5min后反应达到D点,则0~5min内的平均反应速率v(CH3OCH3)=_______ 。
③若T1<T2,则反应的ΔH_______ (填“<”“>”或“=”)0;T1温度下D点所对应反应的平衡常数为_______ (保留两位小数);KA、KB、KC三者之间的大小关系为_______ 。
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图乙所示:
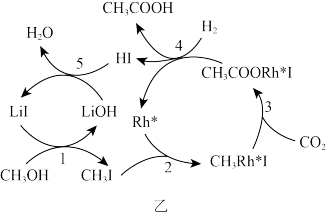
①根据图示,写出总反应的化学方程式:_______ 。
②原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式:_______ 。
(1)CH4与CO2反应可获得应用广泛的合成气(CO和H2):CH4+CO2=2CO+2H2。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-820kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ΔH3=-566kJ·mol-1
则反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=
(2)一定条件下,将CO2与H2的混合气体通过催化剂可实现将CO2转变为二甲醚(CH3OCH3)(g),同时有H2O(g)生成。在某压强下,在不同温度、不同投料比时,CO2与H2反应生成二甲醚的反应中,CO2的平衡转化率如图甲所示:

①写出该反应的化学方程式:
②T1温度下,在2L密闭容器中充入18mol原料气,5min后反应达到D点,则0~5min内的平均反应速率v(CH3OCH3)=
③若T1<T2,则反应的ΔH
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图乙所示:

①根据图示,写出总反应的化学方程式:
②原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式:
您最近一年使用:0次
8 . 造成大气污染的NOx、SO2主要来自于汽车尾气及工厂废气的排放,对其进行处理是我们研究的重要课题。
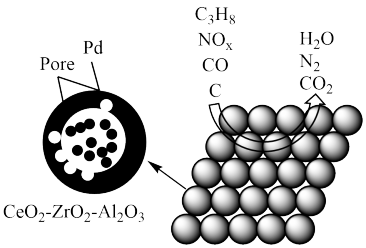
(1)某汽车安装的尾气净化装置工作原理如图所示。下列叙述错误的是_______(填字母)。
(2)已知:2C(s)+O2(g) 2CO(g) ΔH1=-221.0kJ·mol-1
2CO(g) ΔH1=-221.0kJ·mol-1
N2(g)+O2(g) 2NO(g) ΔH2=+180.5kJ·mol-1
2NO(g) ΔH2=+180.5kJ·mol-1
2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH3=-746.0kJ·mol-1
2CO2(g)+N2(g) ΔH3=-746.0kJ·mol-1
则用焦炭还原NO生成无污染气体的热化学方程式为_______ 。
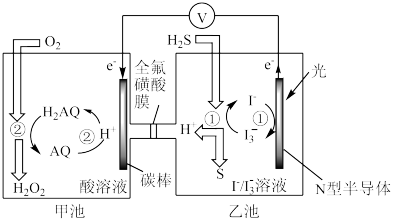
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。
①装置中H+向_______ 池迁移。
②写出乙池溶液中发生反应的离子方程式_______ 。
(4)铈元素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成含有Ce3+和 的吸收液,反应的离子方程式为
的吸收液,反应的离子方程式为_______ ;现采用电解法将上述吸收液中的 转化为无毒物质,同时再生Ce4+,其原理如图所示。
转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的_______ (填字母代号)口流出。
②写出阴极的电极反应式:_______ 。
(1)某汽车安装的尾气净化装置工作原理如图所示。下列叙述错误的是_______(填字母)。

| A.Pd-Pore催化剂可提高尾气净化反应的平衡转化率 |
| B.NOx的生成主要是与汽油燃烧不充分有关 |
| C.在此变化过程中,NOx被还原 |
| D.在催化剂的作用下,CO、NOx、C3H8都转化为无毒的物质 |
 2CO(g) ΔH1=-221.0kJ·mol-1
2CO(g) ΔH1=-221.0kJ·mol-1N2(g)+O2(g)
 2NO(g) ΔH2=+180.5kJ·mol-1
2NO(g) ΔH2=+180.5kJ·mol-12NO(g)+2CO(g)
 2CO2(g)+N2(g) ΔH3=-746.0kJ·mol-1
2CO2(g)+N2(g) ΔH3=-746.0kJ·mol-1则用焦炭还原NO生成无污染气体的热化学方程式为
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

①装置中H+向
②写出乙池溶液中发生反应的离子方程式
(4)铈元素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成含有Ce3+和
 的吸收液,反应的离子方程式为
的吸收液,反应的离子方程式为 转化为无毒物质,同时再生Ce4+,其原理如图所示。
转化为无毒物质,同时再生Ce4+,其原理如图所示。
①Ce4+从电解槽的
②写出阴极的电极反应式:
您最近一年使用:0次
2022-08-20更新
|
148次组卷
|
2卷引用:山西省怀仁市第一中学2021-2022学年高三上学期期中理科综合化学试题
名校
解题方法
9 . 合成氨是目前最有效工业固氮的方法,解决数亿人口生存问题。回答下列问题:
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。
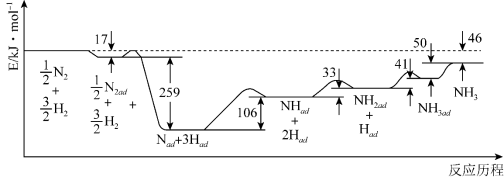
由图可知合成氨反应N2(g)+3 H2(g) 2NH3(g)的∆H=
2NH3(g)的∆H=___________ kJ·mol-1.该历程中反应速率最慢的步骤的化学方程式为___________ 。
(2)工业合成氨反应为:N2(g)+3H2(g) 2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
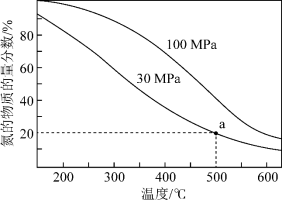
①500℃时,反应平衡常数Kp(30MPa)___________ Kp(100MPa)。(填“<”、“=”、“>”)
②500℃、30 MPa时,氢气的平衡转化率为___________ (保留2位有效数字),Kp=___________ (MPa)-2(列出计算式)。
(3)利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

为使电池持续放电,需选用___________ 离子交换膜(“阴”或“阳”),A电极反应式___________
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

由图可知合成氨反应N2(g)+3 H2(g)
 2NH3(g)的∆H=
2NH3(g)的∆H=(2)工业合成氨反应为:N2(g)+3H2(g)
 2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
①500℃时,反应平衡常数Kp(30MPa)
②500℃、30 MPa时,氢气的平衡转化率为
(3)利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

为使电池持续放电,需选用
您最近一年使用:0次
2021-12-04更新
|
145次组卷
|
2卷引用:山西大学附属中学校2021-2022学年高三上学期期中考试化学试题
10 . 回答下列问题:
(1)将5mL0.005mol/L的 溶液与5mL0.01mol/L的KSCN溶液混合,建立平衡。
溶液与5mL0.01mol/L的KSCN溶液混合,建立平衡。
①若滴加1mol/LKSCN溶液4滴,平衡___________ (填“正向”“不”或“逆向”,②同)移动,溶液红色___________ 。
②若滴加3滴浓KCl溶液,则平衡___________ 移动。
(2)火箭发射时可以用肼( ,液态)为燃料,过氧化氢(液态)作氧化剂,两者反应生成氮气和水蒸气,已知0.05 mol
,液态)为燃料,过氧化氢(液态)作氧化剂,两者反应生成氮气和水蒸气,已知0.05 mol 在上述反应中放出64.22kJ的热量,该反应的热化学方程式为
在上述反应中放出64.22kJ的热量,该反应的热化学方程式为___________ 。
(3)在探究温度对化学平衡影响的实验中。已知,绿色 水溶液中存在如下平衡:
水溶液中存在如下平衡: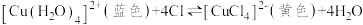
 ,加热的实验现象是溶液变为
,加热的实验现象是溶液变为___________ 色,由此得出的结论是___________ 。
(4)1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得了诺贝尔化学奖。
①工业上合成氨反应的化学方程式为___________ 。
②用 分别表示N2、H2、NH3。观察下图,写出符合在催化剂表面合成氨反应过程的顺序 (将下面五张图按反应过程顺序用序号排列)
分别表示N2、H2、NH3。观察下图,写出符合在催化剂表面合成氨反应过程的顺序 (将下面五张图按反应过程顺序用序号排列) ___________
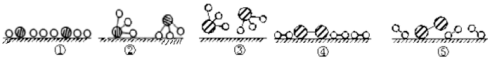
状态①、②、④中,能量最高的状态是___________ 。
(1)将5mL0.005mol/L的
 溶液与5mL0.01mol/L的KSCN溶液混合,建立平衡。
溶液与5mL0.01mol/L的KSCN溶液混合,建立平衡。①若滴加1mol/LKSCN溶液4滴,平衡
②若滴加3滴浓KCl溶液,则平衡
(2)火箭发射时可以用肼(
 ,液态)为燃料,过氧化氢(液态)作氧化剂,两者反应生成氮气和水蒸气,已知0.05 mol
,液态)为燃料,过氧化氢(液态)作氧化剂,两者反应生成氮气和水蒸气,已知0.05 mol 在上述反应中放出64.22kJ的热量,该反应的热化学方程式为
在上述反应中放出64.22kJ的热量,该反应的热化学方程式为(3)在探究温度对化学平衡影响的实验中。已知,绿色
 水溶液中存在如下平衡:
水溶液中存在如下平衡: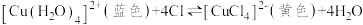
 ,加热的实验现象是溶液变为
,加热的实验现象是溶液变为(4)1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得了诺贝尔化学奖。
①工业上合成氨反应的化学方程式为
②用
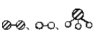 分别表示N2、H2、NH3。观察下图,写出符合在催化剂表面合成氨反应过程的顺序 (将下面五张图按反应过程顺序用序号排列)
分别表示N2、H2、NH3。观察下图,写出符合在催化剂表面合成氨反应过程的顺序 (将下面五张图按反应过程顺序用序号排列) 
状态①、②、④中,能量最高的状态是
您最近一年使用:0次



