在“碳达峰、碳中和”的目标引领下,减少 排放实现
排放实现 的有效转化成为科研工作者的研究热点。根据以下几种常见的
的有效转化成为科研工作者的研究热点。根据以下几种常见的 利用方法,回答下列问题。
利用方法,回答下列问题。
I.以 作催化剂,采用“
作催化剂,采用“ 催化加氢制甲醇”方法将其资源化利用。反应历程如下:
催化加氢制甲醇”方法将其资源化利用。反应历程如下:
i.催化剂活化: (无活性)
(无活性)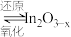 (有活性);
(有活性);
ii. 与
与 在活化的催化剂表面同时发生如下反应:
在活化的催化剂表面同时发生如下反应:
①主反应:
 ,
,
②副反应:
 。
。
(1)某温度下,在恒容反应器中,能说明反应①达到平衡状态的是_______(填序号)。
(2)a. 选择性随气体流速增大而升高的原因可能是
选择性随气体流速增大而升高的原因可能是_______ 。(已知: 选择性
选择性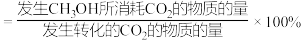 )
)
b.某温度下, 与
与 的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中
的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中 的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:
的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:_______ 。
(3)反应①、②的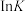 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。

升高温度,反应 的化学平衡常数
的化学平衡常数_______ (填“增大”或“减小”或“不变”)。
(4)恒温恒压密闭容器中,加入2mol 和4mol
和4mol ,只发生反应①和反应②,初始压强为
,只发生反应①和反应②,初始压强为 。
。
a.在230℃以上,升高温度 的平衡转化率增大,但甲醇的产率降低,原因是
的平衡转化率增大,但甲醇的产率降低,原因是_______ 。
b.在300℃发生反应,反应达平衡时, 的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=
的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=_______ (保留两位有效数字)。
II.利用干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
i.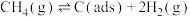
ii.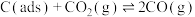
上述反应中 为吸附活性炭,反应历程的能量变化如图1所示:
为吸附活性炭,反应历程的能量变化如图1所示:

(5) 干重整反应的速率由决定
干重整反应的速率由决定_______ (填“反应i”或“反应ⅱ”), 干重整反应的热化方程式为
干重整反应的热化方程式为_______ 。(选取图1中 、
、 、
、 表示反应热)。
表示反应热)。
 排放实现
排放实现 的有效转化成为科研工作者的研究热点。根据以下几种常见的
的有效转化成为科研工作者的研究热点。根据以下几种常见的 利用方法,回答下列问题。
利用方法,回答下列问题。I.以
 作催化剂,采用“
作催化剂,采用“ 催化加氢制甲醇”方法将其资源化利用。反应历程如下:
催化加氢制甲醇”方法将其资源化利用。反应历程如下:i.催化剂活化:
 (无活性)
(无活性)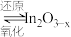 (有活性);
(有活性);ii.
 与
与 在活化的催化剂表面同时发生如下反应:
在活化的催化剂表面同时发生如下反应:①主反应:

 ,
,②副反应:

 。
。(1)某温度下,在恒容反应器中,能说明反应①达到平衡状态的是_______(填序号)。
A.分别用 和 和 表示的速率之比为3:1 表示的速率之比为3:1 |
| B.混合气体的平均摩尔质量不变 |
| C.混合气体的密度不变 |
D. 和 和 的分压之比不变 的分压之比不变 |
 选择性随气体流速增大而升高的原因可能是
选择性随气体流速增大而升高的原因可能是 选择性
选择性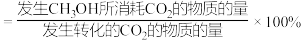 )
)b.某温度下,
 与
与 的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中
的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中 的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:
的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:(3)反应①、②的
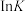 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
升高温度,反应
 的化学平衡常数
的化学平衡常数(4)恒温恒压密闭容器中,加入2mol
 和4mol
和4mol ,只发生反应①和反应②,初始压强为
,只发生反应①和反应②,初始压强为 。
。a.在230℃以上,升高温度
 的平衡转化率增大,但甲醇的产率降低,原因是
的平衡转化率增大,但甲醇的产率降低,原因是b.在300℃发生反应,反应达平衡时,
 的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=
的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=II.利用干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
i.
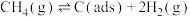
ii.
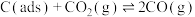
上述反应中
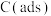 为吸附活性炭,反应历程的能量变化如图1所示:
为吸附活性炭,反应历程的能量变化如图1所示:
(5)
 干重整反应的速率由决定
干重整反应的速率由决定 干重整反应的热化方程式为
干重整反应的热化方程式为 、
、 、
、 表示反应热)。
表示反应热)。
更新时间:2022-11-19 19:04:43
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为: CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
(1)已知: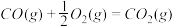 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1
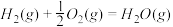 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为:
_______________________________________________ ;
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、 270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:
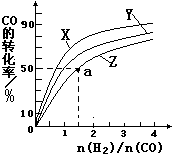
①在上述三种温度中,曲线Z对应的温度是__________
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=_____________________ 。
(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
若5min~10min只改变了某一条件,所改变的条件是_________________________ ;且该条件所改变的量是_______________ 。
 CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1(1)已知:
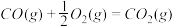 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1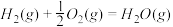 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为:
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、 270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:

①在上述三种温度中,曲线Z对应的温度是
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g)
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
若5min~10min只改变了某一条件,所改变的条件是
您最近一年使用:0次
【推荐2】1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟哈伯合成氨的工业化生产:N2(g)+3H2(g) 2NH3(g)∆H<0.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
2NH3(g)∆H<0.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.

回答下列问题:
(1)已知:①NH3(l)═NH3(g) ∆H1,②N2(g)+3H2(g) 2NH3(l) ∆H2;则反应N2(g)+3H2(g)
2NH3(l) ∆H2;则反应N2(g)+3H2(g)  2NH3(g)的∆H=
2NH3(g)的∆H=_____________ (用含∆H1、∆H2的代数式表示);
(2)合成氨的平衡常数表达式为____________ ,平衡时,M点NH3的体积分数为10%,则N2的转化率为____________ (保留两位有效数字)\;
(3)X轴上a点的数值比b点____________ (填“大”或“小”)。上图中,Y轴表示____________ (填“温度”或“压强”),判断的理由是____________ ;
(4)若将1molN2和3molH2分别投入起始容积为1L的密闭容器中,实验条件和平衡时的相关数据如表所示:
下列判断正确的是____________ ;
A.放出热量:Ql<Q2<∆Hl B.N2的转化率:Ⅰ>Ⅲ
C.平衡常数:Ⅱ>Ⅰ D.达平衡时氨气的体积分数:Ⅰ>Ⅱ
(5)常温下,向VmLamol/L的稀硫酸溶液中滴加等体积bmol/L的氨水,恰好使混合溶液呈中性,此时溶液中c( )
)____________ c( )(填“>”、“<”或“=”) ;
)(填“>”、“<”或“=”) ;
(6)利用氨气设计一种环保燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-,写出负极的电极反应式____________ 。
 2NH3(g)∆H<0.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
2NH3(g)∆H<0.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
回答下列问题:
(1)已知:①NH3(l)═NH3(g) ∆H1,②N2(g)+3H2(g)
 2NH3(l) ∆H2;则反应N2(g)+3H2(g)
2NH3(l) ∆H2;则反应N2(g)+3H2(g)  2NH3(g)的∆H=
2NH3(g)的∆H=(2)合成氨的平衡常数表达式为
(3)X轴上a点的数值比b点
(4)若将1molN2和3molH2分别投入起始容积为1L的密闭容器中,实验条件和平衡时的相关数据如表所示:
| 容器编号 | 实验条件 | 平衡时反应中的能量变化 |
| Ⅰ | 恒温恒容 | 放热Q1kJ |
| Ⅱ | 恒温恒压 | 放热Q2kJ |
| Ⅲ | 恒容绝热 | 放热Q3kJ |
下列判断正确的是
A.放出热量:Ql<Q2<∆Hl B.N2的转化率:Ⅰ>Ⅲ
C.平衡常数:Ⅱ>Ⅰ D.达平衡时氨气的体积分数:Ⅰ>Ⅱ
(5)常温下,向VmLamol/L的稀硫酸溶液中滴加等体积bmol/L的氨水,恰好使混合溶液呈中性,此时溶液中c(
 )
) )(填“>”、“<”或“=”) ;
)(填“>”、“<”或“=”) ;(6)利用氨气设计一种环保燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-,写出负极的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】 是大气主要污染物之一,还原烟气中的
是大气主要污染物之一,还原烟气中的 回收S的相关反应如下:
回收S的相关反应如下:
I: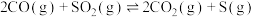
 ,活化能
,活化能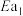
II:
 ,活化能
,活化能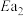
请回答:
(1)已知
 ,则
,则
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)反应I的平衡常数表达式为:
___________ 。
(3)恒温恒容条件下进行上述反应,下列说法正确的是___________。
(4)现以 (一种多孔性物质,具有良好的吸附性能)作为催化剂,用CO去除烟气中的
(一种多孔性物质,具有良好的吸附性能)作为催化剂,用CO去除烟气中的 ,反应相同的时间,
,反应相同的时间, 的去除率随反应温度的变化如图所示。
的去除率随反应温度的变化如图所示。
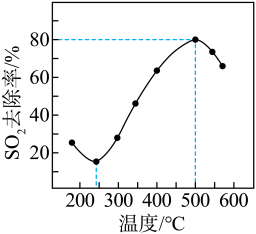
反应温度低于240℃时,随着温度的升高, 去除率降低的原因是
去除率降低的原因是___________ 。
(5)恒温恒容条件下,保持 、CO和C的投料比不变,请在下图中画出平衡时
、CO和C的投料比不变,请在下图中画出平衡时 随压强变化示意图
随压强变化示意图___________ 。

 是大气主要污染物之一,还原烟气中的
是大气主要污染物之一,还原烟气中的 回收S的相关反应如下:
回收S的相关反应如下:I:
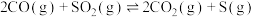
 ,活化能
,活化能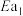
II:

 ,活化能
,活化能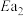
请回答:
(1)已知

 ,则
,则
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)反应I的平衡常数表达式为:

(3)恒温恒容条件下进行上述反应,下列说法正确的是___________。
A.反应I在一定条件下自发进行, |
| B.气体密度不变说明体系达到平衡 |
C.若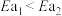 ,则体系中一定以反应I为主 ,则体系中一定以反应I为主 |
D.通过监测反应体系中 与S的浓度变化可判断反应I和反应II是否同时发生 与S的浓度变化可判断反应I和反应II是否同时发生 |
 (一种多孔性物质,具有良好的吸附性能)作为催化剂,用CO去除烟气中的
(一种多孔性物质,具有良好的吸附性能)作为催化剂,用CO去除烟气中的 ,反应相同的时间,
,反应相同的时间, 的去除率随反应温度的变化如图所示。
的去除率随反应温度的变化如图所示。
反应温度低于240℃时,随着温度的升高,
 去除率降低的原因是
去除率降低的原因是(5)恒温恒容条件下,保持
 、CO和C的投料比不变,请在下图中画出平衡时
、CO和C的投料比不变,请在下图中画出平衡时 随压强变化示意图
随压强变化示意图
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐1】镍、钴是重要的战略物资,但资源匮乏。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工艺流程如图:

已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)提高"酸浸”速率的方法有___________ (任写一条)。
(2)基态Fe原子的核外电子排布式为___________ 。
(3)黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12,“除铁”的离子方程式为___________ 。
(4)“除钙镁"时,随pH降低,NaF用量急剧增加,原因是___________ (结合平衡理论解释)。
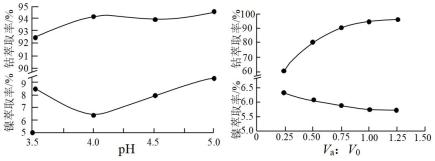
(5)镍、钻萃取率与料液pH、萃取剂体积与料液体积比Va:V0的关系曲线如图所示,则萃取”时应选择的pH和Va:V0分别为_________ 、_________ 。
(6)获得NiSO4(s)的“一系列操作是________ ,工艺流程中,可循环利用的物质是______ 。

已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)提高"酸浸”速率的方法有
(2)基态Fe原子的核外电子排布式为
(3)黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12,“除铁”的离子方程式为
(4)“除钙镁"时,随pH降低,NaF用量急剧增加,原因是
(5)镍、钻萃取率与料液pH、萃取剂体积与料液体积比Va:V0的关系曲线如图所示,则萃取”时应选择的pH和Va:V0分别为

(6)获得NiSO4(s)的“一系列操作是
您最近一年使用:0次
【推荐2】碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。已知25℃, 时:
时:
① 葡萄糖
葡萄糖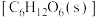 完全燃烧生成
完全燃烧生成 和
和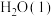 ,放出
,放出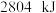 热量。
热量。
②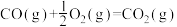
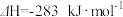 。
。
回答问题:
(1)25℃时, 与
与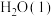 经光合作用生成葡萄糖
经光合作用生成葡萄糖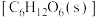 和
和 的热化学方程式为
的热化学方程式为___________ 。
(2)25℃, 时,气态分子断开
时,气态分子断开 化学键的焓变称为键焓。已知
化学键的焓变称为键焓。已知 、
、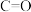 键的键焓分别为
键的键焓分别为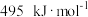 、
、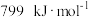 ,
,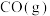 分子中碳氧键的键焓为
分子中碳氧键的键焓为___________  。
。
(3)溶于水的 只有部分转化为
只有部分转化为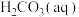 ,大部分以水合
,大部分以水合 的形式存在,水合
的形式存在,水合 可用
可用 表示。已知25℃时,
表示。已知25℃时,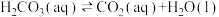 的平衡常数
的平衡常数 ,正反应的速率可表示为
,正反应的速率可表示为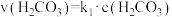 ,逆反应的速率可表示为
,逆反应的速率可表示为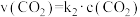 ,则
,则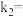
___________ (用含 的代数式表示)。
的代数式表示)。
(4)25℃时,潮湿的石膏雕像表面会发生反应: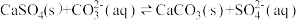 ,其平衡常数
,其平衡常数
___________ 。[已知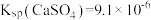 ,
, ]
]
(5)溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石有破坏作用,从化学平衡的角度说明其原因___________ 。
 时:
时:①
 葡萄糖
葡萄糖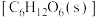 完全燃烧生成
完全燃烧生成 和
和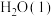 ,放出
,放出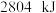 热量。
热量。②
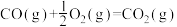
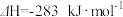 。
。回答问题:
(1)25℃时,
 与
与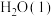 经光合作用生成葡萄糖
经光合作用生成葡萄糖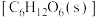 和
和 的热化学方程式为
的热化学方程式为(2)25℃,
 时,气态分子断开
时,气态分子断开 化学键的焓变称为键焓。已知
化学键的焓变称为键焓。已知 、
、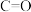 键的键焓分别为
键的键焓分别为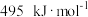 、
、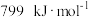 ,
,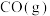 分子中碳氧键的键焓为
分子中碳氧键的键焓为 。
。(3)溶于水的
 只有部分转化为
只有部分转化为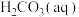 ,大部分以水合
,大部分以水合 的形式存在,水合
的形式存在,水合 可用
可用 表示。已知25℃时,
表示。已知25℃时,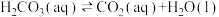 的平衡常数
的平衡常数 ,正反应的速率可表示为
,正反应的速率可表示为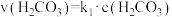 ,逆反应的速率可表示为
,逆反应的速率可表示为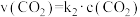 ,则
,则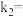
 的代数式表示)。
的代数式表示)。(4)25℃时,潮湿的石膏雕像表面会发生反应:
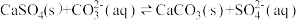 ,其平衡常数
,其平衡常数
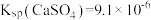 ,
, ]
](5)溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石有破坏作用,从化学平衡的角度说明其原因
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】工业合成氨在人类历史上具有非常重要的意义。回答下列问题:
(1)断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表:
进行反应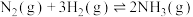 ,当生成2mol
,当生成2mol  时,将
时,将___________ (填“吸收”或“放出”)___________ kJ的热量。
(2)Bosch在研究合成氨工业的催化剂和装置时,发现氢气渗透到钢铁内部生成了一种能产生温室效应的气体,该气体为___________ (填名称),用铁催化氨合成时会产生FeN,氢气与FeN反应生成氨气,写出氢气与FeN反应的化学方程式___________ 。
(3)20世纪初、以Nernst和Haber为代表的研究小组研究不同反应条件下的合成氨反应、所得数据如下表:
试解释Haber采取的生产条件平衡混合气体中 所占体积分数高的原因
所占体积分数高的原因___________ 。
(4)以氨气和二氧化碳为原料制备尿素的化学方程式为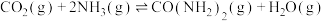 ,反应物平衡转化率随氨碳比的变化曲线如图所示,刚性容器中当投料比
,反应物平衡转化率随氨碳比的变化曲线如图所示,刚性容器中当投料比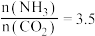 且初始压强为45MPa时,该反应的平衡常数
且初始压强为45MPa时,该反应的平衡常数
___________  。(结果用分数表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
。(结果用分数表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)

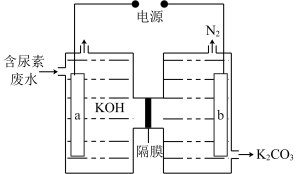
(5)尿素的过度使用会造成水体污染,科学家通过电解的方法处理含尿素的碱性废水、并向煤液化供氢。其装置如图所示,电极b上的电极反应式为___________ 。
(1)断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表:
| 共价键 | H-H | N-H | N≡N |
能量变化/( ) ) | 436.0 | 390.8 | 946.0 |
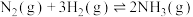 ,当生成2mol
,当生成2mol  时,将
时,将(2)Bosch在研究合成氨工业的催化剂和装置时,发现氢气渗透到钢铁内部生成了一种能产生温室效应的气体,该气体为
(3)20世纪初、以Nernst和Haber为代表的研究小组研究不同反应条件下的合成氨反应、所得数据如下表:
| 研究者 | 压强/atm | 温度/℃ | 催化剂 | 反应结果(平衡混合气体中 所占体积分数) 所占体积分数) |
| Nernst | 50 | 685 | 铂、锰 | 0.96% |
| Haber | 150~250 | 550 | 锇、铀 | 8.25% |
 所占体积分数高的原因
所占体积分数高的原因(4)以氨气和二氧化碳为原料制备尿素的化学方程式为
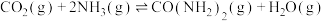 ,反应物平衡转化率随氨碳比的变化曲线如图所示,刚性容器中当投料比
,反应物平衡转化率随氨碳比的变化曲线如图所示,刚性容器中当投料比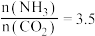 且初始压强为45MPa时,该反应的平衡常数
且初始压强为45MPa时,该反应的平衡常数
 。(结果用分数表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
。(结果用分数表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(5)尿素的过度使用会造成水体污染,科学家通过电解的方法处理含尿素的碱性废水、并向煤液化供氢。其装置如图所示,电极b上的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】合成氨反应N2(g)+3H2(g) 2NH3(g)是目前最有效的工业固氮方法,解决数亿人口生存问题。
2NH3(g)是目前最有效的工业固氮方法,解决数亿人口生存问题。
(1)反应历程中各步势能变化如图所示,其中吸附在催化剂表面的物种用*标注。
该历程中反应速率最慢的步骤的方程式为________ 。
(2)在T℃、压强为0.9MPa条件下,向一恒压密闭容器中通入 =3的混合气体,体系中各气体的含量与时间变化关系如图所示:
=3的混合气体,体系中各气体的含量与时间变化关系如图所示:

①以下叙述不能 说明该条件下反应达到平衡状态的是_________ (填字母)。
a.氨气的体积分数保持不变
b.容器中 保持不变
保持不变
c.气体平均相对分子质量保持不变
d.气体密度保持不变
e.3v(H2)=v(N2)
②反应20min时达到平衡,则0~20min内v(H2)=________ MPa•min-1,该反应的Kp=_______ MPa-2(保留小数点后两位)。(Kp为以分压表示的平衡常数)
③若起始条件相同,在恒容容器中发生反应,则达到平衡时H2的含量符合图中_________ 点(填“d”“e”“f”或“g”)。
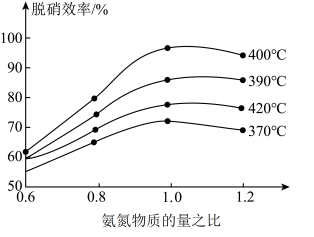
(3)氨化脱硝过程发生反应4NO(g)+4NH3(g)+O2(g)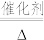 4N2(g)+6H2O(g) △H<0,分析420℃的脱硝效率低于390℃的脱硝效率可能的原因
4N2(g)+6H2O(g) △H<0,分析420℃的脱硝效率低于390℃的脱硝效率可能的原因_________ 。
(4)25℃用甲酸吸收氨气可得到HCOONH4溶液。已知:25℃时甲酸的Ka=1.75×10-5,NH3•H2O的Kb=2×10-5。则反应NH3•H2O+HCOOH HCOO-+NH
HCOO-+NH +H2O的平衡常数K=
+H2O的平衡常数K=________ 。
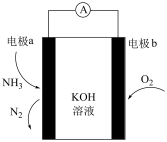
(5)化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图NH3如图。电极a上的电极反应式为:________ 。
 2NH3(g)是目前最有效的工业固氮方法,解决数亿人口生存问题。
2NH3(g)是目前最有效的工业固氮方法,解决数亿人口生存问题。(1)反应历程中各步势能变化如图所示,其中吸附在催化剂表面的物种用*标注。

该历程中反应速率最慢的步骤的方程式为
(2)在T℃、压强为0.9MPa条件下,向一恒压密闭容器中通入
 =3的混合气体,体系中各气体的含量与时间变化关系如图所示:
=3的混合气体,体系中各气体的含量与时间变化关系如图所示:
①以下叙述
a.氨气的体积分数保持不变
b.容器中
 保持不变
保持不变c.气体平均相对分子质量保持不变
d.气体密度保持不变
e.3v(H2)=v(N2)
②反应20min时达到平衡,则0~20min内v(H2)=
③若起始条件相同,在恒容容器中发生反应,则达到平衡时H2的含量符合图中
(3)氨化脱硝过程发生反应4NO(g)+4NH3(g)+O2(g)
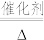 4N2(g)+6H2O(g) △H<0,分析420℃的脱硝效率低于390℃的脱硝效率可能的原因
4N2(g)+6H2O(g) △H<0,分析420℃的脱硝效率低于390℃的脱硝效率可能的原因
(4)25℃用甲酸吸收氨气可得到HCOONH4溶液。已知:25℃时甲酸的Ka=1.75×10-5,NH3•H2O的Kb=2×10-5。则反应NH3•H2O+HCOOH
 HCOO-+NH
HCOO-+NH +H2O的平衡常数K=
+H2O的平衡常数K=(5)化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图NH3如图。电极a上的电极反应式为:

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】氮及氮的化合物在生产生活中有着重要的用途,NH3、HNQ3等是重要化工产品。
(1)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
①2C+ O2→2CO
②C+H2O(g)→CO+H2
③CO+H2O(g)→CO2+H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:表中x=_______ m3,实际消耗了_____ kg焦炭。
(2)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:2CO(g)+SO2(g) 2CO2(g)+S(1) ΔH<0。若向2L 恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
2CO2(g)+S(1) ΔH<0。若向2L 恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示

①与实验a相比,c组改变的实验条件可能是____________ 。
②用P0表示开始时总压强,P表示平衡时总压强,.用α表示SO2的平衡转化率,则α表达式为________ 。
(3)已知N2O4 2NO2,N2O4与NO2共存的温度是264-413K,低于熔点264K时,全部为无色的N2O4晶体,达到264K时N2O4开始分解,沸点294K时成为红棕色的混合气体,温度高与413K时,气体又变为无色。(2NO2
2NO2,N2O4与NO2共存的温度是264-413K,低于熔点264K时,全部为无色的N2O4晶体,达到264K时N2O4开始分解,沸点294K时成为红棕色的混合气体,温度高与413K时,气体又变为无色。(2NO2 2NO+O2)。在1L的密闭容器中发生反应N2O4
2NO+O2)。在1L的密闭容器中发生反应N2O4 2NO2 达到平衡状态。
2NO2 达到平衡状态。
①若此时为标准状态下(273K 101KPa),再向其中加入4.6g纯的NO2,则达到平衡时混合物的颜色____ (和原平衡状态比,填选项字母,下同)
A.增大(加深) B.减小(变浅) C.不变 D.不能确定
②若此时为25℃,101KPa下,再向其中加入4.6g纯的NO2,则达到平衡时混合物的颜色______ ,混合物中NO2的体积分数___________ 。
(4)查阅资料可知:常温下,Ksp[Ag(NH3)2+]= 1.00×107。Ksp[AgC1]=2.50×10-10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq) Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=__________ ;
②计算得到可逆反应AgCl (s)+2NH3(aq) Ag(NH3)2+ (aq)+Cl-(aq)的化学平衡常数K=
Ag(NH3)2+ (aq)+Cl-(aq)的化学平衡常数K=______ ,1 L 1 mol/L氨水中最多可以溶解AgCl_______ mol(保留2位有效数字)
(1)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
①2C+ O2→2CO
②C+H2O(g)→CO+H2
③CO+H2O(g)→CO2+H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:表中x=
| 气体 | CO | N2 | CO2 | H2 | O2 |
| 体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
 2CO2(g)+S(1) ΔH<0。若向2L 恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
2CO2(g)+S(1) ΔH<0。若向2L 恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
①与实验a相比,c组改变的实验条件可能是
②用P0表示开始时总压强,P表示平衡时总压强,.用α表示SO2的平衡转化率,则α表达式为
(3)已知N2O4
 2NO2,N2O4与NO2共存的温度是264-413K,低于熔点264K时,全部为无色的N2O4晶体,达到264K时N2O4开始分解,沸点294K时成为红棕色的混合气体,温度高与413K时,气体又变为无色。(2NO2
2NO2,N2O4与NO2共存的温度是264-413K,低于熔点264K时,全部为无色的N2O4晶体,达到264K时N2O4开始分解,沸点294K时成为红棕色的混合气体,温度高与413K时,气体又变为无色。(2NO2 2NO+O2)。在1L的密闭容器中发生反应N2O4
2NO+O2)。在1L的密闭容器中发生反应N2O4 2NO2 达到平衡状态。
2NO2 达到平衡状态。①若此时为标准状态下(273K 101KPa),再向其中加入4.6g纯的NO2,则达到平衡时混合物的颜色
A.增大(加深) B.减小(变浅) C.不变 D.不能确定
②若此时为25℃,101KPa下,再向其中加入4.6g纯的NO2,则达到平衡时混合物的颜色
(4)查阅资料可知:常温下,Ksp[Ag(NH3)2+]= 1.00×107。Ksp[AgC1]=2.50×10-10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)
 Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=②计算得到可逆反应AgCl (s)+2NH3(aq)
 Ag(NH3)2+ (aq)+Cl-(aq)的化学平衡常数K=
Ag(NH3)2+ (aq)+Cl-(aq)的化学平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】硫及其化合物在生产生活中有广泛的应用。请回答:
(1)室温下, 溶液呈碱性的原因是
溶液呈碱性的原因是___________ (用离子方程式表示)。
(2)下列关于硫及其化合物的说法,正确的是___________ (填字母)。
A.硫元素在自然界中只能以化合态形式存在
B. 通入紫色石蕊试液,先变红后褪色
通入紫色石蕊试液,先变红后褪色
C.酸雨是 的降水,主要是由污染物
的降水,主要是由污染物 、
、 造成
造成
D.浓硫酸中加入少量胆矾晶体,搅拌,固体逐渐变成白色
(3)光谱研究表明, 的水溶液中存在下列平衡:
的水溶液中存在下列平衡:
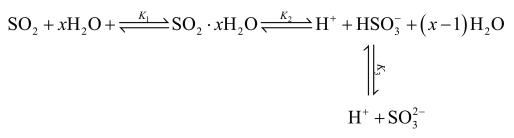
其中 、
、 、
、 为各步的平衡常数,且
为各步的平衡常数,且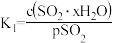 (
( 表示
表示 的平衡压强)。
的平衡压强)。
①当 的平衡压强为p时,测得
的平衡压强为p时,测得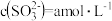 ,则溶液
,则溶液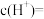
___________ 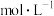 。
。
(用含p、a、 、
、 、
、 的式子表示)
的式子表示)
②滴加NaOH至 时,溶液中
时,溶液中 。如果溶液中
。如果溶液中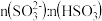
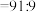 ,需加NaOH将溶液pH调整为约等于
,需加NaOH将溶液pH调整为约等于___________ 。
(4)“钙基固硫”是利用石灰石将燃煤烟气中的 转化为
转化为 。但高温时CO会与
。但高温时CO会与 反应而影响脱硫效率。相关反应如下:
反应而影响脱硫效率。相关反应如下:
Ⅰ.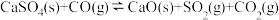
Ⅱ.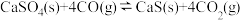
当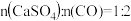 时,反应25min,体系中
时,反应25min,体系中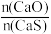 的比值随温度变化如表所示:
的比值随温度变化如表所示:
请结合题给反应过程能量图,说明:
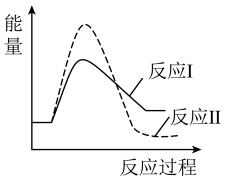
①750K→1250K时,比值随温度升高逐渐减小的原因是___________ 。
②1250K后,比值随温度升高逐渐增大的原因是___________ 。
(5)氨水也可吸收 :
: ,
,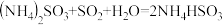 。能提高
。能提高 去除率的措施有
去除率的措施有___________ (填字母)。
A.增大氨水浓度 B.加热煮沸
C.降低烟气的流速 D.补充 ,将
,将 氧化为
氧化为
(1)室温下,
 溶液呈碱性的原因是
溶液呈碱性的原因是(2)下列关于硫及其化合物的说法,正确的是
A.硫元素在自然界中只能以化合态形式存在
B.
 通入紫色石蕊试液,先变红后褪色
通入紫色石蕊试液,先变红后褪色C.酸雨是
 的降水,主要是由污染物
的降水,主要是由污染物 、
、 造成
造成D.浓硫酸中加入少量胆矾晶体,搅拌,固体逐渐变成白色
(3)光谱研究表明,
 的水溶液中存在下列平衡:
的水溶液中存在下列平衡: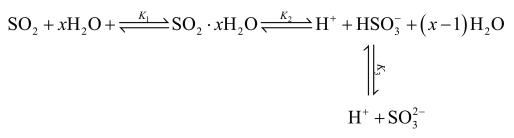
其中
 、
、 、
、 为各步的平衡常数,且
为各步的平衡常数,且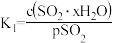 (
( 表示
表示 的平衡压强)。
的平衡压强)。①当
 的平衡压强为p时,测得
的平衡压强为p时,测得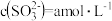 ,则溶液
,则溶液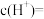
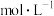 。
。(用含p、a、
 、
、 、
、 的式子表示)
的式子表示)②滴加NaOH至
 时,溶液中
时,溶液中 。如果溶液中
。如果溶液中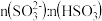
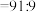 ,需加NaOH将溶液pH调整为约等于
,需加NaOH将溶液pH调整为约等于(4)“钙基固硫”是利用石灰石将燃煤烟气中的
 转化为
转化为 。但高温时CO会与
。但高温时CO会与 反应而影响脱硫效率。相关反应如下:
反应而影响脱硫效率。相关反应如下:Ⅰ.
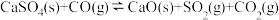
Ⅱ.
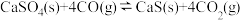
当
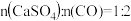 时,反应25min,体系中
时,反应25min,体系中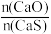 的比值随温度变化如表所示:
的比值随温度变化如表所示:| 温度 | 750K | 1250K | 1750K |
| 比值 | 3.57 | 1.08 | 3.42 |

①750K→1250K时,比值随温度升高逐渐减小的原因是
②1250K后,比值随温度升高逐渐增大的原因是
(5)氨水也可吸收
 :
: ,
,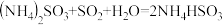 。能提高
。能提高 去除率的措施有
去除率的措施有A.增大氨水浓度 B.加热煮沸
C.降低烟气的流速 D.补充
 ,将
,将 氧化为
氧化为
您最近一年使用:0次



