1 . 下列有关化学反应自发性的说法中正确的是( )
| A.放热反应一定是自发进行的反应 |
| B.化学反应的熵变与反应的方向无关 |
| C.反应的自发性要综合考虑焓变和熵变两种因素 |
| D.只有不需要任何条件就能够自动进行的过程才是自发过程 |
您最近一年使用:0次
2019-01-14更新
|
370次组卷
|
3卷引用:湖北省监利县实验高中2017-2018学年高二上学期期中考试化学试题
2 .  肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
(1)N2H4中N原子核外最外层达到8电子稳定结构.写出N2H4的结构式:___________ .
(2)实验室用两种固体制取NH3的反应化学方程式为_____________ .
(3)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为_____________ .
(4)肼一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为_____________ .
(5)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2]反应的化学方程式为2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
①焓变△H_________ 0(填“>”、“<”或“=”).
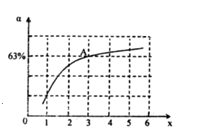
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)\frac{n(NH_{3})}{n(CO_{2})}=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大而增大的原因是_____________ .图中A点处,NH3的平衡转化率为___________ .
(6)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料,发生反应:N2(g)+3H2(g)⇌2NH3(g),测得甲容器中H2的平衡转化率为40%.
①判断乙容器中反应进行的方向是_____________ (填“正向或“逆向”)移动.
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为_____________ 。
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:___________________ ,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是____________ (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为_____________________ 。
(7)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是___________ (填字母代号)。
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(8)如果某氨水的电离程度为1%,浓度为0.01 mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),溶液中的NH3·H2O的浓度为__________ {已知Ksp[Mg(OH)2]=4.0×10-12]}
 肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:(1)N2H4中N原子核外最外层达到8电子稳定结构.写出N2H4的结构式:
(2)实验室用两种固体制取NH3的反应化学方程式为
(3)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为
(4)肼一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为
(5)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2]反应的化学方程式为2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)\frac{n(NH_{3})}{n(CO_{2})}=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大而增大的原因是

(6)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料,发生反应:N2(g)+3H2(g)⇌2NH3(g),测得甲容器中H2的平衡转化率为40%.
| n(N2) | n(H2) | n(NH3) | |
| 甲 | 1mol | 3mol | 0mol |
| 乙 | 0.5mol | 1.5mol | 1mol |
| 丙 | 0mol | 0mol | 4mol |
①判断乙容器中反应进行的方向是
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:
(7)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(8)如果某氨水的电离程度为1%,浓度为0.01 mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),溶液中的NH3·H2O的浓度为
您最近一年使用:0次
13-14高二·广东江门·阶段练习
名校
3 . 下列说法正确的是
| A.所有的放热反应都能在常温常压下自发进行 |
| B.Ba(OH)2·8H2O与NH4Cl反应属放热反应 |
| C.天然气燃烧时,其化学能全部转化为热能 |
| D.反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
您最近一年使用:0次
2016-12-09更新
|
1190次组卷
|
7卷引用:湖北省沙市中学2017-2018学年高二上学期期末考试化学试题
4 . 下列说法中错误 的是
| A.凡是放热反应而且熵增加的反应,就更易自发进行 |
| B.对于同一物质在不同状态时的熵值是:气态>液态>固态 |
| C.平衡常数K值越大,则可逆反应进行越完全,反应物的转化率越大 |
| D.凡是能量达到活化能的分子发生的碰撞均为有效碰撞 |
您最近一年使用:0次
2016-12-09更新
|
1496次组卷
|
16卷引用:湖北省荆州中学2019-2020学年高二上学期第一次月考化学试题
湖北省荆州中学2019-2020学年高二上学期第一次月考化学试题(已下线)09~10年大连23中高一下学期期末考试化学卷(已下线)2010年黑龙江牡丹江一中高二上学期期中考试化学试卷(已下线)2010—2011学年广东省梅州市曾宪梓中学高二上学期期末考试理综)化学部分天津市六校(静海一中、杨村一中、宝坻一中等)2017-2018学年高二上学期期末联考化学试题江西省上高县第二中学2019-2020学年高二上学期第一次月考化学试题安徽省芜湖市城南实验中学2019-2020学年高二上学期期中考试化学试题河北省唐山市遵化市第一中学2019-2020学年高二上学期第一次月考化学试题河北省衡水市深州市中学2019-2020学年高二下学期期中考试化学试题(已下线)2.4+化学反应进行的方向-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)河南省洛阳市2020-2021学年高二上学期期中考试化学试题吉林省白山市抚松县第五中学2020-2021学年高二上学期期中考试化学试题(已下线)2.3 化学反应的方向(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)湖南省祁东县育贤中学2022-2023学年高二上学期第一次月考化学试题山东省济南市天桥区黄河双语实验学校2021-2022学年高二上学期10月月考化学试题四川省宜宾市第四中学校2023-2024学年高二上学期11月期中考试化学试题
5 . 下列说法正确的是
| A.Na与H2O的反应是熵增的放热反应,该反应能自发进行 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.增大压强会加快化学反应速率,其原因是增加了活化分子的百分率 |
| D.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 |
您最近一年使用:0次
2016-11-04更新
|
438次组卷
|
2卷引用:2015-2016学年湖北武汉第二中学高二上期中考试化学试卷



