1 . 环氧乙烷(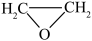 )常温下易燃易爆,其爆炸极限为5%~100%,常用于医学消毒,工业上使用特定的催化剂催化乙烯氧化法制备环氧乙烷,主要涉及反应:
)常温下易燃易爆,其爆炸极限为5%~100%,常用于医学消毒,工业上使用特定的催化剂催化乙烯氧化法制备环氧乙烷,主要涉及反应:
ⅰ.2C2H4(g)+O2(g) 2
2 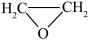 (g)
(g)
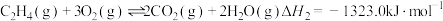
回答下列问题:
(1)已知
 ,键能
,键能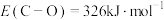 ,
,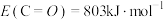 ,则
,则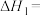
(2)环氧乙烷的合成采用的主催化剂都是银单质。将乙烯、氧气、氮气按体积比为2∶1∶7充入反应容器中,只发生反应ⅰ和ⅱ,压强恒定为pMPa,使用不同的助催化剂反应一定时间,乙烯的转化率与环氧乙烷的选择性随温度的变化如图所示(已知m处于平衡状态):
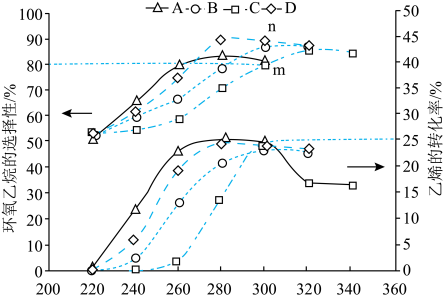
②应选择的适宜的条件是
③m点对应的反应ⅰ的平衡常数

 (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。(3)我国科研工作者提出通过阴离子交换膜及合适的催化剂,先使CO2电催化转化为乙烯,乙烯再与另一电化学体系结合制备高附加值的环氧乙烷的工作原理如图所示:
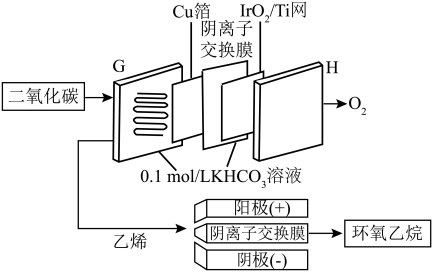
②电极H上生成10.08L(标准状况)O2时,理论上可得到环氧乙烷的质量为
您最近一年使用:0次
名校
解题方法
2 . 探究甲醇对丙烷制丙烯的影响。丙烷制烯烃过程主要发生的反应有
ⅰ.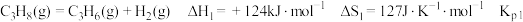
ⅱ.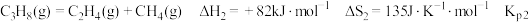
ⅲ.
已知: 为用气体分压表示的平衡常数,分压=物质的量分数×总压。在
为用气体分压表示的平衡常数,分压=物质的量分数×总压。在 下,丙烷单独进料时,平衡体系中各组分的体积分数
下,丙烷单独进料时,平衡体系中各组分的体积分数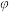 见下表。
见下表。
(1)比较反应自发进行(∆G=∆H-T∆S<0)的最低温度,反应ⅰ_____ 反应 ⅱ(填“>”或“<”)。
(2)①从初始投料到达到平衡,反应 ⅰ、ⅱ、ⅲ 的丙烷消耗的平均速率从大到小的顺序为:_____ 。
②平衡体系中检测不到 ,可认为存在反应:
,可认为存在反应: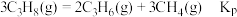 ,下列相关说法正确的是
,下列相关说法正确的是_____ (填标号)。
a.
b.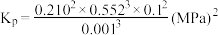
c.使用催化剂,可提高丙烯的平衡产率
d.平衡后再通入少量丙烷,可提高丙烯的体积分数
③由表中数据推算:丙烯选择性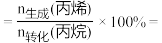
_____ (列出计算式)。
(3)丙烷甲醇共进料时,还发生反应:ⅳ.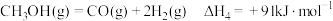 ,在
,在 下,平衡体系中各组分体积分数与进料比的关系如图所示。
下,平衡体系中各组分体积分数与进料比的关系如图所示。
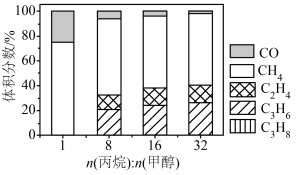
①进料比n(丙烷):n(甲醇) 时,体系总反应:
时,体系总反应: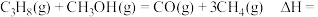
______  。
。
②随着甲醇投料增加,平衡体系中丙烯的体积分数降低的原因是______ 。
ⅰ.
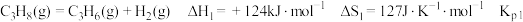
ⅱ.
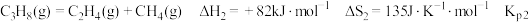
ⅲ.

已知:
 为用气体分压表示的平衡常数,分压=物质的量分数×总压。在
为用气体分压表示的平衡常数,分压=物质的量分数×总压。在 下,丙烷单独进料时,平衡体系中各组分的体积分数
下,丙烷单独进料时,平衡体系中各组分的体积分数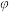 见下表。
见下表。| 物质 | 丙烯 | 乙烯 | 甲烷 | 丙烷 | 氢气 |
| 体积分数(%) | 21 | 23.7 | 55.2 | 0.1 | 0 |
(1)比较反应自发进行(∆G=∆H-T∆S<0)的最低温度,反应ⅰ
(2)①从初始投料到达到平衡,反应 ⅰ、ⅱ、ⅲ 的丙烷消耗的平均速率从大到小的顺序为:
②平衡体系中检测不到
 ,可认为存在反应:
,可认为存在反应: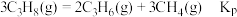 ,下列相关说法正确的是
,下列相关说法正确的是a.

b.
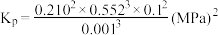
c.使用催化剂,可提高丙烯的平衡产率
d.平衡后再通入少量丙烷,可提高丙烯的体积分数
③由表中数据推算:丙烯选择性
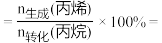
(3)丙烷甲醇共进料时,还发生反应:ⅳ.
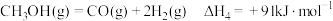 ,在
,在 下,平衡体系中各组分体积分数与进料比的关系如图所示。
下,平衡体系中各组分体积分数与进料比的关系如图所示。
①进料比n(丙烷):n(甲醇)
 时,体系总反应:
时,体系总反应: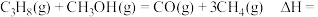
 。
。②随着甲醇投料增加,平衡体系中丙烯的体积分数降低的原因是
您最近一年使用:0次
解题方法
3 . 在2023年第19届杭州亚运会上,主火炬塔的燃料首次使用废碳再生的绿色甲醇,实现循环内的零排放,这也是首次在大型体育赛事上使用这种绿色燃料。
(1)常温常压下利用铜基催化剂实现二氧化碳选择性加氢制甲醇的反应机理和能量变化图如下(其中吸附在催化剂表面上的粒子用*标注)。
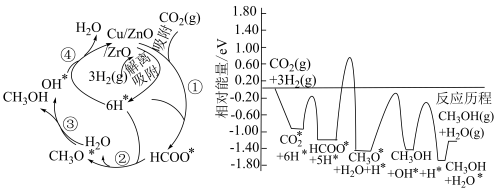
①下列说法正确的是________ (填字母,下同)。
A. 转化为甲醇,在高温下不能自发进行
转化为甲醇,在高温下不能自发进行
B.甲醇被称为绿色燃料,因为甲醇无毒无害无污染
C.零排放是指甲醇在燃烧过程中,没有CO、 等物质生成
等物质生成
D.寻找高效催化剂,有利于 的回收利用,早日实现国家碳中和战略目标
的回收利用,早日实现国家碳中和战略目标
②该转化历程的决速步的化学方程式为:________ 。
(2)一定条件下, 和
和 可以发生如下两个平行反应:
可以发生如下两个平行反应:
Ⅰ.
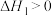
Ⅱ.

①为了提高 的平衡转化率且增大甲醇的平衡产率,可采用的措施是
的平衡转化率且增大甲醇的平衡产率,可采用的措施是________ 。
A.增大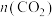 B.及时移走甲醇 C.减小容器体积 D.充入He
B.及时移走甲醇 C.减小容器体积 D.充入He
②保持温度恒定,向一定体积的密闭容器中按体积比1:3充入 和
和 ,起始压强为4MPa。发生上述平行反应,达到平衡后压强为2.8MPa。已知达到平衡时
,起始压强为4MPa。发生上述平行反应,达到平衡后压强为2.8MPa。已知达到平衡时 的选择性为75%(反应中转化的
的选择性为75%(反应中转化的 中生成
中生成 的百分比)。则:
的百分比)。则:
 的转化率为
的转化率为________ ;该条件下反应Ⅱ的压强平衡常数 为
为________ 。(用分压表示,分压=总压×物质的量分数)
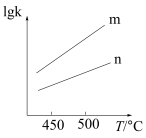
③对于反应Ⅱ,已知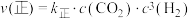 ,
, ,(
,( 、
、 分别为正逆反应速率常数)。该反应的
分别为正逆反应速率常数)。该反应的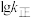 、
、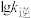 随温度变化的曲线如图所示,则
随温度变化的曲线如图所示,则________ (填“m”或“n”)表示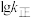 随温度变化的曲线。
随温度变化的曲线。
(3) 电解技术助力实现碳中和。科学家们提出可以利用电解装置在酸性水溶液中将
电解技术助力实现碳中和。科学家们提出可以利用电解装置在酸性水溶液中将 直接转化为
直接转化为 ,则生成
,则生成 的电极反应方程式为:
的电极反应方程式为:________ 。
(1)常温常压下利用铜基催化剂实现二氧化碳选择性加氢制甲醇的反应机理和能量变化图如下(其中吸附在催化剂表面上的粒子用*标注)。

①下列说法正确的是
A.
 转化为甲醇,在高温下不能自发进行
转化为甲醇,在高温下不能自发进行B.甲醇被称为绿色燃料,因为甲醇无毒无害无污染
C.零排放是指甲醇在燃烧过程中,没有CO、
 等物质生成
等物质生成D.寻找高效催化剂,有利于
 的回收利用,早日实现国家碳中和战略目标
的回收利用,早日实现国家碳中和战略目标②该转化历程的决速步的化学方程式为:
(2)一定条件下,
 和
和 可以发生如下两个平行反应:
可以发生如下两个平行反应:Ⅰ.

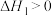
Ⅱ.


①为了提高
 的平衡转化率且增大甲醇的平衡产率,可采用的措施是
的平衡转化率且增大甲醇的平衡产率,可采用的措施是A.增大
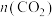 B.及时移走甲醇 C.减小容器体积 D.充入He
B.及时移走甲醇 C.减小容器体积 D.充入He②保持温度恒定,向一定体积的密闭容器中按体积比1:3充入
 和
和 ,起始压强为4MPa。发生上述平行反应,达到平衡后压强为2.8MPa。已知达到平衡时
,起始压强为4MPa。发生上述平行反应,达到平衡后压强为2.8MPa。已知达到平衡时 的选择性为75%(反应中转化的
的选择性为75%(反应中转化的 中生成
中生成 的百分比)。则:
的百分比)。则: 的转化率为
的转化率为 为
为③对于反应Ⅱ,已知
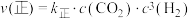 ,
, ,(
,( 、
、 分别为正逆反应速率常数)。该反应的
分别为正逆反应速率常数)。该反应的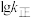 、
、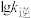 随温度变化的曲线如图所示,则
随温度变化的曲线如图所示,则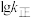 随温度变化的曲线。
随温度变化的曲线。
(3)
 电解技术助力实现碳中和。科学家们提出可以利用电解装置在酸性水溶液中将
电解技术助力实现碳中和。科学家们提出可以利用电解装置在酸性水溶液中将 直接转化为
直接转化为 ,则生成
,则生成 的电极反应方程式为:
的电极反应方程式为:
您最近一年使用:0次
4 . 二氧化碳加氢制甲烷和甲烷重整对碳资源利用具有重要的战略意义。回答下列问题:
I.CO2加氢选择合成甲烷的主要反应如下:
①CO2(g)+4H2 CH4(g)+2H2O(g) △H1(298K)
CH4(g)+2H2O(g) △H1(298K)
②CO2(g)+H2(g) CO(g)+H2O(g) △H2(298K)
CO(g)+H2O(g) △H2(298K)
③2CO(g)+2H2(g) CO2(g)+CH4(g) △H3(298K)
CO2(g)+CH4(g) △H3(298K)
在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,如表为298K时几种物质的标准摩尔生成焓。
(1)有利于反应①自发进行的条件是_______ (填“高温”或“低温”);根据表中数据计算反应②的焓变△H2(298K)=_______ kJ·mol-1。
(2)在一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和4molH2发生上述反应,反应20min容器内反应达到平衡时,容器中CH4为amol,CO为bmol,以H2表示的0~20min内平均反应速率v(H2)=_______ mol·L-1·min-1(用含a、b、V的代数式表示,下同),此时H2O(g)的浓度为_______ mol·L-1,反应II的平衡常数为_______ (列出计算式)。
II.甲烷重整工艺主要包括甲烷水蒸气重整制氢、甲烷部分氧化重整制氢、甲烷二氧化碳重整制氢、甲烷三重整制氢等。
(3)甲烷三重整制氢的逆反应CO(g)+3H2 CH4(g)+H2O(g)。合成总反应在起始物
CH4(g)+H2O(g)。合成总反应在起始物 =3时,在不同条件下达到平衡,设体系中CH4的物质的量分数为x(CH4),在t=250℃下的x(CH4)-p、在p=5×105Pa下的x(CH4)-t如图所示。
=3时,在不同条件下达到平衡,设体系中CH4的物质的量分数为x(CH4),在t=250℃下的x(CH4)-p、在p=5×105Pa下的x(CH4)-t如图所示。
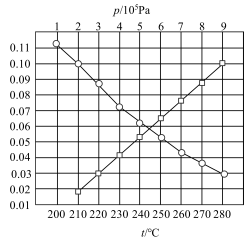
①当CO的平衡转化率为 时,反应条件可能是
时,反应条件可能是_______ 。
②甲烷三重整制氢工业一般将反应温度设置为750℃~920℃,将反应压力设置为2~3MPa并向转化炉内通入空气或氧气,通入空气或氧气的目的是_______ 。
I.CO2加氢选择合成甲烷的主要反应如下:
①CO2(g)+4H2
 CH4(g)+2H2O(g) △H1(298K)
CH4(g)+2H2O(g) △H1(298K)②CO2(g)+H2(g)
 CO(g)+H2O(g) △H2(298K)
CO(g)+H2O(g) △H2(298K)③2CO(g)+2H2(g)
 CO2(g)+CH4(g) △H3(298K)
CO2(g)+CH4(g) △H3(298K)在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,如表为298K时几种物质的标准摩尔生成焓。
| 物质 | H2(g) | O2(g) | CO(g) | CO2(g) | H2O(g) | CH4(g) |
| 标准摩尔生成焓(kJ·mol-1) | 0 | 0 | -110.5 | -393.5 | -241.8 | -74.81 |
(1)有利于反应①自发进行的条件是
(2)在一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和4molH2发生上述反应,反应20min容器内反应达到平衡时,容器中CH4为amol,CO为bmol,以H2表示的0~20min内平均反应速率v(H2)=
II.甲烷重整工艺主要包括甲烷水蒸气重整制氢、甲烷部分氧化重整制氢、甲烷二氧化碳重整制氢、甲烷三重整制氢等。
(3)甲烷三重整制氢的逆反应CO(g)+3H2
 CH4(g)+H2O(g)。合成总反应在起始物
CH4(g)+H2O(g)。合成总反应在起始物 =3时,在不同条件下达到平衡,设体系中CH4的物质的量分数为x(CH4),在t=250℃下的x(CH4)-p、在p=5×105Pa下的x(CH4)-t如图所示。
=3时,在不同条件下达到平衡,设体系中CH4的物质的量分数为x(CH4),在t=250℃下的x(CH4)-p、在p=5×105Pa下的x(CH4)-t如图所示。
①当CO的平衡转化率为
 时,反应条件可能是
时,反应条件可能是②甲烷三重整制氢工业一般将反应温度设置为750℃~920℃,将反应压力设置为2~3MPa并向转化炉内通入空气或氧气,通入空气或氧气的目的是
您最近一年使用:0次
名校
解题方法
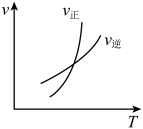
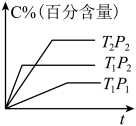
5 . 以下图像对应的叙述正确的是
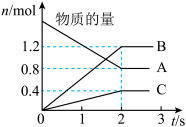 | 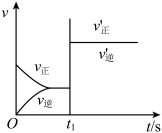 |  |  |
 | 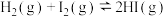 |   |   |
| 甲 | 乙 | 丙 | 丁 |
| A.图丁:该正向反应在任何温度下都能自发进行 |
| B.图丙:对图中反应升高温度,该反应平衡常数减小 |
C.图乙: 时刻改变的条件只能是加入催化剂 时刻改变的条件只能是加入催化剂 |
D.图甲: 的平衡转化率为 的平衡转化率为 |
您最近一年使用:0次
2023-10-27更新
|
545次组卷
|
2卷引用:湖北省襄阳市第六中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
6 . 工业合成氨是人类科学技术的一项重大突破。其合成原理为:

(1)下列关于工业合成氨的说法正确的是___________。
(2)一定温度下,在密闭容器中充入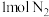 和
和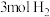 并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的
并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的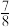 ,则
,则 的转化率为
的转化率为___________ 。
(3)工业上合成氨的部分工艺流程如图:
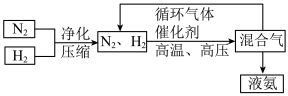
请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因___________ 。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响,实验结果如图所示(图中T表示温度)。则:
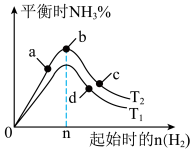
图象中 和
和 的关系是:
的关系是:
___________  (填“>、<或=”,下同);a、b、c、d四点所处的平衡状态中,反应物
(填“>、<或=”,下同);a、b、c、d四点所处的平衡状态中,反应物 的转化率最高的是
的转化率最高的是___________ (填字母)。
(5)恒温下,往一个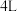 的密闭容器中充入
的密闭容器中充入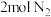 和
和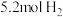 ,反应过程中对
,反应过程中对 的浓度进行检测,得到的数据如表所示:
的浓度进行检测,得到的数据如表所示:
此条件下该反应的化学平衡常数
___________ ;若维持容器体积不变,温度不变,往原平衡体系中加入 、
、 和
和 各
各 ,化学平衡将向
,化学平衡将向___________ 反应方向移动(填“正”或“逆”)。

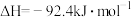

(1)下列关于工业合成氨的说法正确的是___________。
A.因为 ,所以该反应一定能自发进行 ,所以该反应一定能自发进行 |
| B.工业合成氨的反应是熵减小的放热反应,在常温时可自发进行 |
| C.合成氨反应选择在400~500℃进行的重要原因是此温度下氨的产率最高 |
| D.生产中在考虑动力和设备材料承受能力的前提下,压强越大越好 |
(2)一定温度下,在密闭容器中充入
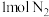 和
和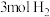 并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的
并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的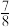 ,则
,则 的转化率为
的转化率为(3)工业上合成氨的部分工艺流程如图:

请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响,实验结果如图所示(图中T表示温度)。则:

图象中
 和
和 的关系是:
的关系是:
 (填“>、<或=”,下同);a、b、c、d四点所处的平衡状态中,反应物
(填“>、<或=”,下同);a、b、c、d四点所处的平衡状态中,反应物 的转化率最高的是
的转化率最高的是(5)恒温下,往一个
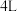 的密闭容器中充入
的密闭容器中充入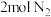 和
和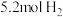 ,反应过程中对
,反应过程中对 的浓度进行检测,得到的数据如表所示:
的浓度进行检测,得到的数据如表所示:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
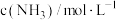 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |

 、
、 和
和 各
各 ,化学平衡将向
,化学平衡将向
您最近一年使用:0次
名校
解题方法
7 . 聚丙烯简称PP,是一种应用非常广泛的有机合成高分子材料,其单体丙烯可以通过丙烷催化剂脱氢制备。
已知:

(1)
___________ 0(填“>”、“<”或“=”),该反应在___________ (填“高温”或“低温”)更容易自发进行。
(2)已知 、
、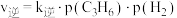 ,其中
,其中 、
、 为速率常数。
为速率常数。 ,
, 时,
时,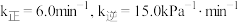 ,在容器中投入一定量的
,在容器中投入一定量的 ,反应达到平衡时,
,反应达到平衡时,
___________ 。( )
)
(3)已知速率常数k与温度T的关系可表示为: 。其中
。其中 为反应活化能,
为反应活化能, ,A为常数。
,A为常数。
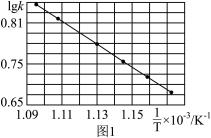
①丙烷脱氢速率常数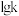 与
与 的图像如图1所示,则可通过斜率计算
的图像如图1所示,则可通过斜率计算___________ 。
②800K时,其他条件不变,使用某催化剂使丙烷脱氢反应的总活化能降低了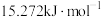 ,则反应速率变为原来的
,则反应速率变为原来的___________ 倍。
③若催化剂能降低相同的活化能,当温度越___________ (填“高”或“低”)时, 越大。
越大。
(4)“丙烷催化脱氢膜反应器”的原理如图2所示。在一定压强下,该装置采用___________ 措施提高了 的转化率。
的转化率。

(5)丙烷催化氧化也是制备丙烯的常见方法,下图为两种催化剂(甲采用碳基催化剂,乙采用钒系催化剂)催化氧化丙烷的机理。
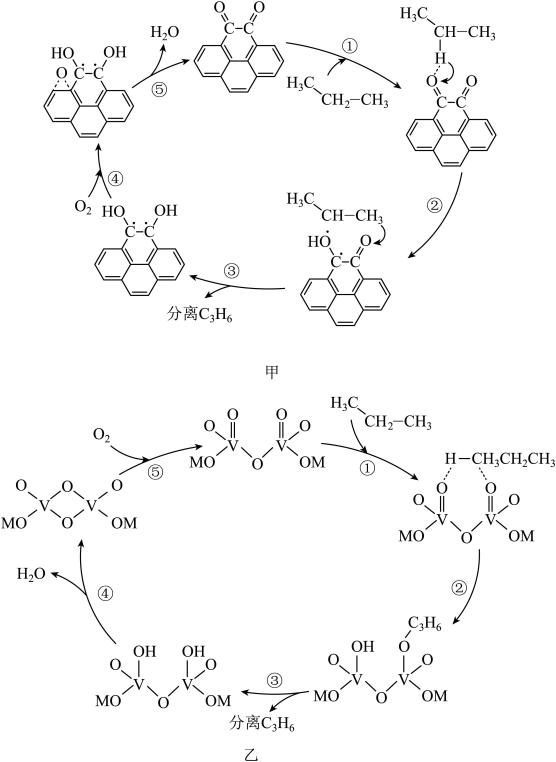
下列说法正确的是___________。
已知:


(1)

(2)已知
 、
、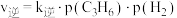 ,其中
,其中 、
、 为速率常数。
为速率常数。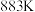 ,
, 时,
时,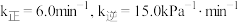 ,在容器中投入一定量的
,在容器中投入一定量的 ,反应达到平衡时,
,反应达到平衡时,
 )
)(3)已知速率常数k与温度T的关系可表示为:
 。其中
。其中 为反应活化能,
为反应活化能,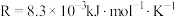 ,A为常数。
,A为常数。①丙烷脱氢速率常数
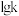 与
与 的图像如图1所示,则可通过斜率计算
的图像如图1所示,则可通过斜率计算
②800K时,其他条件不变,使用某催化剂使丙烷脱氢反应的总活化能降低了
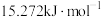 ,则反应速率变为原来的
,则反应速率变为原来的③若催化剂能降低相同的活化能,当温度越
 越大。
越大。(4)“丙烷催化脱氢膜反应器”的原理如图2所示。在一定压强下,该装置采用
 的转化率。
的转化率。
(5)丙烷催化氧化也是制备丙烯的常见方法,下图为两种催化剂(甲采用碳基催化剂,乙采用钒系催化剂)催化氧化丙烷的机理。

下列说法正确的是___________。
| A.每步反应都是氧化还原反应 |
| B.两种催化剂都可防止丙烯进一步被氧化 |
| C.碳基催化剂的活性温度低 |
D.若用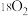 参与反应,最终两种催化剂中都含有 参与反应,最终两种催化剂中都含有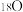 |
您最近一年使用:0次
解题方法
8 . 中央工作会议强调“加快新能源、绿色低碳等前沿技术研发和应用推广”, 甲烷化是目前研究的热点方向之一,在环境保护方面显示出较大潜力。其主要反应如下:
甲烷化是目前研究的热点方向之一,在环境保护方面显示出较大潜力。其主要反应如下:
反应I:

反应Ⅱ:

回答下列问题:
(1)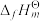 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成 该物质的焓变。反应I的反应热
该物质的焓变。反应I的反应热
___________ ,温度越高,反应I正向自发趋势越___________ (填“大”或“小”)。
(2)将一定量的 和
和 的混合气体充入密闭容器中,反应相同的时间,
的混合气体充入密闭容器中,反应相同的时间, 、
、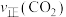 与温度的关系如下图所示,400℃之后
与温度的关系如下图所示,400℃之后 降低,但速率仍然增大可能的原因是
降低,但速率仍然增大可能的原因是___________ 。
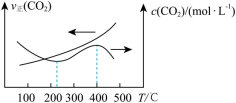
(3)向恒压密闭装置中充入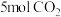 和
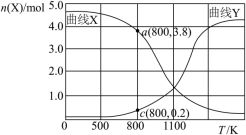
和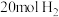 ,不同温度下同时发生反应I和反应Ⅱ,达到平衡时其中两种含碳物质的物质的量
,不同温度下同时发生反应I和反应Ⅱ,达到平衡时其中两种含碳物质的物质的量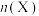 与温度T的关系如图所示。图中缺少
与温度T的关系如图所示。图中缺少___________ (填含碳物质的分子式)的变化曲线,随温度升高该物质的变化趋势为___________ ,800℃时, 的选择性为
的选择性为___________ 。(已知: 的选择性=
的选择性=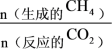 ×100%)
×100%)
(4)在酸性条件下可采用电解法还原 制
制 。阴极的电极反应式:
。阴极的电极反应式:___________ 。
 甲烷化是目前研究的热点方向之一,在环境保护方面显示出较大潜力。其主要反应如下:
甲烷化是目前研究的热点方向之一,在环境保护方面显示出较大潜力。其主要反应如下:反应I:


反应Ⅱ:


回答下列问题:
(1)
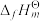 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成 该物质的焓变。反应I的反应热
该物质的焓变。反应I的反应热
| 物质 |  |  |  |  |
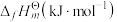 |  | 0 | 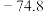 | 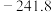 |
 和
和 的混合气体充入密闭容器中,反应相同的时间,
的混合气体充入密闭容器中,反应相同的时间, 、
、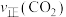 与温度的关系如下图所示,400℃之后
与温度的关系如下图所示,400℃之后 降低,但速率仍然增大可能的原因是
降低,但速率仍然增大可能的原因是
(3)向恒压密闭装置中充入
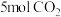 和
和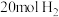 ,不同温度下同时发生反应I和反应Ⅱ,达到平衡时其中两种含碳物质的物质的量
,不同温度下同时发生反应I和反应Ⅱ,达到平衡时其中两种含碳物质的物质的量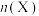 与温度T的关系如图所示。图中缺少
与温度T的关系如图所示。图中缺少 的选择性为
的选择性为 的选择性=
的选择性= ×100%)
×100%)
(4)在酸性条件下可采用电解法还原
 制
制 。阴极的电极反应式:
。阴极的电极反应式:
您最近一年使用:0次
名校
9 . 利用化学原理研究对废气进行脱硝处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。合理应用和处理氮氧化合物,在生产生活中有着重要的意义。
I.
(1)闪电时空气中的 和
和 会发生反应:
会发生反应: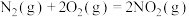
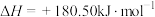 ,
,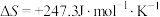 ,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
II.已知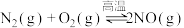 ,该反应在2404℃时的平衡常数
,该反应在2404℃时的平衡常数 。
。
(2)该温度下,向 密闭容器中充入
密闭容器中充入 与
与 各
各 ,平衡时
,平衡时 的转化率是
的转化率是___________ %(保留整数)。
(3)该温度下,某时刻测得容器内 、
、 、
、 的浓度分别为
的浓度分别为 、
、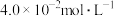 、
、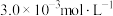 ,此时反应
,此时反应___________ (填“处于化学平衡状态”“正向进行”或“逆向进行”)。请说明理由___________ 。
(4)将 、
、 的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是
的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是___________ 。
A.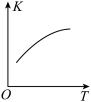 B.
B.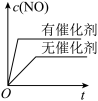 C.
C.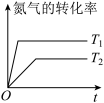
(5)向恒温恒容的密闭容器中充入等物质的量的 与
与 ,达到平衡状态后再向其中充入一定量
,达到平衡状态后再向其中充入一定量 ,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中
,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中 的体积分数
的体积分数___________ (填“变大”“变小”或“不变”)。
I.
(1)闪电时空气中的
 和
和 会发生反应:
会发生反应:
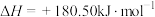 ,
,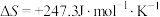 ,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。| A.在1000℃时,此反应能自发进行 |
| B.在1000℃时,此反应不能自发进行 |
| C.该反应能自发进行的最低温度约为730℃ |
D.该反应能自发进行的最高温度约为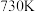 |
II.已知
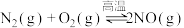 ,该反应在2404℃时的平衡常数
,该反应在2404℃时的平衡常数 。
。(2)该温度下,向
 密闭容器中充入
密闭容器中充入 与
与 各
各 ,平衡时
,平衡时 的转化率是
的转化率是(3)该温度下,某时刻测得容器内
 、
、 、
、 的浓度分别为
的浓度分别为 、
、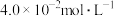 、
、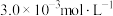 ,此时反应
,此时反应(4)将
 、
、 的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是
的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是A.
 B.
B. C.
C.
(5)向恒温恒容的密闭容器中充入等物质的量的
 与
与 ,达到平衡状态后再向其中充入一定量
,达到平衡状态后再向其中充入一定量 ,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中
,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中 的体积分数
的体积分数
您最近一年使用:0次
2023-04-15更新
|
399次组卷
|
3卷引用:湖北省十堰市部分普通高中2023-2024学年高二上学期11月期中考试化学试题
2022·湖南·高考真题
10 . 钛(Ti)及其合金是理想的高强度、低密度结构材料。以钛渣(主要成分为 ,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
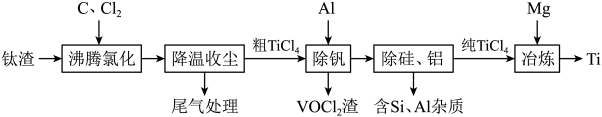
已知“降温收尘”后,粗 中含有的几种物质的沸点:
中含有的几种物质的沸点:
回答下列问题:
(1)已知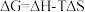 ,
,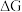 的值只决定于反应体系的始态和终态,忽略
的值只决定于反应体系的始态和终态,忽略 、
、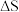 随温度的变化。若
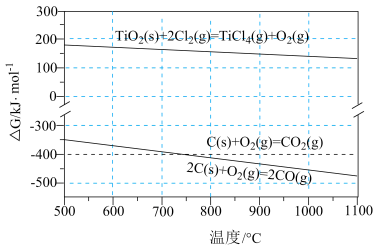
随温度的变化。若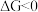 ,则该反应可以自发进行。根据下图判断:
,则该反应可以自发进行。根据下图判断: 时,下列反应不能自发进行的是_______。
时,下列反应不能自发进行的是_______。
(2) 与C、
与C、 ,在
,在 的沸腾炉中充分反应后,混合气体中各组分的分压如下表:
的沸腾炉中充分反应后,混合气体中各组分的分压如下表:
①该温度下, 与C、
与C、 反应的总化学方程式为
反应的总化学方程式为_______ ;
②随着温度升高,尾气中 的含量升高,原因是
的含量升高,原因是_______ 。
(3)“除钒”过程中的化学方程式为_______ ;“除硅、铝”过程中,分离 中含
中含 、
、 杂质的方法是
杂质的方法是_______ 。
(4)“除钒”和“除硅、铝”的顺序_______ (填“能”或“不能”)交换,理由是_______ 。
(5)下列金属冶炼方法与本工艺流程中加入 冶炼
冶炼 的方法相似的是_______。
的方法相似的是_______。
 ,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
已知“降温收尘”后,粗
 中含有的几种物质的沸点:
中含有的几种物质的沸点:| 物质 |  | 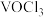 |  | 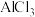 |
沸点/ | 136 | 127 | 57 | 180 |
(1)已知
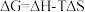 ,
,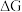 的值只决定于反应体系的始态和终态,忽略
的值只决定于反应体系的始态和终态,忽略 、
、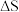 随温度的变化。若
随温度的变化。若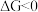 ,则该反应可以自发进行。根据下图判断:
,则该反应可以自发进行。根据下图判断: 时,下列反应不能自发进行的是_______。
时,下列反应不能自发进行的是_______。
A.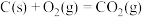 | B. |
C. | D. |
 与C、
与C、 ,在
,在 的沸腾炉中充分反应后,混合气体中各组分的分压如下表:
的沸腾炉中充分反应后,混合气体中各组分的分压如下表:| 物质 |  |  |  |  |
分压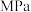 | 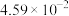 | 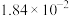 |  |  |
 与C、
与C、 反应的总化学方程式为
反应的总化学方程式为②随着温度升高,尾气中
 的含量升高,原因是
的含量升高,原因是(3)“除钒”过程中的化学方程式为
 中含
中含 、
、 杂质的方法是
杂质的方法是(4)“除钒”和“除硅、铝”的顺序
(5)下列金属冶炼方法与本工艺流程中加入
 冶炼
冶炼 的方法相似的是_______。
的方法相似的是_______。| A.高炉炼铁 | B.电解熔融氯化钠制钠 | C.铝热反应制锰 | D.氧化汞分解制汞 |
您最近一年使用:0次
2022-06-10更新
|
11235次组卷
|
19卷引用:2022年湖北省高考真题变式题16-19
(已下线)2022年湖北省高考真题变式题16-192022年新高考湖南化学高考真题(已下线)2022年湖南卷高考真题变式题(15-19)(已下线)专题14 化学反应原理综合题-2022年高考真题模拟题分项汇编(已下线)专题16 工艺流程题-三年(2020-2022)高考真题分项汇编(已下线)考点24 化学反应的方向-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)2022年海南省高考真题变式题15-19(已下线)易错点08 金属材料-备战2023年高考化学考试易错题(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 大题突破3 无机化工流程题题型研究(已下线)题型38 基于金属元素的工艺流程题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)云南省开远市第一中学校2022-2023学年高二下学期5月月考化学试题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)福建省厦门第一中学2023-2024学年高二上学期期中考试化学试题河南省周口恒大中学2023-2024学年高二上学期12月月考化学试题



