利用化学原理研究对废气进行脱硝处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。合理应用和处理氮氧化合物,在生产生活中有着重要的意义。
I.
(1)闪电时空气中的 和
和 会发生反应:
会发生反应:
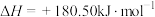 ,
,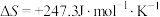 ,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
II.已知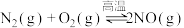 ,该反应在2404℃时的平衡常数
,该反应在2404℃时的平衡常数 。
。
(2)该温度下,向 密闭容器中充入
密闭容器中充入 与
与 各
各 ,平衡时
,平衡时 的转化率是
的转化率是___________ %(保留整数)。
(3)该温度下,某时刻测得容器内 、
、 、
、 的浓度分别为
的浓度分别为 、
、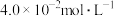 、
、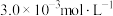 ,此时反应
,此时反应___________ (填“处于化学平衡状态”“正向进行”或“逆向进行”)。请说明理由___________ 。
(4)将 、
、 的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是
的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是___________ 。
A.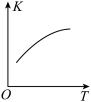 B.
B.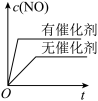 C.
C.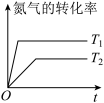
(5)向恒温恒容的密闭容器中充入等物质的量的 与
与 ,达到平衡状态后再向其中充入一定量
,达到平衡状态后再向其中充入一定量 ,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中
,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中 的体积分数
的体积分数___________ (填“变大”“变小”或“不变”)。
I.
(1)闪电时空气中的
 和
和 会发生反应:
会发生反应:
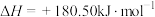 ,
,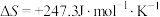 ,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。| A.在1000℃时,此反应能自发进行 |
| B.在1000℃时,此反应不能自发进行 |
| C.该反应能自发进行的最低温度约为730℃ |
D.该反应能自发进行的最高温度约为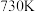 |
II.已知
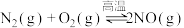 ,该反应在2404℃时的平衡常数
,该反应在2404℃时的平衡常数 。
。(2)该温度下,向
 密闭容器中充入
密闭容器中充入 与
与 各
各 ,平衡时
,平衡时 的转化率是
的转化率是(3)该温度下,某时刻测得容器内
 、
、 、
、 的浓度分别为
的浓度分别为 、
、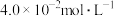 、
、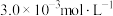 ,此时反应
,此时反应(4)将
 、
、 的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是
的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是A.
 B.
B. C.
C.
(5)向恒温恒容的密闭容器中充入等物质的量的
 与
与 ,达到平衡状态后再向其中充入一定量
,达到平衡状态后再向其中充入一定量 ,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中
,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中 的体积分数
的体积分数
更新时间:2023-04-15 18:12:54
|
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ•mol-1。
CO(g)+H2(g) ΔH=+131.3 kJ•mol-1。
①该反应在常温下____________ 自发进行(填“能”与“不能”);
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是______________ (填字母,下同)。
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.c(CO)=c(H2) d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
①实验1中以v(CO2) 表示的反应速率为________________ 。(取小数二位,下同)
②该反应为_____ (填“吸”或“放”)热反应,实验2条件下平衡常数K=________ 。
③若实验3达平衡时与实验2平衡状态中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是________________________ (用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是
CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是___________ 。
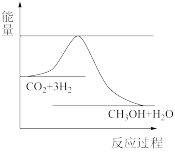
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g)
 CO(g)+H2(g) ΔH=+131.3 kJ•mol-1。
CO(g)+H2(g) ΔH=+131.3 kJ•mol-1。①该反应在常温下
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.c(CO)=c(H2) d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1中以v(CO2) 表示的反应速率为
②该反应为
③若实验3达平衡时与实验2平衡状态中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是
CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】在体积为2L容器中放入2molA和2molB,一定条件下发生反应:aA(s)+bB(g) dD(g)+eE(g)(放热反应),5分钟后达到平衡,平衡时B的转化率为50%,
dD(g)+eE(g)(放热反应),5分钟后达到平衡,平衡时B的转化率为50%,
(1)若从反应开始,甲同学控制恒温恒容,乙同学控制恒温恒压,且b >d+e ,则平衡时B的转化率甲____ 乙(填“大于”、“小于”或“等于”)
(2)若从反应开始,甲同学控制恒温恒容,乙同学控制恒容绝热,则平衡时B的转化率:甲___ 乙。(填“大于”、“小于”或“等于”)
(3)若控制恒温恒容,反应达到平衡后,混合气体的密度比反应未达平衡前_____ (填“增大”、“不变”或“减小”)
 dD(g)+eE(g)(放热反应),5分钟后达到平衡,平衡时B的转化率为50%,
dD(g)+eE(g)(放热反应),5分钟后达到平衡,平衡时B的转化率为50%,(1)若从反应开始,甲同学控制恒温恒容,乙同学控制恒温恒压,且b >d+e ,则平衡时B的转化率甲
(2)若从反应开始,甲同学控制恒温恒容,乙同学控制恒容绝热,则平衡时B的转化率:甲
(3)若控制恒温恒容,反应达到平衡后,混合气体的密度比反应未达平衡前
您最近一年使用:0次
【推荐3】为了有效减少碳排放,我们可利用 制备“合成气”(CO、
制备“合成气”(CO、 )、甲醇、二甲醚等产品,进行资源化应用。
)、甲醇、二甲醚等产品,进行资源化应用。
利用 合成二甲醚有两种工艺。
合成二甲醚有两种工艺。
工艺1:涉及以下主要反应:
Ⅰ.甲醇的合成:
 ;
;
Ⅱ.逆水汽变换:
 ;
;
Ⅲ.甲醇脱水:
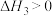 。
。
工艺2:利用 直接加氢合成
直接加氢合成 (反应Ⅳ)。
(反应Ⅳ)。
(1)①写出反应Ⅳ的热化学方程式:________ 。(反应热用上述反应的 表示)。
表示)。
②恒温恒容情况下,下列说法能判断反应Ⅳ达到平衡的是________ (填字母)。
A.气体物质中碳元素与氧元素的质量比不变
B.容器内压强不变
C.容器内气体密度不变
D.容器内 浓度保持不变
浓度保持不变
(2)工艺1需先合成甲醇。在不同压强下,按照 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系分别如下图所示。
的平衡产率随温度的变化关系分别如下图所示。________ 。
A.图甲纵坐标表示 的平衡产率
的平衡产率
B.
C.为了同时提高 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压条件
的平衡产率,应选择低温、高压条件
D.一定温度、压强下,提高 的平衡转化率的主要方向是寻找活性更高的催化剂
的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是________ 。
(3)对于反应
 ,反应速率
,反应速率 ,其中
,其中 、
、 分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
①降低温度,
________ (填“增大”“减小”或“不变”)。
②在TK、101kPa下,按照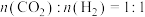 投料,
投料, 转化率为50%时,
转化率为50%时, ,用气体分压表示的平衡常数
,用气体分压表示的平衡常数
________ (保留小数点后一位)。
(4)将 通入一定浓度的
通入一定浓度的 溶液至饱和,通电后在电极上反应生成
溶液至饱和,通电后在电极上反应生成 ,原理如图所示(阴、阳极区溶液均为
,原理如图所示(阴、阳极区溶液均为 溶液)。生成尿素的电极反应式为
溶液)。生成尿素的电极反应式为________ 。
 制备“合成气”(CO、
制备“合成气”(CO、 )、甲醇、二甲醚等产品,进行资源化应用。
)、甲醇、二甲醚等产品,进行资源化应用。利用
 合成二甲醚有两种工艺。
合成二甲醚有两种工艺。工艺1:涉及以下主要反应:
Ⅰ.甲醇的合成:

 ;
;Ⅱ.逆水汽变换:

 ;
;Ⅲ.甲醇脱水:

 。
。工艺2:利用
 直接加氢合成
直接加氢合成 (反应Ⅳ)。
(反应Ⅳ)。(1)①写出反应Ⅳ的热化学方程式:
 表示)。
表示)。②恒温恒容情况下,下列说法能判断反应Ⅳ达到平衡的是
A.气体物质中碳元素与氧元素的质量比不变
B.容器内压强不变
C.容器内气体密度不变
D.容器内
 浓度保持不变
浓度保持不变(2)工艺1需先合成甲醇。在不同压强下,按照
 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系分别如下图所示。
的平衡产率随温度的变化关系分别如下图所示。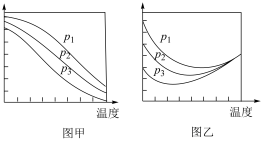
A.图甲纵坐标表示
 的平衡产率
的平衡产率B.
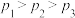
C.为了同时提高
 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压条件
的平衡产率,应选择低温、高压条件D.一定温度、压强下,提高
 的平衡转化率的主要方向是寻找活性更高的催化剂
的平衡转化率的主要方向是寻找活性更高的催化剂②图乙中,某温度时,三条曲线几乎交于一点的原因是
(3)对于反应

 ,反应速率
,反应速率 ,其中
,其中 、
、 分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。①降低温度,

②在TK、101kPa下,按照
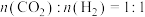 投料,
投料, 转化率为50%时,
转化率为50%时, ,用气体分压表示的平衡常数
,用气体分压表示的平衡常数
(4)将
 通入一定浓度的
通入一定浓度的 溶液至饱和,通电后在电极上反应生成
溶液至饱和,通电后在电极上反应生成 ,原理如图所示(阴、阳极区溶液均为
,原理如图所示(阴、阳极区溶液均为 溶液)。生成尿素的电极反应式为
溶液)。生成尿素的电极反应式为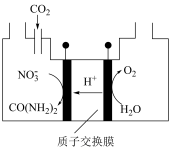
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
xA(g)+2B(s) yC(g) ΔH<0
yC(g) ΔH<0
在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)根据图示可确定x∶y=________ 。
(2)0~10 min容器内压强________ (填“变大”、“不变”或“变小”)。
(3)推测第10 min引起曲线变化的反应条件可能是________ ;第16 min引起曲线变化的反应条件可能是________ 。
①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(4)写出反应的平衡常数表达式________ ,平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________ K2(填“>”、“=”或“<”)。
xA(g)+2B(s)
 yC(g) ΔH<0
yC(g) ΔH<0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)根据图示可确定x∶y=
(2)0~10 min容器内压强
(3)推测第10 min引起曲线变化的反应条件可能是
①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(4)写出反应的平衡常数表达式
您最近一年使用:0次
填空题
|
较难
(0.4)
真题
【推荐2】铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
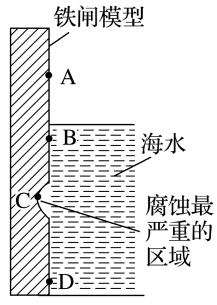
①该电化腐蚀称为__________________ 。
②图中A、B、C、D四个区域,生成铁锈最多的是_________ (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
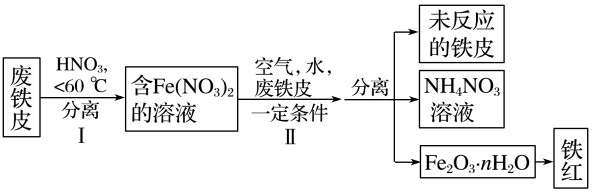
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为____________________ 。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为________________________ 。
③上述生产流程中,能体现“绿色化学”思想的是____________________ (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)=_____________ 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x=___________________ 。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。

①该电化腐蚀称为
②图中A、B、C、D四个区域,生成铁锈最多的是
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为
③上述生产流程中,能体现“绿色化学”思想的是
(3)已知t℃时,反应FeO(s)+CO(g)
 Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。①t℃时,反应达到平衡时n(CO):n(CO2)=
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x=
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g) Fe(s)+CO2(g) △H>0
Fe(s)+CO2(g) △H>0
试回答下列问题:
⑴铁在元素周期表中位于_________ 周期______ 族。
⑵写出该反应的平衡常数表达式:____ ,升高温度,该反应的平衡常数K值将__________ (填“增大”、“减小”或“不变”,下同),平衡体系中固体的质量将______ 。
⑶为减少高炉冶铁时,含有CO的尾气排放,下列研究方向不可取的是___________ 。
⑷1100℃时, FeO(s)+CO(g) Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2g的FeO,同时通入4.48L的CO气体(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为
Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2g的FeO,同时通入4.48L的CO气体(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为_____ 。(精确到0.1%)
 Fe(s)+CO2(g) △H>0
Fe(s)+CO2(g) △H>0试回答下列问题:
⑴铁在元素周期表中位于
⑵写出该反应的平衡常数表达式:
⑶为减少高炉冶铁时,含有CO的尾气排放,下列研究方向不可取的是
| A.其它条件不变,增加高炉的高度 | B.调节还原时的炉温 |
| C.增加原料中焦炭与赤铁矿的比例 | D.将生成的铁水及时移出 |
⑷1100℃时, FeO(s)+CO(g)
 Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2g的FeO,同时通入4.48L的CO气体(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为
Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2g的FeO,同时通入4.48L的CO气体(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】已知:CO(g)+H2O(g) CO2(g)+H2(g) △H= -42kJ·mol-1
CO2(g)+H2(g) △H= -42kJ·mol-1
(1)在一定温度下,向一定体积的密闭容器中通入1molCO、2molH2O(g),反应达平衡时,测得放出的热量为28kJ,求CO的转化率为____________________ ;
(2)该温度下,向该密闭容器中通入 molCO2、
molCO2、 molH2,欲使反应达平衡时CO的转化率与(1)相同,则还需满足的条件是
molH2,欲使反应达平衡时CO的转化率与(1)相同,则还需满足的条件是________________________________ ;
(3)该温度下,向该密闭容器中通入2molCO、3molH2O(g),反应达平衡时时,求H2O(g)的转化率______________________________ ;
(4)该温度下,向该密闭容器中通入1.5molCO、3molH2O(g),反应达平衡时,放出的热量为_________________ kJ。
 CO2(g)+H2(g) △H= -42kJ·mol-1
CO2(g)+H2(g) △H= -42kJ·mol-1(1)在一定温度下,向一定体积的密闭容器中通入1molCO、2molH2O(g),反应达平衡时,测得放出的热量为28kJ,求CO的转化率为
(2)该温度下,向该密闭容器中通入
 molCO2、
molCO2、 molH2,欲使反应达平衡时CO的转化率与(1)相同,则还需满足的条件是
molH2,欲使反应达平衡时CO的转化率与(1)相同,则还需满足的条件是(3)该温度下,向该密闭容器中通入2molCO、3molH2O(g),反应达平衡时时,求H2O(g)的转化率
(4)该温度下,向该密闭容器中通入1.5molCO、3molH2O(g),反应达平衡时,放出的热量为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】煤和天然气都是重要的化石资源,在工业生产中用途广泛。
(1)燃煤时往往在煤中添加石灰石,目的是_______ ,达到该目的时发生反应的化学方程式为____________ 。
(2)煤的综合利用包括________ (将煤隔绝空气加强热)、煤的气化和液化。煤的气化是将其转化为可燃性气体的过程,主要发生的反应的化学方程式为_________ 。
(3)CO是煤气的主要成分,可与水蒸气反应生成氢气:CO(g)+ H2O(g)⇌CO2(g)+H2(g)△H。 查阅资料得出相关数据如下:
①该反应升高到一定温度时,反应将不能正向进行,由此判断该反应的△S_____ (填“>”或“<”")0。
②在容积为10 L的密闭容器中通入0.1 mol CO(g)和0.1 mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为_____ 。
(4)将2 mol CH4和4 mol H2O(g)通入容积为10 L的恒容密闭容器中,发生反应:CH4(g)+ H2O(g)⇌CO(g)+ 3H2(g)。CH4的平衡转化率与温度、压强的变化关系如图所示。
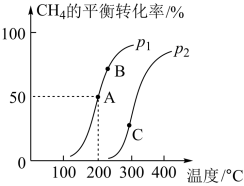
①200 °C时,该反应的平衡常数K=__________ 。
②A、B、C三点的平衡常数KA、KB、KC的大小关系是_________ 。
③压强:p1___________ (填“>”“<”或“=”)p2。
(1)燃煤时往往在煤中添加石灰石,目的是
(2)煤的综合利用包括
(3)CO是煤气的主要成分,可与水蒸气反应生成氢气:CO(g)+ H2O(g)⇌CO2(g)+H2(g)△H。 查阅资料得出相关数据如下:
| 温度/°C | 400 | 500 |
| 平衡常数K | 9 | 5.3 |
①该反应升高到一定温度时,反应将不能正向进行,由此判断该反应的△S
②在容积为10 L的密闭容器中通入0.1 mol CO(g)和0.1 mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为
(4)将2 mol CH4和4 mol H2O(g)通入容积为10 L的恒容密闭容器中,发生反应:CH4(g)+ H2O(g)⇌CO(g)+ 3H2(g)。CH4的平衡转化率与温度、压强的变化关系如图所示。

①200 °C时,该反应的平衡常数K=
②A、B、C三点的平衡常数KA、KB、KC的大小关系是
③压强:p1
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】Ⅰ、铁能形成多种价态的化合物,单质铁能被众多的氧化剂所氧化。
(1)将5.6g的生铁与足量的稀盐酸反应,生成H2的质量______ 0.2g(填“>”“<”“=”),向此生铁上滴加几滴稀硝酸,写出反应的离子方程式:___________________________ 。
(2)配制FeCl3溶液时常会出现浑浊现象,其原因是______________________ (用离子方程式表示)。室温下配制5mol/L 200mL FeCl3溶液,至少需要添加_______ mL 2mol/L的盐酸才会不出现浑浊(已知室温时Ksp[Fe(OH)3]=4.0×10-38,忽略加入盐酸对溶液体积的影响)。
(3)钢铁制品易生锈,导致其生锈的最主要原因是发生了________ 腐蚀;用NaOH、NaNO2等溶液对铁制品进行钝化处理可提高其抗腐蚀能力,下面是处理过程中所发生的一个反应:____ Na2FeO2+_____NaNO2+_____H2O===_____Na2Fe2O4+_____NH3↑+_____,请完善该反应方程式。
II、硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为
(1)下列说法中可以说明该反应已达到平衡状态的是_________ 。
a. 体系内混合气体的密度保持不变 b.
c. 容器内气体的总压强保持不变 d. NO体积分数不再改变
(2)某温度下,NO2(g)+SO2(g) SO3(g)+NO(g)的平衡常数k=2.25,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如下表所示。
SO3(g)+NO(g)的平衡常数k=2.25,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如下表所示。
①10min后,甲中达到平衡,则甲中反应的平均速率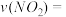
___________ 。
②丙达到平衡所用的时间_________ (填“<”“>”“=”)10min,达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为_________ 。
(1)将5.6g的生铁与足量的稀盐酸反应,生成H2的质量
(2)配制FeCl3溶液时常会出现浑浊现象,其原因是
(3)钢铁制品易生锈,导致其生锈的最主要原因是发生了
II、硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为
NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1
(1)下列说法中可以说明该反应已达到平衡状态的是
a. 体系内混合气体的密度保持不变 b.

c. 容器内气体的总压强保持不变 d. NO体积分数不再改变
(2)某温度下,NO2(g)+SO2(g)
 SO3(g)+NO(g)的平衡常数k=2.25,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如下表所示。
SO3(g)+NO(g)的平衡常数k=2.25,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如下表所示。起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol/L | 0.10 | 0.20 | 0.20 |
c(SO2)/mol/L | 0.10 | 0.10 | 0.20 |
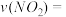
②丙达到平衡所用的时间
您最近一年使用:0次
【推荐1】苯乙烯是生产塑料和合成橡胶的重要有机原料,国内外目前主要采用多种方案用乙苯制取苯乙烯。相关反应及数据如下表所示:
(1)直接催化脱氢法制苯乙烯:将一定量乙苯气体充入密闭容器中,发生反应1。
①控制反应温度为 ,恒容时,下列能判断反应达到化学平衡状态的是
,恒容时,下列能判断反应达到化学平衡状态的是_______ 。
A.气体的压强不变 B. 不变
不变
C.气体密度不变 D.气体的平均相对分子质量不变
②反应Ⅰ在一定条件下能自发反应的原因是_______ 。
③研究表明,在恒压条件下,该反应存在乙苯平衡转化率较低、催化剂表面积碳等问题。若乙苯蒸气中掺混水蒸气,控制反应温度 ,能够有效解决这些问题。掺入水蒸气的作用是
,能够有效解决这些问题。掺入水蒸气的作用是_______ 。
(2) 氧化脱水法制苯乙烯:工业上将一定量乙苯和
氧化脱水法制苯乙烯:工业上将一定量乙苯和 充入恒容密闭容器中,发生反应3,控制反应温度为
充入恒容密闭容器中,发生反应3,控制反应温度为 。
。
①结合反应1和反应4,说明 氧化脱水法中氧气参与反应的优点有:反应4可为反应1提供所需的能量和
氧化脱水法中氧气参与反应的优点有:反应4可为反应1提供所需的能量和___________ (结合相关数据 及必要的文字说明)。
②已知焓变数值越大,平衡常数 受温度影响越大。反应1的
受温度影响越大。反应1的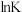 随
随 (温度的倒数)的变化如图所示。请在图中画出反应4的
(温度的倒数)的变化如图所示。请在图中画出反应4的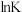 随
随 的变化图
的变化图________ 。

(3)反应4: 设
设 的平衡分压为
的平衡分压为 ,
, 的平衡转化率为
的平衡转化率为 ,用含
,用含 和
和 的代数式表示上述反应的
的代数式表示上述反应的
___________ (用平衡分压代替平衡浓度计算)。
| 反应方程式 | 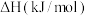 | 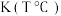 | |
| 反应1:直接催化脱氢法 |  |  | 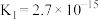 |
反应2: 氧化脱氢法 氧化脱氢法 |  |  |  |
反应3: 氧化脱水法 氧化脱水法 |  |  |  |
| 反应4 |  |  | 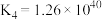 |
(1)直接催化脱氢法制苯乙烯:将一定量乙苯气体充入密闭容器中,发生反应1。
①控制反应温度为
 ,恒容时,下列能判断反应达到化学平衡状态的是
,恒容时,下列能判断反应达到化学平衡状态的是A.气体的压强不变 B.
 不变
不变C.气体密度不变 D.气体的平均相对分子质量不变
②反应Ⅰ在一定条件下能自发反应的原因是
③研究表明,在恒压条件下,该反应存在乙苯平衡转化率较低、催化剂表面积碳等问题。若乙苯蒸气中掺混水蒸气,控制反应温度
 ,能够有效解决这些问题。掺入水蒸气的作用是
,能够有效解决这些问题。掺入水蒸气的作用是(2)
 氧化脱水法制苯乙烯:工业上将一定量乙苯和
氧化脱水法制苯乙烯:工业上将一定量乙苯和 充入恒容密闭容器中,发生反应3,控制反应温度为
充入恒容密闭容器中,发生反应3,控制反应温度为 。
。①结合反应1和反应4,说明
 氧化脱水法中氧气参与反应的优点有:反应4可为反应1提供所需的能量和
氧化脱水法中氧气参与反应的优点有:反应4可为反应1提供所需的能量和②已知焓变数值越大,平衡常数
 受温度影响越大。反应1的
受温度影响越大。反应1的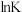 随
随 (温度的倒数)的变化如图所示。请在图中画出反应4的
(温度的倒数)的变化如图所示。请在图中画出反应4的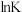 随
随 的变化图
的变化图
(3)反应4:
 设
设 的平衡分压为
的平衡分压为 ,
, 的平衡转化率为
的平衡转化率为 ,用含
,用含 和
和 的代数式表示上述反应的
的代数式表示上述反应的
您最近一年使用:0次
【推荐2】氮氧化物的有效去除和资源的充分利用是当今社会的重要研究课题。
(1)已知:4NH3(g)+5O2(g)=4NO(g) +6H2O(g) ΔH1 = -907.0 kJ•mol-1
4NH3(g) +3O2(g)=2N2(g)+6H2O(g) ΔH2= -1269.0 kJ•mol-1
若4NH3(g) +6NO(g) 5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为
5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为_______ kJ•mol-1 (用含E逆的代数式表示)。
(2)已知:①2NO(g)+2ICl(g) 2NOCl (g)+I2(g)
2NOCl (g)+I2(g)
②2NOCl(g) 2NO(g)+Cl2(g)
2NO(g)+Cl2(g)
③I2(g)+Cl2(g) 2ICl(g)
2ICl(g)
若向VL恒容密闭容器中加 2mol NO和 2mol ICl发生上述反应,达到平衡时,容器中 NOCl (g)为amol,Cl2(g)为b mol,此时 I2(g)的浓度为_______ mol•L-1(用含 a、b、V 的代数式表示,下同),反应③的平衡常数为_______ 。
(3)某化工厂排出的尾气(含 CO、N2O)治理的方法为在密闭容器中发生如下反应:CO(g)+N2O(g) CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:
CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:_______ 。
(4)已知4CO(g) +2NO2(g) 4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在_______ (填“高温”、“低温”或“任何温度”)下能自发进行,为探究温度及不同催化剂对该反应的影响,保持其它初始条件不变重复实验,在相同时间内测得 N2产率与温度的关系如图所示。在催化剂乙作用下,图中 M 点对应的速率(对应温度400℃)v正_______ (填“>”、“<” 或“=”) v逆,温度高于400℃,N2产率降低的原因可能是_______ 。
(1)已知:4NH3(g)+5O2(g)=4NO(g) +6H2O(g) ΔH1 = -907.0 kJ•mol-1
4NH3(g) +3O2(g)=2N2(g)+6H2O(g) ΔH2= -1269.0 kJ•mol-1
若4NH3(g) +6NO(g)
 5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为
5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为(2)已知:①2NO(g)+2ICl(g)
 2NOCl (g)+I2(g)
2NOCl (g)+I2(g) ②2NOCl(g)
 2NO(g)+Cl2(g)
2NO(g)+Cl2(g)③I2(g)+Cl2(g)
 2ICl(g)
2ICl(g)若向VL恒容密闭容器中加 2mol NO和 2mol ICl发生上述反应,达到平衡时,容器中 NOCl (g)为amol,Cl2(g)为b mol,此时 I2(g)的浓度为
(3)某化工厂排出的尾气(含 CO、N2O)治理的方法为在密闭容器中发生如下反应:CO(g)+N2O(g)
 CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:
CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:
(4)已知4CO(g) +2NO2(g)
 4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】高炉炼铁是重要的工业过程,冶炼过程中涉及如下反应:
i.
 (
( )
)
ii.
 (
( )
)
气体常数R等于8.314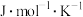 ;相关的热力学数据(298K)列入下表:
;相关的热力学数据(298K)列入下表:
(1)假设上述反应体系在密闭条件下达平衡时总压为1200kPa,计算各气体的分压__________ 。
(2)计算 =
=__________ 。
(3)计算 的标准熵上
的标准熵上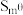 (单位:
(单位: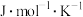 )
)__________ 。(设反应的焓变和熵变不随温度变化)
(4)反应体系中,若CO(g)和 均保持标态,判断此条件下反应的自发性(填写对应的字母):
均保持标态,判断此条件下反应的自发性(填写对应的字母):
①反应(1)A自发B不自发C达平衡__________
②反应(2)A自发B不自发C达平衡__________
(5)若升高温度,指出反应平衡常数如何变化填写对应的字母)。计算反应焓变,给出原因。
①反应(1)A增大B不变化C减小__________
② 反应(2)A增大B不变化C减小__________
i.

 (
( )
)ii.

 (
( )
)气体常数R等于8.314
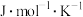 ;相关的热力学数据(298K)列入下表:
;相关的热力学数据(298K)列入下表: | FeO(s) | Fe(s) | C(s)石墨 | CO(g) |  | |
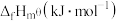 | 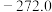 | - | - | 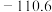 |  |
 | 60.75 | 27.3 | 5.74 | / | x |
(1)假设上述反应体系在密闭条件下达平衡时总压为1200kPa,计算各气体的分压
(2)计算
 =
=(3)计算
 的标准熵上
的标准熵上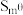 (单位:
(单位: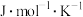 )
)(4)反应体系中,若CO(g)和
 均保持标态,判断此条件下反应的自发性(填写对应的字母):
均保持标态,判断此条件下反应的自发性(填写对应的字母):①反应(1)A自发B不自发C达平衡
②反应(2)A自发B不自发C达平衡
(5)若升高温度,指出反应平衡常数如何变化填写对应的字母)。计算反应焓变,给出原因。
①反应(1)A增大B不变化C减小
② 反应(2)A增大B不变化C减小
您最近一年使用:0次



