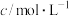名校
解题方法
1 . 实验小组探究 溶液与
溶液与 溶液的反应:
溶液的反应:
【资料】① 是强电解质,具有强氧化性。
是强电解质,具有强氧化性。 易被还原为
易被还原为 ;
;
② 可与
可与 发生反应:
发生反应:
③在溶液中 淀粉复合物必须有足够的浓度才能显示明显的蓝色
淀粉复合物必须有足够的浓度才能显示明显的蓝色
Ⅰ.实验小组设计了下列实验验证了 溶液与
溶液与 溶液的反应:
溶液的反应:
(1)实验1-1的目的是_______ 。
(2)请用离子方程式表示实验1-2中的化学反应_______ 。
Ⅱ.实验小组发现, 溶液中若含有
溶液中若含有 ,溶液并不会立刻变蓝,而会等待一段时间后再变蓝。为了解释这一现象,甲同学对此提出两种猜想:
,溶液并不会立刻变蓝,而会等待一段时间后再变蓝。为了解释这一现象,甲同学对此提出两种猜想:
猜想1:其他条件相同时, 与
与 反应速率_______
反应速率_______ 与
与 的反应速率,使溶液中
的反应速率,使溶液中 浓度降低,化学反应速率变慢。(填“
浓度降低,化学反应速率变慢。(填“ ”或“
”或“ ”)
”)
猜想2:其他条件相同时, 与
与 不反应。
不反应。 与
与 反应速率_______
反应速率_______ 与
与 的反应速率(填“
的反应速率(填“ ”或“
”或“ ”)。
”)。
(3)请补全猜想1:_______ 与猜想2:_______ 。
(4)根据资料2可知 的还原性
的还原性_______ (填“强于”或“弱于”) ,甲同学认为,该事实可以用来作为
,甲同学认为,该事实可以用来作为_______ (填“猜想1”或“猜想2”)的依据。
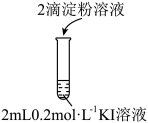
Ⅲ.为了进一步研究 的作用,小组同学分别向两支试管中依次加入下列试剂,并记录变他时间,如下表所示。
的作用,小组同学分别向两支试管中依次加入下列试剂,并记录变他时间,如下表所示。
(5)请补全表格中①_______ 与②_______
(6)乙同学根据现有数据证明Ⅱ中猜想1不成立,理由是_______ 。
Ⅳ.查阅文献表明Ⅱ中猜想2成立:
(7)下列说法正确的是_______(填字母)。
(8)结合实验2-2的数据,计算 内的
内的 消耗的速率
消耗的速率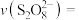
_______ 
 溶液与
溶液与 溶液的反应:
溶液的反应:【资料】①
 是强电解质,具有强氧化性。
是强电解质,具有强氧化性。 易被还原为
易被还原为 ;
;②
 可与
可与 发生反应:
发生反应:
③在溶液中
 淀粉复合物必须有足够的浓度才能显示明显的蓝色
淀粉复合物必须有足够的浓度才能显示明显的蓝色Ⅰ.实验小组设计了下列实验验证了
 溶液与
溶液与 溶液的反应:
溶液的反应:编号 | 1-1 | 1-2 |
实验操作 |
|
|
现象 | 无明显现象 | 溶液立即变蓝 |
(2)请用离子方程式表示实验1-2中的化学反应
Ⅱ.实验小组发现,
 溶液中若含有
溶液中若含有 ,溶液并不会立刻变蓝,而会等待一段时间后再变蓝。为了解释这一现象,甲同学对此提出两种猜想:
,溶液并不会立刻变蓝,而会等待一段时间后再变蓝。为了解释这一现象,甲同学对此提出两种猜想:猜想1:其他条件相同时,
 与
与 反应速率_______
反应速率_______ 与
与 的反应速率,使溶液中
的反应速率,使溶液中 浓度降低,化学反应速率变慢。(填“
浓度降低,化学反应速率变慢。(填“ ”或“
”或“ ”)
”)猜想2:其他条件相同时,
 与
与 不反应。
不反应。 与
与 反应速率_______
反应速率_______ 与
与 的反应速率(填“
的反应速率(填“ ”或“
”或“ ”)。
”)。(3)请补全猜想1:
(4)根据资料2可知
 的还原性
的还原性 ,甲同学认为,该事实可以用来作为
,甲同学认为,该事实可以用来作为Ⅲ.为了进一步研究
 的作用,小组同学分别向两支试管中依次加入下列试剂,并记录变他时间,如下表所示。
的作用,小组同学分别向两支试管中依次加入下列试剂,并记录变他时间,如下表所示。编号 |
|
| 淀粉 溶液 |
| ① | 变色时间 |
2-1 |
|
| 2滴 |
| ② | 立即 |
2-2 |
|
| 2滴 |
|
|
|
(6)乙同学根据现有数据证明Ⅱ中猜想1不成立,理由是
Ⅳ.查阅文献表明Ⅱ中猜想2成立:
(7)下列说法正确的是_______(填字母)。
A.增加溶液中 浓度, 浓度, 的初始反应速率会增加 的初始反应速率会增加 |
B.增加溶液中 浓度,溶液变蓝时间可能增加 浓度,溶液变蓝时间可能增加 |
C.增加溶液中 浓度,溶液可能无法变蓝 浓度,溶液可能无法变蓝 |
| D.升高溶液温度,溶液开始变蓝时间可能增加 |
 内的
内的 消耗的速率
消耗的速率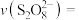

您最近一年使用:0次
2 . 请回答下列问题
(1)800℃时,在体积固定为2L的密闭容器中存在反应: ,
, 随时间的变化如下表:
随时间的变化如下表:
①如图中A点处,v(正)________ v(逆)(填“大于”、“小于”或“等于”)。
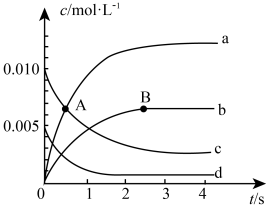
②图中表示 的变化的曲线是
的变化的曲线是________ ,用 表示从0~2s内该反应的平均速率
表示从0~2s内该反应的平均速率
________ 。
③下列不能使该反应的反应速率增大的是________ 。
a.及时分离出 气体 b.适当升高温度
气体 b.适当升高温度
c.增大 的浓度 d.选择高效的催化剂
的浓度 d.选择高效的催化剂
(2)某研究性学习小组利用 溶液和酸性
溶液和酸性 溶液之间的反应
溶液之间的反应
 来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
①通过实验A、B,可探究出浓度的改变对反应速率的影响,其中
________ ,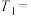
________ ;通过实验________ (实验序号)可探究出温度变化对化学反应速率的影响。
②C组实验中溶液褪色时间t________ (填“>”或“<”)8s,C组实验的反应速率
________ 。(用含有t的式子表示)
③同学们在实验中发现反应速率总是如图所示,其中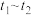 时间内速率变快的主要原因可能是:①产物
时间内速率变快的主要原因可能是:①产物 (或
(或 )是反应的催化剂;②
)是反应的催化剂;②________ 。

(1)800℃时,在体积固定为2L的密闭容器中存在反应:
 ,
, 随时间的变化如下表:
随时间的变化如下表:时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

②图中表示
 的变化的曲线是
的变化的曲线是 表示从0~2s内该反应的平均速率
表示从0~2s内该反应的平均速率
③下列不能使该反应的反应速率增大的是
a.及时分离出
 气体 b.适当升高温度
气体 b.适当升高温度c.增大
 的浓度 d.选择高效的催化剂
的浓度 d.选择高效的催化剂(2)某研究性学习小组利用
 溶液和酸性
溶液和酸性 溶液之间的反应
溶液之间的反应
 来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)实验序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
|
|
| |||||
V/mL |
| V/mL |
| V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
B |
| 2 | 0.02 | 3 | 0.1 |
| 8 |
C | 313 | 2 | 0.02 |
| 0.1 | 1 | t |

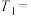
②C组实验中溶液褪色时间t

③同学们在实验中发现反应速率总是如图所示,其中
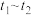 时间内速率变快的主要原因可能是:①产物
时间内速率变快的主要原因可能是:①产物 (或
(或 )是反应的催化剂;②
)是反应的催化剂;②
您最近一年使用:0次
名校
解题方法
3 . 下列方案设计能达到实验目的的是
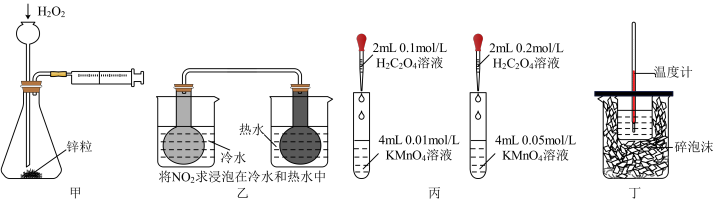

| A.甲装置可以定量测定化学反应速率 |
| B.乙装置可以由球中气体颜色的深浅判断温度对平衡的影响 |
| C.丙装置由褪色快慢研究反应物浓度对反应速率的影响 |
| D.丁装置可以准确测定中和热 |
您最近一年使用:0次
2021-10-02更新
|
1394次组卷
|
17卷引用:四川省成都石室中学2021-2022学年高二上学期9月测试化学试题
四川省成都石室中学2021-2022学年高二上学期9月测试化学试题甘肃省天水市田家炳中学2021-2022学年高二上学期高二第一阶段考试化学试题吉林省长春市十一高中2021-2022学年高二上学期第一学程考试化学试题吉林省长春市第二十中学2021-2022学年高二上学期第一次质量检测化学试题陕西省西安市第三中学2022-2023学年高二上学期10月月测评化学试题四川省内江市第二中学2023-2024学年高二上学期第一次月考化学试题广东省广州市第八十九中学2023-2024学年高二上学期10月月考化学试题山东省济南市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)必考点02 化学反应速率-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)广东省珠海市第一中学2021-2022学年高二上学期期中考试化学试题四川省遂宁中学校2021-2022学年高二下学期开学考试化学试题四川省成都市郫都区2021-2022学年高二上学期期中考试化学试题天津市五校(杨村宝坻蓟州芦台静海一中)2022-2023学年高二上学期期中考试化学试题四川省成都市简阳市阳安中学2022-2023学年高二上学期期中考试化学试题广东省广州市从化区从化中学2022-2023学年高二上学期期中考试化学试题青海省海南藏族自治州高级中学2022-2023学年高二下学期期末考试化学试题广东省广州市第七中学2023-2024学年高二上学期11月期中化学试题
20-21高二·浙江·阶段练习
名校
4 . 化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
I.测定化学反应速率,该同学利用如图装置测定化学反应速率。

(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是_______ ;
(2)该反应有黄色固体生成,并且伴有刺激性,能使品红溶液褪色的气体生成。请写出该反应的离子方程式:____ 。
(3)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是__ 。
II.为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知2Na2S2O3+I2=Na2S4O6+2NaI,其中Na2S2O3溶液均足量)
表中Vx=_______ mL,比较t1、t2、t3大小,试推测该实验结论:_______
III.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,离子方程式:2 +5
+5 +H+=2Mn2++5
+H+=2Mn2++5 +3H2O;回答下列问题:
+3H2O;回答下列问题:
(1)用KMnO4进行滴定时,判断滴定终点的现象是_______ 。
(2)下列操作会导致测定结果偏低的是_______ 。
A. 酸式滴定管水洗后未用待测液润洗
B. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定管尖嘴部分有气泡,滴定后消失
D. 观察读数时,滴定前仰视,滴定后俯视
(3)根据下表中测定的实验数据,计算NaHSO3溶液的物质的量浓度(写出计算过程,结果保留4位有效数字)_________ 。
I.测定化学反应速率,该同学利用如图装置测定化学反应速率。

(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是
(2)该反应有黄色固体生成,并且伴有刺激性,能使品红溶液褪色的气体生成。请写出该反应的离子方程式:
(3)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是
II.为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知2Na2S2O3+I2=Na2S4O6+2NaI,其中Na2S2O3溶液均足量)
| 实验 序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
III.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,离子方程式:2
 +5
+5 +H+=2Mn2++5
+H+=2Mn2++5 +3H2O;回答下列问题:
+3H2O;回答下列问题:(1)用KMnO4进行滴定时,判断滴定终点的现象是
(2)下列操作会导致测定结果偏低的是
A. 酸式滴定管水洗后未用待测液润洗
B. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定管尖嘴部分有气泡,滴定后消失
D. 观察读数时,滴定前仰视,滴定后俯视
(3)根据下表中测定的实验数据,计算NaHSO3溶液的物质的量浓度(写出计算过程,结果保留4位有效数字)
| 实验编号 | 待测NaHSO3溶液的体积/mL | KMnO4溶液的体积/mL |
| 1 | 20.00 | 15.98 |
| 2 | 20.00 | 17.00 |
| 3 | 20.00 | 16.02 |
您最近一年使用:0次