名校
解题方法
1 . 一定条件下, 与
与 反应可得到
反应可得到 、
、 及少量副产物
及少量副产物 的混合气体,图是用
的混合气体,图是用 与
与 制备
制备 和
和 的反应历程,关于该过程的说法中错误的是
的反应历程,关于该过程的说法中错误的是

已知: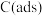 表示吸附性活性炭,TS表示反应中的过渡态
表示吸附性活性炭,TS表示反应中的过渡态
 与
与 反应可得到
反应可得到 、
、 及少量副产物
及少量副产物 的混合气体,图是用
的混合气体,图是用 与
与 制备
制备 和
和 的反应历程,关于该过程的说法中错误的是
的反应历程,关于该过程的说法中错误的是 
已知:
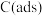 表示吸附性活性炭,TS表示反应中的过渡态
表示吸附性活性炭,TS表示反应中的过渡态A.反应②为 ⇌ ⇌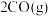 ,与TS2相比,TS1更稳定 ,与TS2相比,TS1更稳定 |
B.反应②活化能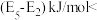 反应①活化能 反应①活化能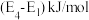 ,总反应的活化能为 ,总反应的活化能为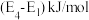 |
| C.若加入固体X能提高CO的选择性,则X为CH4与CO2转化为CO的催化剂 |
| D.反应①决定总反应的快慢,增大CO2浓度能明显增大总反应的速率 |
您最近一年使用:0次
名校
解题方法
2 . 已知 、
、 和
和 (
( 的作用是活化催化剂)按照一定体积比在催化剂表面可合成甲醇:
的作用是活化催化剂)按照一定体积比在催化剂表面可合成甲醇: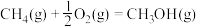
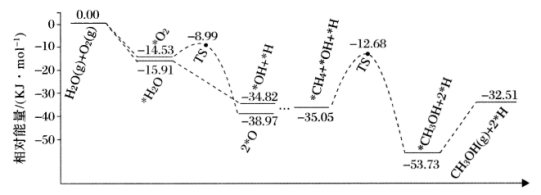
 ,反应的部分历程如下图所示(吸附在催化剂表面的物种用“*”标注,
,反应的部分历程如下图所示(吸附在催化剂表面的物种用“*”标注, 代表过渡态)。下列说法正确的是
代表过渡态)。下列说法正确的是
 、
、 和
和 (
( 的作用是活化催化剂)按照一定体积比在催化剂表面可合成甲醇:
的作用是活化催化剂)按照一定体积比在催化剂表面可合成甲醇: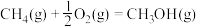
 ,反应的部分历程如下图所示(吸附在催化剂表面的物种用“*”标注,
,反应的部分历程如下图所示(吸附在催化剂表面的物种用“*”标注, 代表过渡态)。下列说法正确的是
代表过渡态)。下列说法正确的是
A.该反应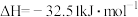 |
B. 比 比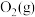 更容易吸附在催化剂表面 更容易吸附在催化剂表面 |
C.该反应过程中只涉及到 键的断裂与形成 键的断裂与形成 |
D.图示中慢反应的方程式为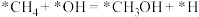 |
您最近一年使用:0次
2021-10-13更新
|
353次组卷
|
3卷引用:2020年山东卷化学高考真题变式题11-15
名校
解题方法
3 . 反应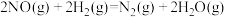 中,每生成
中,每生成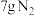 放出
放出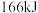 的热量,该反应的速率表达式为
的热量,该反应的速率表达式为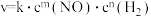 (k、m、n待测),其反应包含下列两步:
(k、m、n待测),其反应包含下列两步:
①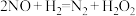 (慢)
(慢)
②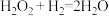 (快)
(快)
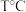 时测得有关实验数据如下:
时测得有关实验数据如下:
下列说法正确的是
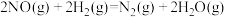 中,每生成
中,每生成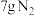 放出
放出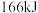 的热量,该反应的速率表达式为
的热量,该反应的速率表达式为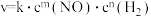 (k、m、n待测),其反应包含下列两步:
(k、m、n待测),其反应包含下列两步:①
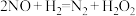 (慢)
(慢)②
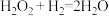 (快)
(快)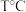 时测得有关实验数据如下:
时测得有关实验数据如下:| 序号 | 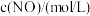 | 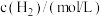 | 速率/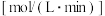 |
| Ⅰ | 0.0060 | 0.0010 | 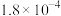 |
| Ⅱ | 0.0060 | 0.0020 |  |
| Ⅲ | 0.0010 | 0.0060 |  |
| Ⅳ | 0.0020 | 0.0060 | 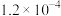 |
| A.正反应的活化能一定是①<② |
| B.整个反应速度由第②步反应决定 |
C.该反应速率表达式: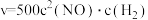 |
D.该反应的热化学方程式为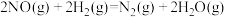  |
您最近一年使用:0次
2021-09-20更新
|
761次组卷
|
19卷引用:2016-2017学年河北正定中学高二上开学考试化学卷
2016-2017学年河北正定中学高二上开学考试化学卷2016-2017学年湖南省衡阳八中高二上月考四化学卷甘肃省兰州第一中学2017-2018学年高二上学期第一次月考(9月)化学试题【全国校级联考】内蒙古赤峰市重点高中(赤峰二中,平煤高级中学等)2017-2018学年高二下学期期末联考(A)化学试题2020届高三化学二轮冲刺新题专练——影响化学反应速率的因素(提升练)夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 影响化学反应速率的因素(强化练习)山西省忻州市第一中学2019-2020学年高二下学期期中考试化学试题安徽省太和第一中学2019-2020学年高一下学期期末考试化学试题(已下线)第02章 化学反应速率与化学平衡(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)(已下线)第七章 能力提升检测卷-2021年高考化学一轮复习讲练测湖南省湘阴县知源学校2020-2021学年高二上学期9月月考化学试题内蒙古包头市回民中学2020-2021学年高二上学期期中考试化学试题山东省东营市胜利第二中学2020-2021学年高二10月月考化学试题(已下线)专题七 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第20讲 化学平衡常数及转化率的计算(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)江苏省泰州中学2022届高三上学期期初检测化学试题(已下线)专题21 化学反应速率(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练安徽省合肥市第六中学2021-2022学年高二上学期月考化学试题安徽省舒城中学2022-2023学年高二上学期第二次月考化学试题
4 . 水是最常用的溶剂。水分子间形成很强的氢键,与一般液体物质相比,常态水具有较大的密度、比热、蒸发热、表面张力和介电常数。水的三相点温度0.01℃、压强610Pa;临界温度374.2℃、临界压强22.1MPa。近年发现,近(超)临界水具备许多特有性质,以其为介质,可以有效实现许多重要的化学反应,应用前景广阔。
(1)画出水的压强-温度(p-T)相图(示意图),标注气相、液相、固相和超临界水所在的区域_______ 。
(2)计算液态水在90°C和0.1MPa时的pKw_______ ( 和
和 可视为常数,相关数据见表1)。
可视为常数,相关数据见表1)。
(3)有人研究了乙酸乙酯在23-30MPa、250-400℃和没有任何其他外加物的条件下的水解动力学,并提出两种可能的机理。
机理1:
CH3COOH CH3COO-+H+Ka
CH3COO-+H+Ka
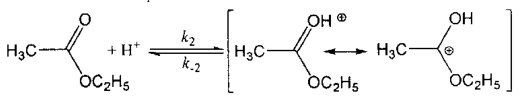 K2
K2
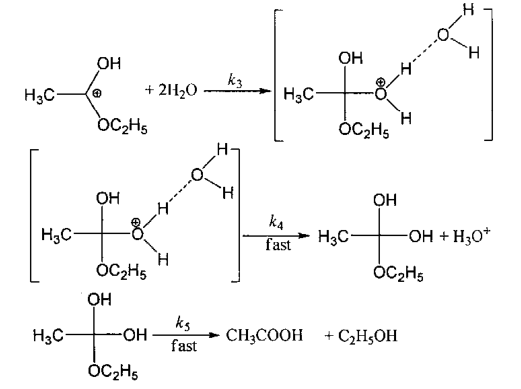
机理2:
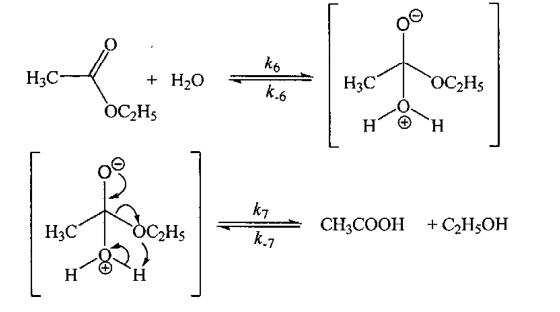
请推测乙酸乙酯在超临界温度时的水解反应按上述哪种机理进行。为什么_______ ?
相关热力学数据如下:
表1有关物质的标准热力学数据(25°C)
表2水和乙酸在25MPa及不同温度下的解离常数Kw和Ka
(4)乙酸乙酯水解反应速率可表示为:r=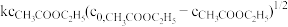 。其中k为速率常数,
。其中k为速率常数, 为乙酸乙酯的初始浓度。请通过推导说明水解反应按哪种机理进行
为乙酸乙酯的初始浓度。请通过推导说明水解反应按哪种机理进行_______ 。
(5)实验表明:近(超)临界水中酯类水解反应的表观活化能可降到常规条件下的1/2,水解反应速率大幅度提高。请通过机理1分析原因_______ 。
(1)画出水的压强-温度(p-T)相图(示意图),标注气相、液相、固相和超临界水所在的区域
(2)计算液态水在90°C和0.1MPa时的pKw
 和
和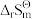 可视为常数,相关数据见表1)。
可视为常数,相关数据见表1)。(3)有人研究了乙酸乙酯在23-30MPa、250-400℃和没有任何其他外加物的条件下的水解动力学,并提出两种可能的机理。
机理1:
CH3COOH
 CH3COO-+H+Ka
CH3COO-+H+Ka K2
K2
机理2:

请推测乙酸乙酯在超临界温度时的水解反应按上述哪种机理进行。为什么
相关热力学数据如下:
表1有关物质的标准热力学数据(25°C)
 /kJ·mol-1 /kJ·mol-1 |  /J·mol-1·K-1 /J·mol-1·K-1 | |
| H2O | -285.830 | 69.91 |
| H+ | 0 | 0 |
| OH- | -229.994 | -10.75 |
表2水和乙酸在25MPa及不同温度下的解离常数Kw和Ka
| 温度/°C | pKw | pKa |
| 250 | 11.05 | 5.95 |
| 300 | 11.12 | 6.65 |
| 350 | 11.55 | 7.90 |
| 400 | 16.57 | 11.41 |
| 450 | 18.13 | 15.48 |
(4)乙酸乙酯水解反应速率可表示为:r=
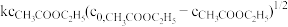 。其中k为速率常数,
。其中k为速率常数, 为乙酸乙酯的初始浓度。请通过推导说明水解反应按哪种机理进行
为乙酸乙酯的初始浓度。请通过推导说明水解反应按哪种机理进行(5)实验表明:近(超)临界水中酯类水解反应的表观活化能可降到常规条件下的1/2,水解反应速率大幅度提高。请通过机理1分析原因
您最近一年使用:0次
5 . 铁卟啉(FeP)是细胞色素(P-450)的活性中心,具有将各种氧供体的氧原子活化并转移至底物的能力。研究人员为模拟活体内的加氧酶催化β-胡萝卜素(P)分解为维生素A(VA)的反应,以FeP为催化剂、间氯过氧化苯甲酸(CPBA)为氧化剂,研究了β-胡萝卜素的分解反应动力学。研究中FeP和CPBA的浓度可视为不变。无论是否存在催化剂FeP,该分解反应对一胡萝卜素均为一级反应。
已知:若y=ax+b,则出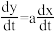 。式中,a,b均为与t无关的常数。
。式中,a,b均为与t无关的常数。
实验A:在无FeP情况下,β-胡萝卜素-间氯过氧化苯甲酸反应体系(β-CPBA)的反应机理1如下(其中β*CPBA为反应中间物,CBA为间氯苯甲酸):
(i)β+CPBA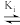 β*CPBA平衡
β*CPBA平衡
(ii)β*CPBA VA+CBA
VA+CBA
实验B.以FeP为催化剂,β-胡萝卜素-间氯过氧化苯甲酸——啉反应体系(β-CPBA-FeP)的反应机理2如下(其中FeOP*CBA、β*FeOP*CBA、β*CPBA为反应中间物):
(iii)FeP+CPBA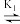 FeOP*CBA(快速平衡)
FeOP*CBA(快速平衡)
(iv)FeOP*CBA+β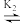 β*FeOP*CBA(快速平衡)
β*FeOP*CBA(快速平衡)
(v)β*FeOP*CBA VA+FeP+CBA
VA+FeP+CBA
(vi)β+CPBA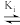 β*CPBA(快速平衡)
β*CPBA(快速平衡)
(vi)β*CPBA VA+CBA
VA+CBA
对该体系的实验结果进行曲线拟合,可得下表数据( 为反应的表观速率常数);
为反应的表观速率常数);
(1)对β-CBPA体系,根据实验测得的表观速率常数 (293.2K)=4.795×10-4s-1,
(293.2K)=4.795×10-4s-1, (301.2K)=8.285×10-4s-1,求反应的表观活化能
(301.2K)=8.285×10-4s-1,求反应的表观活化能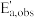
_____ 。
(2)根据反应机理2推导 与[β]间关系的速率方程
与[β]间关系的速率方程______ ,并给出 的表达式
的表达式________ 。
(3)已知β-CPBA-FeP体系反应的表观活化能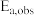 =47.07kJ·mol-1和机理2中(v)步的活化能Ea,1=42.43kJ·mol-1,计算(vii)步的活化能Ea,2
=47.07kJ·mol-1和机理2中(v)步的活化能Ea,1=42.43kJ·mol-1,计算(vii)步的活化能Ea,2___________ 。
(4)分别根据以下条件,说明β-CPBA和β-CPBA-FeP中哪一个体系反应更为有利。
①Ea,1与Ea,2的结果及题中所给其他数据_______ 。
②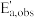 与
与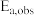 的结果及题中所给其他数据
的结果及题中所给其他数据________ 。
实验C.在金属卟啉催化氧化反应体系中加入一些含氮小分子,会加速反成。为揭示反应机理,研究了FeP与咪唑类(Im)含氮小分子的配位反应热力学。
FeP+2lm⇌FePlm2(1)
实验测得反应(1)的标准平衡常数 见下表。
见下表。
(5)请根据上表中293.2K和301.2K的平衡常数计算反应(1)的 =
=_____ ,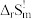 =
=_____ 。已知2730~400K间 =0。
=0。
(6)用上表中所给数据和(5)的计算结果分别解释温度对反应(1)的影响______ 、________ 。
(7)已知在一定温度下反应方向会发生变化,请计算反应的转向温度_________ 。
已知:若y=ax+b,则出
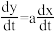 。式中,a,b均为与t无关的常数。
。式中,a,b均为与t无关的常数。实验A:在无FeP情况下,β-胡萝卜素-间氯过氧化苯甲酸反应体系(β-CPBA)的反应机理1如下(其中β*CPBA为反应中间物,CBA为间氯苯甲酸):
(i)β+CPBA
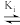 β*CPBA平衡
β*CPBA平衡(ii)β*CPBA
 VA+CBA
VA+CBA实验B.以FeP为催化剂,β-胡萝卜素-间氯过氧化苯甲酸——啉反应体系(β-CPBA-FeP)的反应机理2如下(其中FeOP*CBA、β*FeOP*CBA、β*CPBA为反应中间物):
(iii)FeP+CPBA
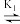 FeOP*CBA(快速平衡)
FeOP*CBA(快速平衡)(iv)FeOP*CBA+β
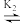 β*FeOP*CBA(快速平衡)
β*FeOP*CBA(快速平衡)(v)β*FeOP*CBA
 VA+FeP+CBA
VA+FeP+CBA(vi)β+CPBA
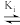 β*CPBA(快速平衡)
β*CPBA(快速平衡)(vi)β*CPBA
 VA+CBA
VA+CBA对该体系的实验结果进行曲线拟合,可得下表数据(
 为反应的表观速率常数);
为反应的表观速率常数);| T/K | k1/s-1 | k1/s-1 |  /s-1 /s-1 |
| 293.2 301.2 | 4.869×10-3 7.731×10-3 | 1.350×10-4 2.398×10-4 | 5.865×10-4 9.795×10-4 |
 (293.2K)=4.795×10-4s-1,
(293.2K)=4.795×10-4s-1, (301.2K)=8.285×10-4s-1,求反应的表观活化能
(301.2K)=8.285×10-4s-1,求反应的表观活化能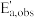
(2)根据反应机理2推导
 与[β]间关系的速率方程
与[β]间关系的速率方程 的表达式
的表达式(3)已知β-CPBA-FeP体系反应的表观活化能
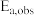 =47.07kJ·mol-1和机理2中(v)步的活化能Ea,1=42.43kJ·mol-1,计算(vii)步的活化能Ea,2
=47.07kJ·mol-1和机理2中(v)步的活化能Ea,1=42.43kJ·mol-1,计算(vii)步的活化能Ea,2(4)分别根据以下条件,说明β-CPBA和β-CPBA-FeP中哪一个体系反应更为有利。
①Ea,1与Ea,2的结果及题中所给其他数据
②
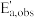 与
与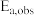 的结果及题中所给其他数据
的结果及题中所给其他数据实验C.在金属卟啉催化氧化反应体系中加入一些含氮小分子,会加速反成。为揭示反应机理,研究了FeP与咪唑类(Im)含氮小分子的配位反应热力学。
FeP+2lm⇌FePlm2(1)
实验测得反应(1)的标准平衡常数
 见下表。
见下表。| T/K | 293.2 | 297.2 | 301.2 | 305.2 |
 | 2.775×105 | 1.012×105 | 4.080×104 | 1.458×104 |
 =
=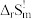 =
= =0。
=0。(6)用上表中所给数据和(5)的计算结果分别解释温度对反应(1)的影响
(7)已知在一定温度下反应方向会发生变化,请计算反应的转向温度
您最近一年使用:0次
2021·山东·模拟预测
6 . 乙炔(HC≡CH)能在Hg(Ⅱ)催化下与水反应生成CH3CHO,反应历程及相对能垒如图所示。下列说法正确的是
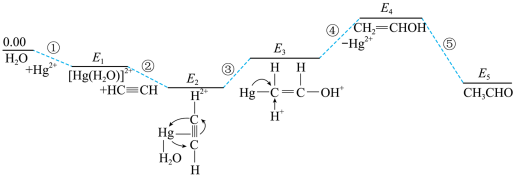

| A.过程①中,水分子中的氧原子向Hg2+的空轨道提供孤对电子 |
| B.本反应历程涉及的物质中,CH2=CHOH的稳定性最弱 |
| C.本反应历程中,决定整个反应快慢的步骤为过程⑤ |
| D.其他条件不变时,更换其他催化剂可改变由乙炔和水制备乙醛的焓变 |
您最近一年使用:0次



