1 . 工业上用菱锰矿(MnCO3)[含FeCO3、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
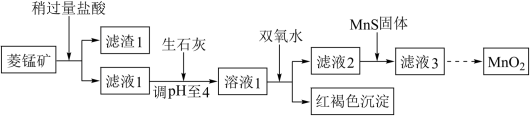
已知:1.Ksp(CuS)=1.27×10-36,Ksp(MnS)=4.65×10-14
2.生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1 mol/L
(1)基态Mn原子价层电子的轨道表示式为___________
(2)含杂质的菱锰矿使用前需将其粉碎,主要目的是___________ 。
(3)向溶液1中加入双氧水时,反应的离子方程式是___________ 。
(4)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,用沉淀溶解平衡 。解释加入难溶电解质MnS的作用___________ 。
(5)制备MnO2的另一种方法是电解法。用惰性电极电解MnCl2溶液可以制得MnO2
①生成MnO2的电极反应式是___________ 。
②若直接电解MnCl2溶液,生成MnO2的电极上同时会产生少量气体。用电极反应式解释产生此气体的原因___________ 。

已知:1.Ksp(CuS)=1.27×10-36,Ksp(MnS)=4.65×10-14
2.生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
(1)基态Mn原子价层电子的轨道表示式为
(2)含杂质的菱锰矿使用前需将其粉碎,主要目的是
(3)向溶液1中加入双氧水时,反应的离子方程式是
(4)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,用
(5)制备MnO2的另一种方法是电解法。用惰性电极电解MnCl2溶液可以制得MnO2
①生成MnO2的电极反应式是
②若直接电解MnCl2溶液,生成MnO2的电极上同时会产生少量气体。用电极反应式解释产生此气体的原因
您最近一年使用:0次
解题方法
2 . 某小组进行实验:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠的混合溶液,一段时间后溶液变蓝。查阅资料知体系中存在两个主要反应:
反应i:H2O2(aq) + 2I-(aq) + 2H+(aq) I2(aq) + 2H2O(l) ΔH1 = -247.5 kJ/mol
I2(aq) + 2H2O(l) ΔH1 = -247.5 kJ/mol
反应ii:I2(aq) + 2S2O32-(aq) 2I-(aq) + S4O62-(aq) ΔH2 = -1021.6 kJ/mol
2I-(aq) + S4O62-(aq) ΔH2 = -1021.6 kJ/mol
(1)H2O2与S2O32-反应的热化学方程式为______ 。
(2)下列实验方案可证实上述反应过程。将实验方案补充完整(所用试剂浓度均为0.01 mol/L)。
a.向酸化的H2O2溶液中加入________ 溶液,溶液几秒后变为蓝色。
b._________ ,溶液立即褪色。
(3)探究c(H+)对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为0.01 mol/L)
① 将实验b补充完整。
② 对比实验a和实验b,t1_____ t2(填“>”或“<”)。
③ 结合(2)中现象解释溶液混合后一段时间才变蓝的原因________ 。
④ 利用实验a的数据,计算t1时间内H2O2与S2O32-反应的平均反应速率(用H2O2浓度的变化表示)________ mol/(L·s)。
反应i:H2O2(aq) + 2I-(aq) + 2H+(aq)
 I2(aq) + 2H2O(l) ΔH1 = -247.5 kJ/mol
I2(aq) + 2H2O(l) ΔH1 = -247.5 kJ/mol反应ii:I2(aq) + 2S2O32-(aq)
 2I-(aq) + S4O62-(aq) ΔH2 = -1021.6 kJ/mol
2I-(aq) + S4O62-(aq) ΔH2 = -1021.6 kJ/mol(1)H2O2与S2O32-反应的热化学方程式为
(2)下列实验方案可证实上述反应过程。将实验方案补充完整(所用试剂浓度均为0.01 mol/L)。
a.向酸化的H2O2溶液中加入
b.
(3)探究c(H+)对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为0.01 mol/L)
| 实验序号 | a | b | |
| 试 剂 | H2O2/mL | 5 | |
| H2SO4/mL | 4 | 2 | |
| Na2S2O3/mL | 8 | ||
| KI(含淀粉)/mL | 3 | ||
| H2O | 0 | ||
| 将上述溶液迅速混合 观察现象 | 溶液变蓝所需时间 为t1秒 | 溶液变蓝所需时间 为t2秒 | |
② 对比实验a和实验b,t1
③ 结合(2)中现象解释溶液混合后一段时间才变蓝的原因
④ 利用实验a的数据,计算t1时间内H2O2与S2O32-反应的平均反应速率(用H2O2浓度的变化表示)
您最近一年使用:0次
2019-04-03更新
|
341次组卷
|
3卷引用:【区级联考】北京市丰台区2019届高三第二学期综合练习(一)(一模)化学试题



