某小组进行实验:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠的混合溶液,一段时间后溶液变蓝。查阅资料知体系中存在两个主要反应:
反应i:H2O2(aq) + 2I-(aq) + 2H+(aq) I2(aq) + 2H2O(l) ΔH1 = -247.5 kJ/mol
I2(aq) + 2H2O(l) ΔH1 = -247.5 kJ/mol
反应ii:I2(aq) + 2S2O32-(aq) 2I-(aq) + S4O62-(aq) ΔH2 = -1021.6 kJ/mol
2I-(aq) + S4O62-(aq) ΔH2 = -1021.6 kJ/mol
(1)H2O2与S2O32-反应的热化学方程式为______ 。
(2)下列实验方案可证实上述反应过程。将实验方案补充完整(所用试剂浓度均为0.01 mol/L)。
a.向酸化的H2O2溶液中加入________ 溶液,溶液几秒后变为蓝色。
b._________ ,溶液立即褪色。
(3)探究c(H+)对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为0.01 mol/L)
① 将实验b补充完整。
② 对比实验a和实验b,t1_____ t2(填“>”或“<”)。
③ 结合(2)中现象解释溶液混合后一段时间才变蓝的原因________ 。
④ 利用实验a的数据,计算t1时间内H2O2与S2O32-反应的平均反应速率(用H2O2浓度的变化表示)________ mol/(L·s)。
反应i:H2O2(aq) + 2I-(aq) + 2H+(aq)
 I2(aq) + 2H2O(l) ΔH1 = -247.5 kJ/mol
I2(aq) + 2H2O(l) ΔH1 = -247.5 kJ/mol反应ii:I2(aq) + 2S2O32-(aq)
 2I-(aq) + S4O62-(aq) ΔH2 = -1021.6 kJ/mol
2I-(aq) + S4O62-(aq) ΔH2 = -1021.6 kJ/mol(1)H2O2与S2O32-反应的热化学方程式为
(2)下列实验方案可证实上述反应过程。将实验方案补充完整(所用试剂浓度均为0.01 mol/L)。
a.向酸化的H2O2溶液中加入
b.
(3)探究c(H+)对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为0.01 mol/L)
| 实验序号 | a | b | |
| 试 剂 | H2O2/mL | 5 | |
| H2SO4/mL | 4 | 2 | |
| Na2S2O3/mL | 8 | ||
| KI(含淀粉)/mL | 3 | ||
| H2O | 0 | ||
| 将上述溶液迅速混合 观察现象 | 溶液变蓝所需时间 为t1秒 | 溶液变蓝所需时间 为t2秒 | |
② 对比实验a和实验b,t1
③ 结合(2)中现象解释溶液混合后一段时间才变蓝的原因
④ 利用实验a的数据,计算t1时间内H2O2与S2O32-反应的平均反应速率(用H2O2浓度的变化表示)
更新时间:2019-04-03 17:28:04
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】 (碳捕获、利用与封存)是应对全球气候变化的关键技术之一,利用捕获的
(碳捕获、利用与封存)是应对全球气候变化的关键技术之一,利用捕获的 催化加氢生成
催化加氢生成 ,可实现
,可实现 资源化,涉及的主要反应如下:
资源化,涉及的主要反应如下:
反应Ⅰ:CO2(g)+4H2(g) CH4(g)+2H2O(g)
CH4(g)+2H2O(g)  H=-164.7kJ·mol-1
H=-164.7kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)  H=+41.2kJ·mol-1
H=+41.2kJ·mol-1
反应Ⅲ:CO(g)+3H2(g) CH4(g)+H2O(g)
CH4(g)+H2O(g)  H=-205.9kJ·mol-1
H=-205.9kJ·mol-1
(1)将一定量 和
和 充入恒容的密闭容器中,控制反应温度为
充入恒容的密闭容器中,控制反应温度为 ,假设只发生反应Ⅰ,
,假设只发生反应Ⅰ, 随t(时间)变化曲线如图1,画出
随t(时间)变化曲线如图1,画出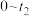 时段,
时段, 随t变化曲线。保持其他条件不变,改变反应温度为
随t变化曲线。保持其他条件不变,改变反应温度为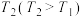 ,再次画出
,再次画出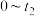 时段,
时段, 随t变化趋势的曲线
随t变化趋势的曲线_______ 。

(2)向恒压、密闭容器中通入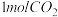 和
和 ,平衡时
,平衡时 、
、 、
、 的物质的量随温度的变化如图2所示;不同压强时,
的物质的量随温度的变化如图2所示;不同压强时, 的平衡转化率如图3所示:
的平衡转化率如图3所示:

①提高 转化为
转化为 的转化率,可以控制的条件是
的转化率,可以控制的条件是_______ ,曲线_______ (填“A”、“B”或“C”)表示 的物质的量随温度的变化,并分析其变化原因:
的物质的量随温度的变化,并分析其变化原因:_______ 。
②判断 的大小关系为
的大小关系为_______ , 时,不同压强下的
时,不同压强下的 平衡转化率趋向于相等的原因是
平衡转化率趋向于相等的原因是_______ 。
③在 时,反应Ⅱ的压强平衡常数
时,反应Ⅱ的压强平衡常数
_______ 。(列出计算式即可,分压=物质的量分数×总压)
 (碳捕获、利用与封存)是应对全球气候变化的关键技术之一,利用捕获的
(碳捕获、利用与封存)是应对全球气候变化的关键技术之一,利用捕获的 催化加氢生成
催化加氢生成 ,可实现
,可实现 资源化,涉及的主要反应如下:
资源化,涉及的主要反应如下:反应Ⅰ:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)
CH4(g)+2H2O(g)  H=-164.7kJ·mol-1
H=-164.7kJ·mol-1反应Ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)  H=+41.2kJ·mol-1
H=+41.2kJ·mol-1反应Ⅲ:CO(g)+3H2(g)
 CH4(g)+H2O(g)
CH4(g)+H2O(g)  H=-205.9kJ·mol-1
H=-205.9kJ·mol-1(1)将一定量
 和
和 充入恒容的密闭容器中,控制反应温度为
充入恒容的密闭容器中,控制反应温度为 ,假设只发生反应Ⅰ,
,假设只发生反应Ⅰ, 随t(时间)变化曲线如图1,画出
随t(时间)变化曲线如图1,画出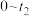 时段,
时段, 随t变化曲线。保持其他条件不变,改变反应温度为
随t变化曲线。保持其他条件不变,改变反应温度为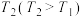 ,再次画出
,再次画出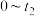 时段,
时段, 随t变化趋势的曲线
随t变化趋势的曲线
(2)向恒压、密闭容器中通入
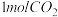 和
和 ,平衡时
,平衡时 、
、 、
、 的物质的量随温度的变化如图2所示;不同压强时,
的物质的量随温度的变化如图2所示;不同压强时, 的平衡转化率如图3所示:
的平衡转化率如图3所示:
①提高
 转化为
转化为 的转化率,可以控制的条件是
的转化率,可以控制的条件是 的物质的量随温度的变化,并分析其变化原因:
的物质的量随温度的变化,并分析其变化原因:②判断
 的大小关系为
的大小关系为 时,不同压强下的
时,不同压强下的 平衡转化率趋向于相等的原因是
平衡转化率趋向于相等的原因是③在
 时,反应Ⅱ的压强平衡常数
时,反应Ⅱ的压强平衡常数
您最近一年使用:0次
【推荐2】燃煤和汽车尾气是造成空气污染产生雾霾的原因之一。消除汽车尾气是减少城市空气污染的热点研究课题。
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②CO(g)+1/2 O2(g)=CO2 (g) △H=-283kJ·mol-1
则汽车尾气中NO和CO在催化转化器中相互反应成无污染的气体的热化学方程式是__________ 。
(2)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
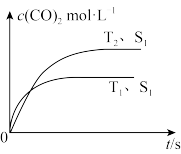
已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程的变化曲线_____________ 。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO 通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如右图所示:

①有害气体NO的转化率为________ , 0~15min NO的平均速率v(NO)=______ mol/(L·min)。(保留两位有效数字)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________ (选填序号)。
a.缩小容器体积b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将___________ 移动(选填“向左”、“向右”或“不”),移动后在达到平衡时的平衡常数的值是____________ (保留两位有效数字)。
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②CO(g)+1/2 O2(g)=CO2 (g) △H=-283kJ·mol-1
则汽车尾气中NO和CO在催化转化器中相互反应成无污染的气体的热化学方程式是
(2)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。

已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程的变化曲线
(3)在一定温度下,将2.0mol NO、2.4mol气体CO 通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如右图所示:

①有害气体NO的转化率为
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是
a.缩小容器体积b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】CH4—CO2催化重整合成CO、H2可有效减少碳排放。其主要反应如下:
反应ⅠCH4(g)+CO2(g)=2CO(g)+2H2(g) △H=247.3kJ•mol-1
反应ⅡCO2(g)+2H2(g)=CO(g)+H2O(g) △H=41.0kJ•mol-1
(1)将一定最CH4与CO2充入密闭容器中,若仅发生上述两个反应,则反应达到平衡的标志是___ (填序号)。
A.恒温恒容条件下,气体的密度不变
B.恒温恒容条件下,气体的压强不变
C.恒温恒容条件下,CO和H2的浓度相等
D.绝热恒容条件下,反应体系的温度不变
(2)反应III为CH4(g)+CO2(g)=4CO(g)+2H2O(g),该反应的△H=___ kJ•mol-1,平衡常数表达式为K=___ 。
(3)图1为反应温度、进料 对反应出口合成气中
对反应出口合成气中 的影响。
的影响。

①850℃时,图1中曲线a、b、c所示 由大到小的关系是
由大到小的关系是___ ,理由是___ 。
②当温度大于850℃时,曲线c出现如图变化的原因可能是___ 。
(4)固体氧化物燃料电池利用CH4为原料,直接在电极上氧化合成CO、H2。其反应原理如图2所示,写出电极m上发生反应的电极方程式____ ;若电极m上通入CH4的速率过快或过慢均会使CO、H2产率降低。其原因是___ 。
反应ⅠCH4(g)+CO2(g)=2CO(g)+2H2(g) △H=247.3kJ•mol-1
反应ⅡCO2(g)+2H2(g)=CO(g)+H2O(g) △H=41.0kJ•mol-1
(1)将一定最CH4与CO2充入密闭容器中,若仅发生上述两个反应,则反应达到平衡的标志是
A.恒温恒容条件下,气体的密度不变
B.恒温恒容条件下,气体的压强不变
C.恒温恒容条件下,CO和H2的浓度相等
D.绝热恒容条件下,反应体系的温度不变
(2)反应III为CH4(g)+CO2(g)=4CO(g)+2H2O(g),该反应的△H=
(3)图1为反应温度、进料
 对反应出口合成气中
对反应出口合成气中 的影响。
的影响。
①850℃时,图1中曲线a、b、c所示
 由大到小的关系是
由大到小的关系是②当温度大于850℃时,曲线c出现如图变化的原因可能是
(4)固体氧化物燃料电池利用CH4为原料,直接在电极上氧化合成CO、H2。其反应原理如图2所示,写出电极m上发生反应的电极方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】1799年,英国化学家汉弗莱·戴维发现了N2O气体。在食品行业中,N2O可用作发泡剂和密封剂。
(1)N2O是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为_________ 。
(2)N2O在金粉表面发生热分解反应:2N2O(g) =2N2(g)+O2(g) △H。
已知:2NH3(g) + 3N2O(g) = 4N2(g) + 3 H2O(l) △H1
4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(l) △H2
△H=_________ (用含△H1、△H2的代数式表示)。
(3)N2O和CO是环境污染性气体,这两种气体会发生反应:N2O(g)+CO)(g)⇌CO2(g)十N2(g),“Fe+”常用作该反应的催化剂。 其总反应分两步进行:
第一步为Fe+ +N2O⇌FeO+ +N2;第二步为________ (写化学方程式)。
第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应活化能_______ (填“大于”“小于”或“等于”)第一步反应活化能。
(4)在四个恒容密闭容器中充入相应量的气体(图甲),发生反应2N2O(g)⇌2N2(g)+O2(g) △H,容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示:

①该反应的△H________ (填“>”或“<”)0。
②容器Ⅱ的体积为5L,在470℃下进行反应,30s后达到平衡,0~30s内容器Ⅱ中O2的反应速率为_________ mol.L-1.min-1 ;容器Ⅳ的体积为1L,容器Ⅳ中的物质也在470℃下进行反应,起始反应速率: 正(N2O)
正(N2O)_______  逆(N2O)。(填“>”“<”或“=”)
逆(N2O)。(填“>”“<”或“=”)
③图中A、B、C三点处容器内密度最大的点是_________ (填“A”“B”或“C”)。
④已知容器Ⅰ的体积为10L,370℃时,该反应的平衡常数k=__________ 。
(1)N2O是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为
(2)N2O在金粉表面发生热分解反应:2N2O(g) =2N2(g)+O2(g) △H。
已知:2NH3(g) + 3N2O(g) = 4N2(g) + 3 H2O(l) △H1
4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(l) △H2
△H=
(3)N2O和CO是环境污染性气体,这两种气体会发生反应:N2O(g)+CO)(g)⇌CO2(g)十N2(g),“Fe+”常用作该反应的催化剂。 其总反应分两步进行:
第一步为Fe+ +N2O⇌FeO+ +N2;第二步为
第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应活化能
(4)在四个恒容密闭容器中充入相应量的气体(图甲),发生反应2N2O(g)⇌2N2(g)+O2(g) △H,容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示:

①该反应的△H
②容器Ⅱ的体积为5L,在470℃下进行反应,30s后达到平衡,0~30s内容器Ⅱ中O2的反应速率为
 正(N2O)
正(N2O) 逆(N2O)。(填“>”“<”或“=”)
逆(N2O)。(填“>”“<”或“=”)③图中A、B、C三点处容器内密度最大的点是
④已知容器Ⅰ的体积为10L,370℃时,该反应的平衡常数k=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①各时间段反应速率最大的是____ (填“0~1”“1~2”“2~3”“3~4”或“4~5”)min,原因是____ 。
②求3~4min时间段以盐酸的浓度变化来表示的该反应速率为_______ (设溶液体积不变)。
(2)另一学生为控制反应速率,防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是_______(填字母)。
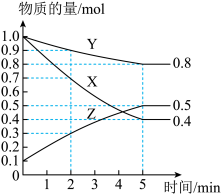
(3)某温度下,在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。_______ 。
②该反应达到平衡状态的标志是_______ (填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1molY的同时消耗2molZ
③2min内Y的转化率为_______ 。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL(标准状况) | 100 | 240 | 464 | 576 | 620 |
②求3~4min时间段以盐酸的浓度变化来表示的该反应速率为
(2)另一学生为控制反应速率,防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是_______(填字母)。
| A.蒸馏水 | B.KCl溶液 | C.KNO3溶液 | D.CuSO4溶液 |
②该反应达到平衡状态的标志是
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1molY的同时消耗2molZ
③2min内Y的转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】 和
和 是重要的能源物质,也是重要的化工原料。为倡导“节能减排”和“低碳经济”,降低大气中
是重要的能源物质,也是重要的化工原料。为倡导“节能减排”和“低碳经济”,降低大气中 的含量及有效地开发利用
的含量及有效地开发利用 ,工业上通常用
,工业上通常用 来生产燃料甲醇。在体积为
来生产燃料甲醇。在体积为 的密闭容器中,充入
的密闭容器中,充入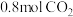 和
和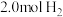 ,一定条件下发生反应:
,一定条件下发生反应: 。测得
。测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。

(1)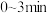 内用
内用 表示该反应的化学反应速率为
表示该反应的化学反应速率为_______ 。
(2)下列措施能提高该反应的化学反应速率的是_______ 。
A.升高温度 B.加入适宜的催化剂 C.缩小容器的体积
(3)能说明上述反应已达到平衡状态的是_______(填字母)。
(4)达到平衡时, 的转化率为
的转化率为_______ ,此时混合气体中 和
和 的物质的量之比为
的物质的量之比为_______ 。
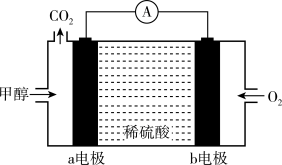
(5)下图为甲醇燃料电池的简易装置,图中a电极为_______ 极(填“正”或“负”);b电极的电极反应式为_______ 。
 和
和 是重要的能源物质,也是重要的化工原料。为倡导“节能减排”和“低碳经济”,降低大气中
是重要的能源物质,也是重要的化工原料。为倡导“节能减排”和“低碳经济”,降低大气中 的含量及有效地开发利用
的含量及有效地开发利用 ,工业上通常用
,工业上通常用 来生产燃料甲醇。在体积为
来生产燃料甲醇。在体积为 的密闭容器中,充入
的密闭容器中,充入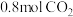 和
和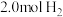 ,一定条件下发生反应:
,一定条件下发生反应: 。测得
。测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
(1)
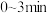 内用
内用 表示该反应的化学反应速率为
表示该反应的化学反应速率为(2)下列措施能提高该反应的化学反应速率的是
A.升高温度 B.加入适宜的催化剂 C.缩小容器的体积
(3)能说明上述反应已达到平衡状态的是_______(填字母)。
A. 四种气体的物质的量浓度之比为1∶3∶1∶1 四种气体的物质的量浓度之比为1∶3∶1∶1 |
| B.容器内混合气体的压强保持不变 |
C. 的消耗速率与 的消耗速率与 的生成速率之比为1∶1 的生成速率之比为1∶1 |
| D.容器内混合气体的平均相对分子质量保持不变 |
 的转化率为
的转化率为 和
和 的物质的量之比为
的物质的量之比为(5)下图为甲醇燃料电池的简易装置,图中a电极为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】亚硝酰硫酸(NOSO4H)主要用于分散染料重氮反应中取代亚硝酸钠,从而降低成本,提高产品质量。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
(1)装置A制取SO2,则A中反应的化学方程式为_______ ,导管b的作用是_______
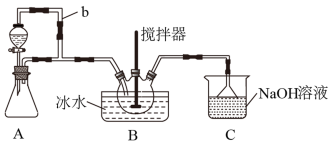
(2)SO2与装置B中盛有的浓硫酸和浓硝酸的混合液在维持体系温度不得高于20℃的条件下,反应制得NOSO4H。反应过程中,亚硝酰硫酸和硝酸的物质的量随时间的变化如图所示。
①装置B中发生反应的化学反应方程式为_______ 。
②反应进行到10min后,反应速度明显加快,其可能的原因是_______ 。
(3)装置C的主要作用是_______ 。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是_______ 。
(5)测定亚硝酰硫酸NOSO4H的纯度:准确称取1.500g产品放入250mL的碘量瓶中,加入0.1000mol·L−1、60.00mL的KMnO4标准溶液和10.00mL25%H2SO4溶液,然后摇匀。用0.2500mol·L−1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.0mL。已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4;2MnO +5C2O
+5C2O +16H+=2Mn2++10CO2↑+8H2O。达到滴定终点时的现象为
+16H+=2Mn2++10CO2↑+8H2O。达到滴定终点时的现象为_______ ,亚硝酰硫酸的纯度为_______ (精确到0.1%)。

(1)装置A制取SO2,则A中反应的化学方程式为
(2)SO2与装置B中盛有的浓硫酸和浓硝酸的混合液在维持体系温度不得高于20℃的条件下,反应制得NOSO4H。反应过程中,亚硝酰硫酸和硝酸的物质的量随时间的变化如图所示。

①装置B中发生反应的化学反应方程式为
②反应进行到10min后,反应速度明显加快,其可能的原因是
(3)装置C的主要作用是
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是
(5)测定亚硝酰硫酸NOSO4H的纯度:准确称取1.500g产品放入250mL的碘量瓶中,加入0.1000mol·L−1、60.00mL的KMnO4标准溶液和10.00mL25%H2SO4溶液,然后摇匀。用0.2500mol·L−1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.0mL。已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4;2MnO
 +5C2O
+5C2O +16H+=2Mn2++10CO2↑+8H2O。达到滴定终点时的现象为
+16H+=2Mn2++10CO2↑+8H2O。达到滴定终点时的现象为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某探究小组通过比较酸性KMnO4溶液与H2C2O4溶液反应过程中,溶液紫色消失时间长短的方法,研究浓度、温度对反应速率的影响。
可供选择的实验条件:KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.1 mol·L-1,H2C2O4溶液的浓度可选择0.1 mol·L-1、0.2 mol·L-1,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)实验设计:请完成以下实验设计表。
(2)实验记录:实验中需要记录的数据是___________________________________ 。
可供选择的实验条件:KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.1 mol·L-1,H2C2O4溶液的浓度可选择0.1 mol·L-1、0.2 mol·L-1,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)实验设计:请完成以下实验设计表。
| 实验编号 | T/K | KMnO4浓度/mol·L-1 | H2C2O4浓度/mol·L-1 | 实验目的 |
| ① | 298 | 0.01 mol·L-1 | 0.1 mol·L-1 | 为以下实验做对照 |
| ② | ||||
| ③ | 探究浓度对反应速率的影响 |
(2)实验记录:实验中需要记录的数据是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
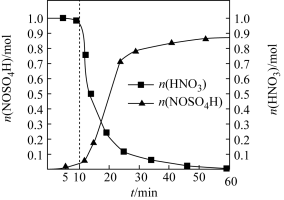
【推荐3】硫酸是中学最常见的三大强酸之一,某研究性学习小组探究外界条件对铁与硫酸反应速率的影响。
[实验设计]控制用同种铁块,初始使用硫酸体积均为1000mL,恒定实验温度在298K或313K(其余实验条件见表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
[解释与结论]
(2)实验①、②表明___________
请再提出一种加快该反应速率的方法___________
(3)实验③得出的结论是:当硫酸浓度为18.4 mol/L,________ ,原因是__________
[思考与交流]
(4)实验③,若t1时开始加热,在铁的表面逐渐产生气泡,当有大量气泡产生时,控制反应温度基本不变。甲同学将收集到的气体体积与时间的关系粗略地表示为图2。t1~t2时间段,反应生成的气体是_________ 。写出开始加热时发生反应的化学方程式:___ 。

[实验设计]控制用同种铁块,初始使用硫酸体积均为1000mL,恒定实验温度在298K或313K(其余实验条件见表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
| 实验 编号 | 实验目的 | T/K | Fe/g | c(H2SO4)/ mol·L-1 |
| ① | 为以下实验作参考 | 298 | 10 | 1.0 |
| ② | 探究温度对反应速率的影响 | |||
| ③ | 298 | 10 | 18.4 |

[解释与结论]
(2)实验①、②表明
请再提出一种加快该反应速率的方法
(3)实验③得出的结论是:当硫酸浓度为18.4 mol/L,
[思考与交流]
(4)实验③,若t1时开始加热,在铁的表面逐渐产生气泡,当有大量气泡产生时,控制反应温度基本不变。甲同学将收集到的气体体积与时间的关系粗略地表示为图2。t1~t2时间段,反应生成的气体是

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】 歧化反应的方程式为
歧化反应的方程式为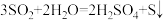 ,
, 可以作为水溶液中
可以作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
(1)i.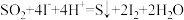
ii.
__________ =__________ +__________ 
(2)探究i、ii反应速率与 歧化反应速率的关系,实验如下:分别将18mL
歧化反应速率的关系,实验如下:分别将18mL 饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:
饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)
①B是A的对比实验,则
__________ 。
②比较A、B、C,可得出的结论是_________________________ 。
③实验表明, 的歧化反应速率
的歧化反应速率 。结合i、ii反应速率解释原因:
。结合i、ii反应速率解释原因:_____________________ 。
 歧化反应的方程式为
歧化反应的方程式为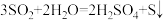 ,
, 可以作为水溶液中
可以作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
歧化反应的催化剂,可能的催化过程如下。将ii补充完整。(1)i.
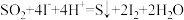
ii.


(2)探究i、ii反应速率与
 歧化反应速率的关系,实验如下:分别将18mL
歧化反应速率的关系,实验如下:分别将18mL 饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:
饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)| 序号 | A | B | C | D |
| 试剂组成 | 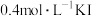 |  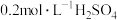 | 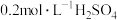 | 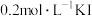 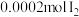 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则

②比较A、B、C,可得出的结论是
③实验表明,
 的歧化反应速率
的歧化反应速率 。结合i、ii反应速率解释原因:
。结合i、ii反应速率解释原因:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】过氧化钙可以用于改善地表水质,处理含重金属元素废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如图:

已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是__ 。
(2)检验“水洗”操作滤液中是否含Cl-,的正确操作是__ 。
(3)沉淀时常用冰水控制温度在0℃左右有利于提高CaO2·8H2O产率,其可能原因是(写出两种)①__ ;②__ 。
(4)测定产品中CaO2含量的实验步骤:
第一步:准确称取ag产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,再滴入少量2mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。(已知:I2+2S2O =2I-+S4O
=2I-+S4O )
)
①CaO2的质量分数为__ (用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能__ (填“不变”、“偏低”或“偏高”)。

已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是
(2)检验“水洗”操作滤液中是否含Cl-,的正确操作是
(3)沉淀时常用冰水控制温度在0℃左右有利于提高CaO2·8H2O产率,其可能原因是(写出两种)①
(4)测定产品中CaO2含量的实验步骤:
第一步:准确称取ag产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,再滴入少量2mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。(已知:I2+2S2O
 =2I-+S4O
=2I-+S4O )
)①CaO2的质量分数为
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】某小组进行实验:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠的混合溶液,一段时间后溶液变蓝。查阅资料知体系中存在两个主要反应:
反应i:H2O2(aq)+2I-(aq)+2H+(aq)=I2(aq)+2H2O(l)△H1=-247.5kJ·mol-1
反应ii:I2(aq)+2S2O (aq)=2I-(aq)+S4O
(aq)=2I-(aq)+S4O (aq)△H2=-1021.6kJ·mol-1
(aq)△H2=-1021.6kJ·mol-1
(1)H2O2与S2O 反应的热化学方程式为
反应的热化学方程式为___ 。
(2)下列实验方案可证实上述反应过程。
将实验方案补充完整(所用试剂浓度均为0.01mol·L-1)。
①向酸化的H2O2溶液中加入___ 溶液,溶液几秒后变为蓝色。
②向①中蓝色溶液中加入___ 溶液,溶液立即褪色。
(3)探究c(H+)对反应速率的影响,实验方案如表所示。(所用试剂除H2O以外,浓度均为0.01mol·L-1)
①将实验b补充完整,X=___ 、Q=___ 。
②对比实验a和实验b,t1___ (填“>”或“<”)t2。
③结合(2)中现象解释溶液混合后一段时间才变蓝的原因:___ 。
④利用实验a的数据,计算t1时间内H2O2与S2O 反应的平均反应速率(用H2O2浓度的变化表示),
反应的平均反应速率(用H2O2浓度的变化表示),___ mol·L-1·s-1。
反应i:H2O2(aq)+2I-(aq)+2H+(aq)=I2(aq)+2H2O(l)△H1=-247.5kJ·mol-1
反应ii:I2(aq)+2S2O
 (aq)=2I-(aq)+S4O
(aq)=2I-(aq)+S4O (aq)△H2=-1021.6kJ·mol-1
(aq)△H2=-1021.6kJ·mol-1(1)H2O2与S2O
 反应的热化学方程式为
反应的热化学方程式为(2)下列实验方案可证实上述反应过程。
将实验方案补充完整(所用试剂浓度均为0.01mol·L-1)。
①向酸化的H2O2溶液中加入
②向①中蓝色溶液中加入
(3)探究c(H+)对反应速率的影响,实验方案如表所示。(所用试剂除H2O以外,浓度均为0.01mol·L-1)
实验序号 | a | b | |
试剂 | H2O2/mL | 4.5 | X |
| H2SO4/mL | 4.5 | 2 | |
| Na2S2O3/mL | 8 | Y | |
| KI(含淀粉)/mL | 3 | Z | |
| H2O/mL | 0 | Q | |
| 将上述溶液迅速混合现象 | 溶液变蓝所需时间为t1秒 | 溶液变蓝所需时间为t2秒 | |
②对比实验a和实验b,t1
③结合(2)中现象解释溶液混合后一段时间才变蓝的原因:
④利用实验a的数据,计算t1时间内H2O2与S2O
 反应的平均反应速率(用H2O2浓度的变化表示),
反应的平均反应速率(用H2O2浓度的变化表示),
您最近一年使用:0次



