名校
解题方法
1 . 过氧化钠是一种重要的强氧化剂,也能作为封闭生态系统的CO2吸收剂和生氧剂,其反应原理为:2Na2O2+2CO2=2NaCO3+O2。答下列问题:
(1)上述反应中两种同周期原子的半径大小为______ (填写元素符号)。反应中破坏的化学键类型有______ 。
(2)S和O位于元素周期表同一主族,非金属性:S______ O(填“<”、“>”或“=”),用一个化学方程式说明判断的理由:______ 。
(3)过氧化钠在日常保存时常因发生反应: ,而发生变质。
,而发生变质。
①该反应的平衡常数表达式为______ 。
②向保存在恒温密闭容器中过氧化钠中通入少量O2,固体质量将______ (“增大”、“减小”或“不变”,下同),达到新平衡时容器内气体的压强将______ 。
(4)利用如图装置探究Na2O2与SO2反应的产物。实验中当通入二氧化硫气体,将带有火星的木条插入试管C中,木条复燃。有同学猜测,B中反应后的固体产物可能是亚硫酸钠和硫酸钠的混合物。
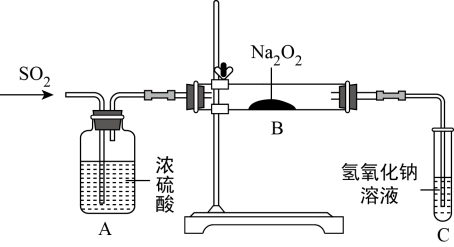
①该同学认为存在硫酸钠的原因是______ (用化学方程式解释)。
②设计一个简单的实验证明是否存在硫酸钠。简要地写出实验的步骤、现象和结论______ 。
(1)上述反应中两种同周期原子的半径大小为
(2)S和O位于元素周期表同一主族,非金属性:S
(3)过氧化钠在日常保存时常因发生反应:
 ,而发生变质。
,而发生变质。①该反应的平衡常数表达式为
②向保存在恒温密闭容器中过氧化钠中通入少量O2,固体质量将
(4)利用如图装置探究Na2O2与SO2反应的产物。实验中当通入二氧化硫气体,将带有火星的木条插入试管C中,木条复燃。有同学猜测,B中反应后的固体产物可能是亚硫酸钠和硫酸钠的混合物。

①该同学认为存在硫酸钠的原因是
②设计一个简单的实验证明是否存在硫酸钠。简要地写出实验的步骤、现象和结论
您最近一年使用:0次
2021-01-07更新
|
187次组卷
|
2卷引用:上海市格致中学2021届高三上学期期中考试化学试题
2 . 工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO (aq)⇌PbCO3(s)+SO
(aq)⇌PbCO3(s)+SO (aq)。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
(aq)。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
(1)上述反应的平衡常数表达式:K=_______ 。
(2)室温时,向两份相同的样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在_______ 溶液中PbSO4转化率较大,理由是_______ 。
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],它和PbCO3受热都易分解生成PbO。该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,请你完成假设二和假设三:
假设一:全部为PbCO3;假设二:_______ ;假设三:_______ 。
(4)为验证假设一是否成立,课题组进行如下研究。
①定性研究:请你完成表中内容。
②定量研究:取26.7mg的干燥样品,加热,测的固体质量随温度的变化关系如图。某同学由图中信息得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:_______ 。

 (aq)⇌PbCO3(s)+SO
(aq)⇌PbCO3(s)+SO (aq)。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
(aq)。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。(1)上述反应的平衡常数表达式:K=
(2)室温时,向两份相同的样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],它和PbCO3受热都易分解生成PbO。该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,请你完成假设二和假设三:
假设一:全部为PbCO3;假设二:
(4)为验证假设一是否成立,课题组进行如下研究。
①定性研究:请你完成表中内容。
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取一定量样品充分干燥, |

您最近一年使用:0次



