名校
1 . 某实验小组从电极反应角度探究银镜反应中物质氧化性和还原性的变化。
资料:ⅰ.[Ag(NH3)2]+⇌ [Ag(NH3)]++NH3K1=10−3.81
[Ag(NH3)]+⇌ Ag++NH3K2=10−3.24
ⅱ.AgOH不稳定,极易分解为黑色Ag2O,Ag2O溶于氨水
(1)实验发现:乙醛和AgNO3溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
①有研究表明:配制银氨溶液时,AgNO3和氨水生成Ag(NH3)2NO3,写出生成Ag(NH3)2NO3的化学方程式_______ 。
②从氧化还原角度分析:发生银镜反应时,氧化性微粒可能是Ag+、_______ 。
(2)甲同学查阅资料:银镜反应时,Ag+被还原成Ag。
①电极反应式:
ⅰ.还原反应:Ag++e−=Ag
ⅱ.氧化反应:_______ 。(碱性条件下)
②从电极反应角度分析物质氧化性和还原性的变化:
ⅰ.随c(Ag+)降低,Ag+氧化性减弱。
ⅱ.随c(OH−)增大,乙醛还原性增强。
③补充实验验证②中的分析。
乙同学认为实验Ⅲ不能证明“随c(Ag+)降低,Ag+氧化性减弱”,理由是_______ 。
(3)设计实验进一步验证。
①乙同学认为通过实验Ⅳ能证明“随c(Ag+)降低,Ag+氧化性减弱”,你认为是否合理并说明原因_______ 。
②分析实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH−)增大,可能是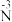 也参与了还原
也参与了还原 。经检验该假设成立,实验方案及现象是
。经检验该假设成立,实验方案及现象是_______ 。
(4)总结:ⅰ.银氨溶液和乙醛发生银镜反应时,氧化剂主要是Ag+,还原剂主要是乙醛;ⅱ.银氨溶液中滴加较浓的NaOH溶液能促进银镜反应的发生,此法不适用于检验醛基,请解释原因_______ 。
资料:ⅰ.[Ag(NH3)2]+⇌ [Ag(NH3)]++NH3K1=10−3.81
[Ag(NH3)]+⇌ Ag++NH3K2=10−3.24
ⅱ.AgOH不稳定,极易分解为黑色Ag2O,Ag2O溶于氨水
(1)实验发现:乙醛和AgNO3溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
①有研究表明:配制银氨溶液时,AgNO3和氨水生成Ag(NH3)2NO3,写出生成Ag(NH3)2NO3的化学方程式
②从氧化还原角度分析:发生银镜反应时,氧化性微粒可能是Ag+、
(2)甲同学查阅资料:银镜反应时,Ag+被还原成Ag。
①电极反应式:
ⅰ.还原反应:Ag++e−=Ag
ⅱ.氧化反应:
②从电极反应角度分析物质氧化性和还原性的变化:
ⅰ.随c(Ag+)降低,Ag+氧化性减弱。
ⅱ.随c(OH−)增大,乙醛还原性增强。
③补充实验验证②中的分析。
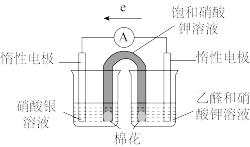
| 实验操作及现象: 实验Ⅰ.插入“饱和KNO3溶液”盐桥,电流表指针偏转; 实验Ⅱ.电流稳定后向右侧烧杯滴加NaOH溶液,指针偏转幅度增大; 实验Ⅲ.电流再次稳定后向左侧烧杯滴加氨水,指针偏转幅度减小 |
(3)设计实验进一步验证。
| 实验 | 实验操作 | 实验现象 |
| Ⅳ | 往盛有银氨溶液的试管中滴加浓氨水,无明显现象,加入3滴乙醛,振荡,水浴加热 | 闻到刺激性气味,溶液略显灰色,试管壁未见银镜 |
| Ⅴ | 往盛有银氨溶液的试管中滴加较浓的NaOH溶液至pH与实验Ⅳ相同,振荡,溶液变浑浊,加入3滴乙醛,振荡,水浴加热 | 试管壁 |
②分析实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH−)增大,可能是
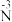 也参与了还原
也参与了还原 。经检验该假设成立,实验方案及现象是
。经检验该假设成立,实验方案及现象是(4)总结:ⅰ.银氨溶液和乙醛发生银镜反应时,氧化剂主要是Ag+,还原剂主要是乙醛;ⅱ.银氨溶液中滴加较浓的NaOH溶液能促进银镜反应的发生,此法不适用于检验醛基,请解释原因
您最近一年使用:0次
2022-04-02更新
|
1048次组卷
|
7卷引用:北京市石景山区2022届高三一模化学试题
2 . 铁的化合物在工业脱硫工艺中有着重要应用。
Ⅰ.电解脱硫
煤中的含硫物质主要是FeS2,电解脱硫原理如图。
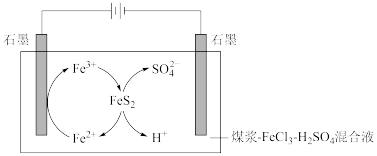
(1)阴极石墨棒上有无色气体产生,该气体是_______ (填化学式)。
(2)研究发现电解时若电压过高,阳极会有副反应发生,造成电解效率降低。某电压下电解100mL煤浆- FeCl3- H2SO4混合液,煤浆中除FeS2外无其它含硫物质, H2SO4浓度为0. 0lmol· L-1,当阴极收集到224mL(标准状况)气体时(阴极无副反应发生),测得溶液中c( )=0.02mol·L-1,若忽略电解前后溶液体积变化,电解效率η(
)=0.02mol·L-1,若忽略电解前后溶液体积变化,电解效率η( )=
)=_______ %[η(B)=  ]。
]。
(3)电解法脱硫的优点有_______ (写出一条即可)。
Ⅱ.生物脱硫
(4)Fe3+参与生物脱硫的过程分为吸收和再生两部分。
①吸收:Fe3+将工业废气中的H2S氧化为S
②再生:硫杆菌作用下O2氧化Fe2+再生Fe3+
硫杆菌生长的最佳pH范围是1. 4~3.0,但酸性条件不利于H2S的吸收,结合平衡移动原理解释原因_______ 。
Ⅲ.络合脱硫
(5)碱性条件有利于H2S的吸收,但Fe3+极易形成氢氧化物和硫化物沉淀,因此需将其制成可溶于水的配合物Fe(III)Ln(L表示配体,n表示配位数)。脱硫过程包含如下两步反应:
①碱性条件下,Fe(Ⅲ)Ln氧化H2S生成S8,离子方程式为_______ 。
②O2氧化再生Fe(Ⅲ)Ln,离子方程式为4Fe(Ⅱ)Ln+O2+2H2O=4Fe(Ⅲ)Ln +4OH-。脱硫过程总反应的化学方程式为_______ 。
(6)Na2H2Y (结构简式为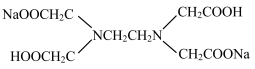 )溶液中,每个H2Y2-电离出2个H+生成酸根Y4-,然后与Fe3+配位。已知该配位反应受溶液pH的影响,若溶液pH太低或太高,分别存在的问题是
)溶液中,每个H2Y2-电离出2个H+生成酸根Y4-,然后与Fe3+配位。已知该配位反应受溶液pH的影响,若溶液pH太低或太高,分别存在的问题是_______ 。
Ⅰ.电解脱硫
煤中的含硫物质主要是FeS2,电解脱硫原理如图。

(1)阴极石墨棒上有无色气体产生,该气体是
(2)研究发现电解时若电压过高,阳极会有副反应发生,造成电解效率降低。某电压下电解100mL煤浆- FeCl3- H2SO4混合液,煤浆中除FeS2外无其它含硫物质, H2SO4浓度为0. 0lmol· L-1,当阴极收集到224mL(标准状况)气体时(阴极无副反应发生),测得溶液中c(
 )=0.02mol·L-1,若忽略电解前后溶液体积变化,电解效率η(
)=0.02mol·L-1,若忽略电解前后溶液体积变化,电解效率η( )=
)= ]。
]。(3)电解法脱硫的优点有
Ⅱ.生物脱硫
(4)Fe3+参与生物脱硫的过程分为吸收和再生两部分。
①吸收:Fe3+将工业废气中的H2S氧化为S
②再生:硫杆菌作用下O2氧化Fe2+再生Fe3+
硫杆菌生长的最佳pH范围是1. 4~3.0,但酸性条件不利于H2S的吸收,结合平衡移动原理解释原因
Ⅲ.络合脱硫
(5)碱性条件有利于H2S的吸收,但Fe3+极易形成氢氧化物和硫化物沉淀,因此需将其制成可溶于水的配合物Fe(III)Ln(L表示配体,n表示配位数)。脱硫过程包含如下两步反应:
①碱性条件下,Fe(Ⅲ)Ln氧化H2S生成S8,离子方程式为
②O2氧化再生Fe(Ⅲ)Ln,离子方程式为4Fe(Ⅱ)Ln+O2+2H2O=4Fe(Ⅲ)Ln +4OH-。脱硫过程总反应的化学方程式为
(6)Na2H2Y (结构简式为
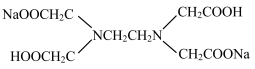 )溶液中,每个H2Y2-电离出2个H+生成酸根Y4-,然后与Fe3+配位。已知该配位反应受溶液pH的影响,若溶液pH太低或太高,分别存在的问题是
)溶液中,每个H2Y2-电离出2个H+生成酸根Y4-,然后与Fe3+配位。已知该配位反应受溶液pH的影响,若溶液pH太低或太高,分别存在的问题是
您最近一年使用:0次
解题方法
3 . 已知 为可逆反应,某小组设计实验测定该反应平衡常数并探究影响化学平衡移动的因素。
为可逆反应,某小组设计实验测定该反应平衡常数并探究影响化学平衡移动的因素。
(1)配制 溶液和
溶液和 溶液。
溶液。
 基态核外电子排布式为
基态核外电子排布式为_______ ,实验中所需的玻璃仪器有容量瓶、量筒和_______ 。(从下图中选择,写出名称)
将 溶液与
溶液与 溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液。(忽略反应引起的溶液体积变化)
溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液。(忽略反应引起的溶液体积变化)
①甲同学通过测定滤液中 浓度测得K。取
浓度测得K。取 滤液,用
滤液,用 标准溶液滴定滤液中
标准溶液滴定滤液中 ,至滴定终点时消耗
,至滴定终点时消耗 标准溶液
标准溶液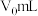 。滴定终点的现象为
。滴定终点的现象为_______ ,反应 的平衡常数
的平衡常数
_______ 。(用含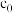 、
、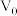 、V的计算式表示)
、V的计算式表示)
②乙同学通过测定滤液中 浓度测得K。取
浓度测得K。取 滤液,加入
滤液,加入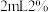 磺基水杨酸溶液,加入
磺基水杨酸溶液,加入 为9~11.5的缓冲溶液,测定吸光度。测得溶液中
为9~11.5的缓冲溶液,测定吸光度。测得溶液中 浓度为
浓度为 ,则
,则 的平衡常数
的平衡常数
_______ 。(用含c的计算式表示)
(3)该小组进一步研究常温下稀释对该平衡移动方向的影响。
用 溶液和
溶液和 溶液,按下表配制总体积相同的系列溶液,测定平衡时
溶液,按下表配制总体积相同的系列溶液,测定平衡时 浓度,记录数据。
浓度,记录数据。

_______ ,
_______ 。 和
和 存在的关系是
存在的关系是_______ (用含 和
和 的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
 为可逆反应,某小组设计实验测定该反应平衡常数并探究影响化学平衡移动的因素。
为可逆反应,某小组设计实验测定该反应平衡常数并探究影响化学平衡移动的因素。(1)配制
 溶液和
溶液和 溶液。
溶液。 基态核外电子排布式为
基态核外电子排布式为
| 资料卡片 ⅰ. 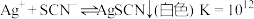 ; ;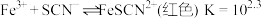 ⅱ.  为9~l1.5条件下 为9~l1.5条件下 和磺基水杨酸 和磺基水杨酸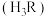 生成稳定的黄色络合物 生成稳定的黄色络合物 , , 可以通过测定吸光度得知其浓度。 可以通过测定吸光度得知其浓度。 |
 溶液与
溶液与 溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液。(忽略反应引起的溶液体积变化)
溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液。(忽略反应引起的溶液体积变化)①甲同学通过测定滤液中
 浓度测得K。取
浓度测得K。取 滤液,用
滤液,用 标准溶液滴定滤液中
标准溶液滴定滤液中 ,至滴定终点时消耗
,至滴定终点时消耗 标准溶液
标准溶液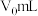 。滴定终点的现象为
。滴定终点的现象为 的平衡常数
的平衡常数
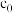 、
、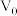 、V的计算式表示)
、V的计算式表示)②乙同学通过测定滤液中
 浓度测得K。取
浓度测得K。取 滤液,加入
滤液,加入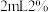 磺基水杨酸溶液,加入
磺基水杨酸溶液,加入 为9~11.5的缓冲溶液,测定吸光度。测得溶液中
为9~11.5的缓冲溶液,测定吸光度。测得溶液中 浓度为
浓度为 ,则
,则 的平衡常数
的平衡常数
(3)该小组进一步研究常温下稀释对该平衡移动方向的影响。
用
 溶液和
溶液和 溶液,按下表配制总体积相同的系列溶液,测定平衡时
溶液,按下表配制总体积相同的系列溶液,测定平衡时 浓度,记录数据。
浓度,记录数据。| 序号 | 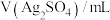 | 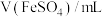 | 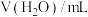 | 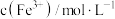 |
| Ⅰ | 10 | 10 |  | |
| Ⅱ | 2 | a | b |  |


 和
和 存在的关系是
存在的关系是 和
和 的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
您最近一年使用:0次
解题方法
4 . 实验小组用固体和水配制相同浓度的 溶液和
溶液和 溶液,用其研究
溶液,用其研究 的性质。
的性质。
【查阅资料】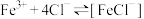 (黄色)
(黄色)
(1) 溶于水后促进了水的电离,实验证据是
溶于水后促进了水的电离,实验证据是___________ 。
(2)根据实验Ⅰ推测, 溶液呈现黄色的原因可能是
溶液呈现黄色的原因可能是 水解所致。结合化学用语分析该推测过程:
水解所致。结合化学用语分析该推测过程:___________
(3)为了证明 溶液中存在平衡:
溶液中存在平衡: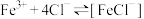 ,同学们设计并进行实验。
,同学们设计并进行实验。
能说明 溶液中存在上述平衡的实验方案是
溶液中存在上述平衡的实验方案是___________ (填字母)。
(4)综合上述实验,分析相同浓度 溶液的
溶液的 大于
大于 溶液的
溶液的 ,原因是
,原因是___________ 。
 溶液和
溶液和 溶液,用其研究
溶液,用其研究 的性质。
的性质。| 实验Ⅰ | 实验Ⅱ |
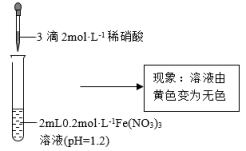 | 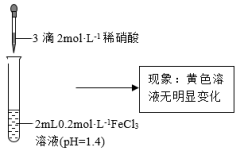 |
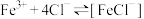 (黄色)
(黄色)(1)
 溶于水后促进了水的电离,实验证据是
溶于水后促进了水的电离,实验证据是(2)根据实验Ⅰ推测,
 溶液呈现黄色的原因可能是
溶液呈现黄色的原因可能是 水解所致。结合化学用语分析该推测过程:
水解所致。结合化学用语分析该推测过程:(3)为了证明
 溶液中存在平衡:
溶液中存在平衡: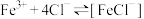 ,同学们设计并进行实验。
,同学们设计并进行实验。| 序号 | 实验操作 | 实验现象 |
| a | 向 溶液中加入铁粉 溶液中加入铁粉 | 溶液颜色变浅 |
| b | 向 溶液中加入3滴 溶液中加入3滴 溶液 溶液 | 产生白色沉淀,溶液颜色变浅 |
| c | 向实验Ⅱ所得溶液中加入3滴NaOH | 产生红褐色沉淀,溶液颜色变浅 |
| d | 将 溶液加热 溶液加热 | 溶液颜色变深 |
 溶液中存在上述平衡的实验方案是
溶液中存在上述平衡的实验方案是(4)综合上述实验,分析相同浓度
 溶液的
溶液的 大于
大于 溶液的
溶液的 ,原因是
,原因是
您最近一年使用:0次
解题方法
5 . 氯亚铂酸钾是合成绝大部分二价铂化合物的原料,广泛应用于电镀、医药中间体、催化剂前驱体等的制备。
已知:
利用Pt废料制备氯亚铂酸钾,流程如下:
(2)关于实验步骤说法错误的是___________。
(3)步骤④发生时有红棕色气体生成,写出发生的化学反应方程式,并标出电子转移的方向和数目___________ 。
(4)步骤⑦得到的溶液中含 和HCl,为了进一步得到晶体
和HCl,为了进一步得到晶体 ,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾(
,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾( )成品。
)成品。
①蒸发浓缩需要控制温度75℃附近的原因___________ 。
②洗涤操作中,用乙醇洗涤相比于用蒸馏水洗涤的优势是___________ 。
A.减小固体的溶解损失
B.除去固体表面吸附的杂质
C.乙醇挥发带走水分,使固体快速干燥
③实验室进行以上步骤不需要用到的仪器是___________ 。___________ 。
已知:
| 氯亚铂酸钾(K2PtCl4) | 水溶性可溶 10 g/L(20℃)、不溶于乙醇、受热分解。 |
| 氯铂酸钾(K2PtCl6) | 溶于热水、微溶于冷水、几乎不溶于乙醇、乙醚。 |
| 氯铂酸(H2PtCl6) | 110℃时部分分解,150℃开始生成金属铂。 |
| 亚硝酸钾(KNO2) | 有一定还原性,还原性:KNO2弱于K2C2O4。 |
| 亚硝酸(HNO2) | 弱酸、不稳定、易分解。 |
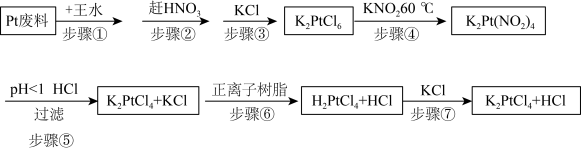
| A.步骤①中王水可以用浓硫酸代替 |
| B.步骤②利用硝酸的易挥发性,适合加强热 |
| C.步骤③加入KCl能促进K2PtCl6晶体析出 |
| D.步骤④用还原剂K2C2O4代替更好 |
(2)关于实验步骤说法错误的是___________。
| A.步骤⑤利用酸性条件下亚硝酸的不稳定性 |
B.步骤⑥用正离子树脂交换是指 和 和 的交换 的交换 |
| C.步骤⑦是氧化还原反应 |
| D.最后得到的溶液中经蒸发能除去HCl |
(3)步骤④发生时有红棕色气体生成,写出发生的化学反应方程式,并标出电子转移的方向和数目
(4)步骤⑦得到的溶液中含
 和HCl,为了进一步得到晶体
和HCl,为了进一步得到晶体 ,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾(
,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾( )成品。
)成品。①蒸发浓缩需要控制温度75℃附近的原因
②洗涤操作中,用乙醇洗涤相比于用蒸馏水洗涤的优势是
A.减小固体的溶解损失
B.除去固体表面吸附的杂质
C.乙醇挥发带走水分,使固体快速干燥
③实验室进行以上步骤不需要用到的仪器是
A.  B.
B.  C.
C.  D.
D.
您最近一年使用:0次



